直径≤5 cm的临床早中期非小细胞肺癌纵隔淋巴结转移数学预测模型的建立
2020-01-10范懿魏任卫东史宏灿束余声陆世春孙超王霄霖
范懿魏 任卫东 史宏灿 束余声 陆世春 孙超 王霄霖
扬州大学临床医学院胸外科225001
随着人们健康意识的增强和低剂量胸部CT在临床的广泛应用,早期肺癌的检出率明显提高。据报道新诊断的肺癌病例中80%以上为直径≤5 cm的临床早中期肺癌[1]。对于没有远处转移的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者而言,根治性手术是获得最佳预后的理想治疗方案。但对于有纵隔淋巴结转移的Ⅲ期患者,即使接受了手术治疗,其术后复发转移和死亡的风险仍较高。从治疗角度看,Ⅲ期肺癌可为可切除和不可切除两大类。虽然目前外科手术技术不断进步,但对于可切除的局部晚期NSCLC(Ⅲa/N2)患者而言,单纯手术切除术后5年生存率仅20%~35%[2],且术后复发及远处转移率皆较高。近年来对于Ⅲa/N2期NSCLC患者的治疗理念已经从手术切除+术后辅助化疗逐渐转变为新辅助治疗或者根治性同步放化疗后再行手术[3]。因此,准确的术前分期,特别是对纵隔淋巴结转移情况的精准评估,这对肺癌的治疗及预后具有重要意义。
有报道称Ⅲa/N2期NSCLC约占所有NSCLC的25%~33.3%[4],考虑到有创操作的潜在风险、病理结果的假阴性及经济状况等客观因素,这一比例并不值得临床医师对所有NSCLC患者在术前常规进行纵隔淋巴结准确分期。因此如何在术前识别纵隔淋巴结转移高风险患者,并指导临床医师进行无创和/或侵入性的检查成为推进术前分期的关键。这也使得进行术前纵隔淋巴结转移风险评估及建立预测模型显得更有价值。
近年来国内外学者通过对NSCLC患者资料的分析研究,建立了相关数学预测模型,如VA模型[5]、Fudan模型[6]。但这两个模型建立时间较早,且都没有进行外部病例的验证,限制了其应用价值。本研究拟在前人研究的基础上,结合本地区NSCLC患者的临床资料和影像特征,遴选出对直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移具有统计学意义的敏感而可靠的独立危险因素,构建数学预测模型,预测纵隔淋巴结转移的概率,为制定其最佳诊疗决策提供重要的数据支持和临床可行性分析。
1 对象与方法
1.1 研究对象 回顾性分析2012年1月至2017年8月扬州大学临床医学院胸外科收治的经手术治疗的NSCLC患者737例。经过筛选,符合入组标准的共608例,入组患者均签署知情同意书。将入组的病例以3∶1的比例分为2组,分组方法采用SPSS随机数字生成器分组法。前者为建模组456例,用于建立模型;后者为验证组152例,用于进行模型的外部验证及与其他模型的比较。入组标准:(1)肿瘤直径≤5 cm,且病理明确诊断为NSCLC;(2)术前CT显示纵隔淋巴结直径≤1 cm且排除远处转移;(3)经手术治疗并接受系统纵隔淋巴结清扫或采样;(4)单发病灶。排除标准:(1)证实有纵隔淋巴结转移或远处转移;(2)术前接受新辅助治疗、靶向或其他治疗;(3)既往有肺癌病史;(4)转移性肺癌;(5)病例资料不完整者。本研究符合 《赫尔辛基宣言》的原则。
1.2 临床病史资料 统计患者的一般资料,包括性别,年龄,临床症状(包括咳嗽、痰血、胸痛、消瘦等),吸烟史,吸烟量,既往肿瘤史,肺癌家族史,肺部基础病史(COPD、肺结核、支气管扩张等)。其中,有吸烟史为就诊时未戒烟、己戒烟但既往曾吸烟。肺癌家族史仅限与患者具有血缘关系的直系亲属。
1.3 影像学特征 统计患者的影像学资料,包括肿瘤部位(左肺或右肺、上叶或中下叶、周围型或中央型),肿瘤直径,特征性影像学表现(分叶、边界、毛刺、胸膜牵拉征)。本研究术前CT影像学评估由2位高年资主治及以上职称的影像科医师进行。肿瘤中心位于肺实质内1/3范围者为中央型肺癌,位于肺实质外2/3范围者为周围性肺癌。肿瘤直径指CT测量的肿瘤最大横断面长径,单位为cm。
1.4 病理结果及淋巴转移情况 统计患者术后病理情况(病理类型、分化程度、脉管浸润),淋巴转移情况(累及站数及个数)。病理分期依据国际肺癌研究学会更新的第八版肺癌TNM分期标准[7]。病理类型分为腺癌或腺鳞癌及非腺癌(鳞癌、类癌、大细胞癌等)。淋巴结分组方法参照MD-ATS肺癌区域淋巴结分布图[8]。系统淋巴结清扫的标准为:清扫上纵隔淋巴结(右侧2R和4R组,左侧第4L、第5和第6组)、隆凸下淋巴结(第7组)、下纵隔淋巴结(第8和第9组)、肺内淋巴结(第11、12组)、肺门淋巴结(第10组),清扫至少3站纵隔淋巴结,6个以上纵隔淋巴结。
1.5 统计学分析 采用SPSS 23.0软件进行统计分析。在单因素分析中,计量资料以表示,符合正态分布、方差齐的计量资料,组间比较采用独立样本t检验,不符合正态分布的计量资料间比较采用秩和检验;计数资料以例数(百分比)表示,组间比较采用Pearson'sχ2检验或Fisher's精确检验。建模组资料通过单因素分析法判断影响直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的危险因素,P<0.2的变量进入多因素分析[9]。通过多因素Logistic回归后退分析法遴选出判断直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的独立危险因素。根据筛选得到的条件建立二元Logistic回归数学模型。采用Hosmer-Lemeshow拟合优度检验评估模型的拟合程度。通过受试者工作特征曲线下面积(area under the curve,AUC)评估预测模型的准确性。通过约登指数确定最佳cut-off值。验证组患者资料带入本模型,利用χ2检验判断纵隔淋巴结转移实际与预测的一致程度,并用Kappa值评价一致率。针对各模型的不同危险因素,将验证组资料带入各模型,计算AUC,比较各模型的预测能力。
2 结果
2.1 淋巴结转移情况 建模组患者中男240例(52.63%),女216例(47.37%);年龄(60.14±9.62)岁,年龄范围为28~82岁。所有患者均行手术治疗,并接受系统纵隔淋巴结清扫或采样。清扫纵隔淋巴结站数为(3.95±0.79)站。其中有纵隔淋巴结转移的共55例(12.06%),按是否有纵隔淋巴结转移分为转移组即p N2(+)组和未转移组即p N2(-)组。
2.2 单因素分析结果 单因素分析显示p N2(+)组和p N2(-)组患者年龄分别为(57.45±6.94)岁和(60.51±9.88)岁,差异有统计学意义(t=2.88,P=0.008)。p N2(+)组和p N2(-)组患者肿瘤直径分别为(3.10±0.87)cm和(2.44±1.08)cm,差异有统计学意义(t=-4.38,P<0.001)。中央型患者出现纵隔淋巴结转移的概率明显高于周围型患者(19.75%比10.97%,χ2=3.14,P=0.076)。肿瘤位于中下叶患者纵隔淋巴结转移的概率高于上叶(15.60%比8.82%,χ2=4.92,P=0.027)。胸部CT见有胸膜牵拉征的患者纵隔淋巴结转移概率高于无牵拉征者(17.51%比8.60%,χ2=8.11,P=0.004)。病理类型为腺癌或腺鳞癌的患者纵隔淋巴结转移的概率高于非腺癌患 者(13.37%比7.22%,χ2=2.73,P=0.099)。术后病理有脉管浸润患者纵隔淋巴结转移概率高于无脉管浸润者(38.10%比10.80%,χ2=11.61,P=0.002)。见表1。由于本研究建立模型的意义是前瞻性预测直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的概率,因此最终纳入多因素Logistic回归的变量应为术前可明确的指标,故脉管浸润未纳入多因素分析。
2.3 多因素Logistic回归分析结果 上述6项危险因素纳入多因素Logistic回归分析,结果显示患者年龄、肿瘤直径、肿瘤部位(中央型或周围型)、胸膜牵拉征、病理类型5项因素在直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移中的差异有统计学意义,是判断直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的独立危险因素(表2)。
2.4 建立数学预测模型 通过对建模组资料进行相关分析,建立的数学预测模型为P=ex/(1+ex),x=-2.831+(0.825×肿瘤直径)+(1.53×中央型)+(0.779×胸膜牵拉征)+(1.883×病理类型)-(0.06×年龄),其中e为自然对数,年龄单位为年,肿瘤直径单位为cm。肿瘤部位中“1”代表中央型,“0”代表周围型。病理类型中“1”代表腺癌或腺鳞癌,“0”代表非腺癌。胸膜牵拉征中 “1”为有,“0”为无。Hosmer-Lemeshow拟合优度检验显示预测值和观察值之间比较,差异无统计学意义(P=0.139)。
2.5 受试者工作特征曲线及cut-off值的选取 本研究模型的AUC为0.763(95%CI:0.697~0.829),见图1。本研究的约登指数为0.419,但本研究旨在术前预测纵隔淋巴结转移风险,提高术前高风险患者的筛查能力,所以在cut-off值的选取上对敏感度要求更高,综合考虑后设定本研究的最佳cut-off值为0.3。当P>0.3时为纵隔淋巴结转移高风险患者,P≤0.3时为低风险患者。
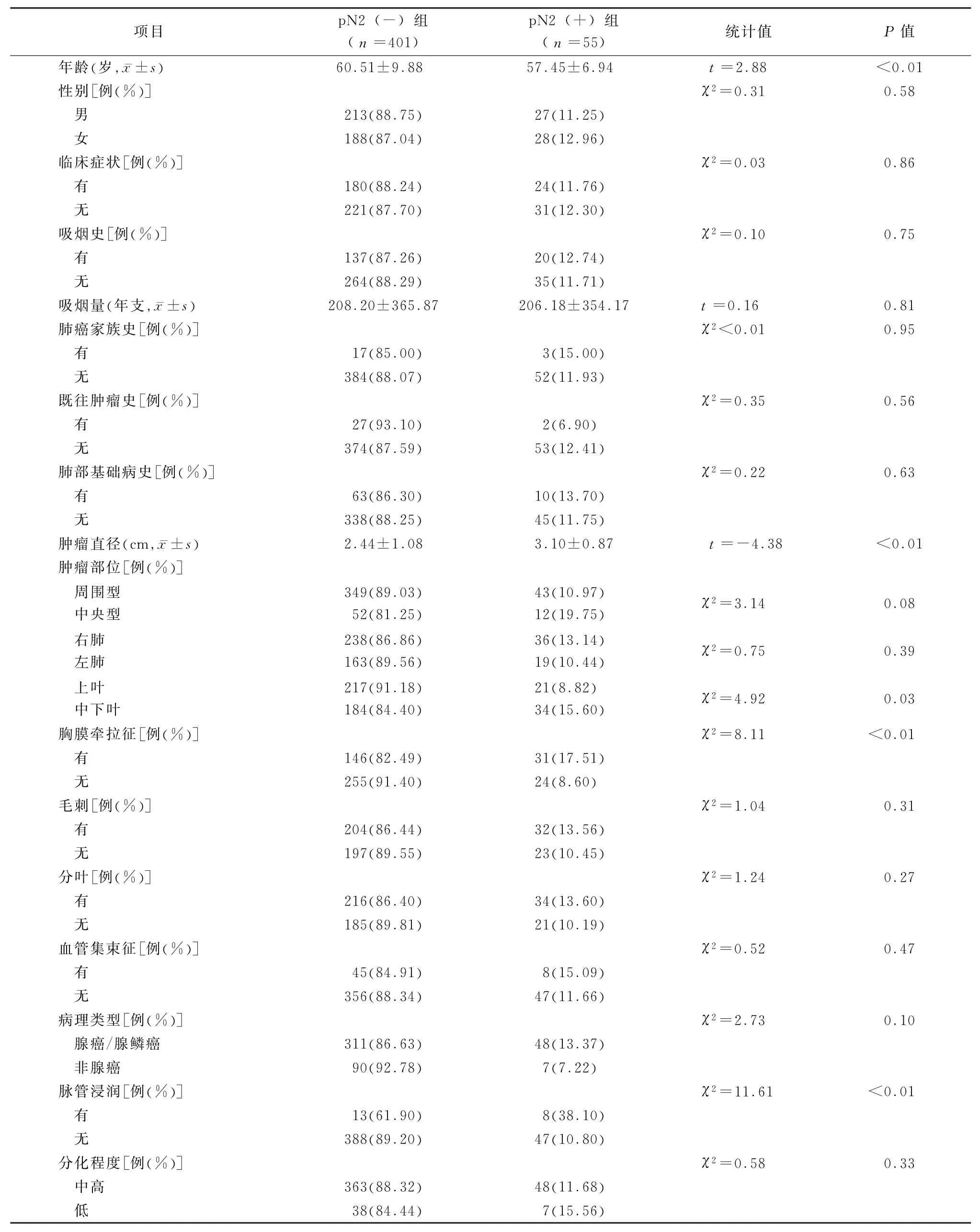
表1 建模组患者单因素分析结果
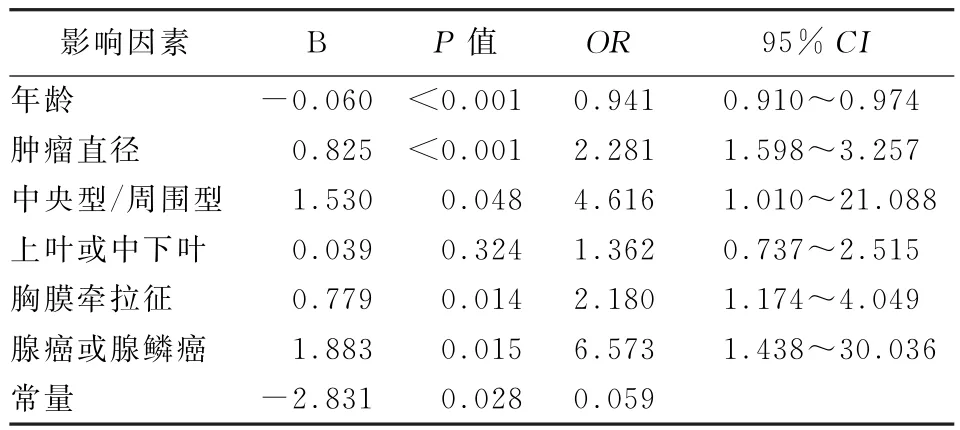
表2 建模组患者多因素分析结果
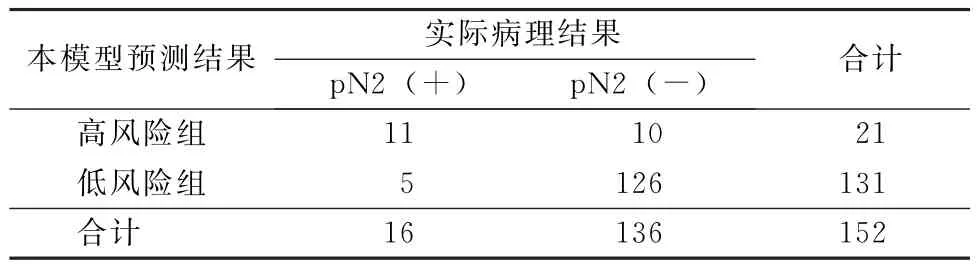
表3 验证组患者一致性检验情况分析结果(例)
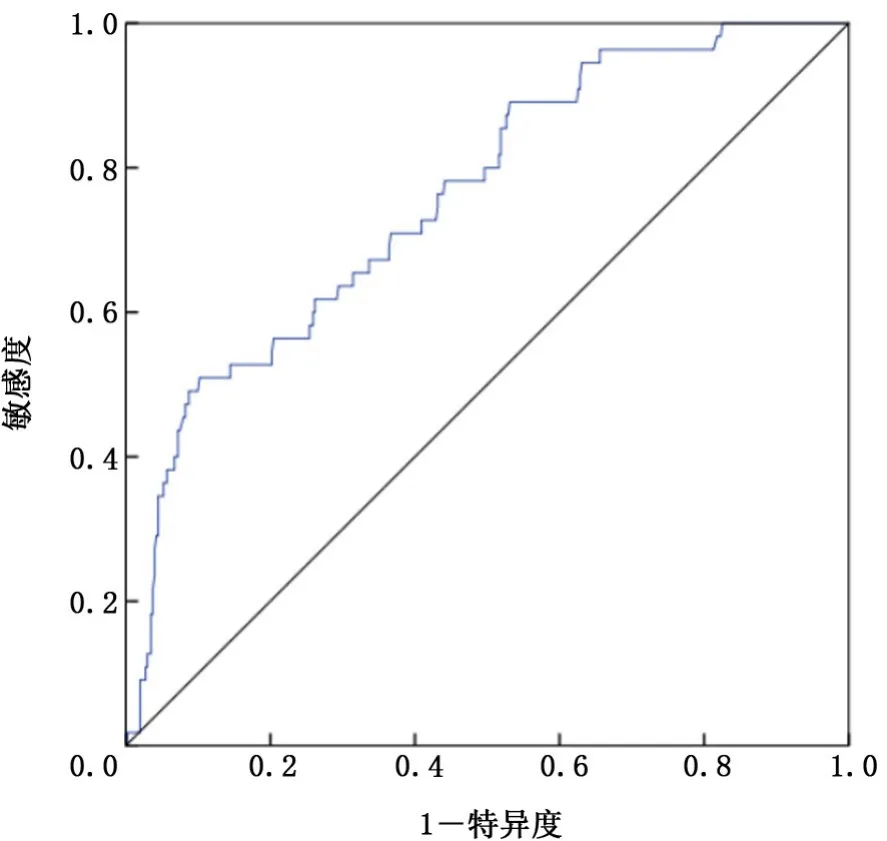
图1 本研究模型的受试者工作特征曲线
2.6 数学模型的一致性验证 验证组患者中男82例(53.95%),女70例(46.05%);年龄(61.41±9.21)岁,年龄范围为32~79岁。清扫纵隔淋巴结站数为(3.93±0.8)站。其中有纵隔淋巴结转移的共16例(10.53%)。将验证组资料代入本研究模型中,以P=0.3为cut-off值。本组资料中纵隔淋巴结转移高风险患者21例(13.82%),低风险患者131例(86.18%),预测结果与实际病理结果进行交叉分析评价一致性。由表3可以得出,该模型的敏感度为68.75%(11/16),特异度为92.65%(126/136)。一致性检验Kappa值为0.54(95%CI:0.336~0.744,P<0.001),具有中等强度一致性。
2.7 各模型间的比较 本研究建立的模型为x=-2.831+(0.825×肿瘤直径)+(1.53×中央型)+(0.779×胸膜牵拉征)+(1.883×病理类型)-(0.06×年龄)。VA模型为x=-1.806+(0.955×腺癌)+(0.876×异常胸片)+(0.749×中央型)+(0.485×临床症状)+(0.435×肿瘤直径)-[0.408×(年龄>65)][5]。Fudan模型为x=-3.449+(1.018×肿瘤直径)+(1.164×中心型)+(1.263×腺癌)-(0.026×年龄)[6]。
将验证组资料带入本模型及VA模型中,绘制ROC曲线并计算AUC,本模型的AUC(0.769,95%CI:0.615~0.924)高于VA模型(0.665,95%CI:0.516~0.814),见图2。由于Fudan模型研究对象是肿块直径≤3 cm的NSCLC患者,所以选取验证组中直径≤3 cm患者101例,对本模型和Fudan模型进行比较,本模型的AUC(0.722,95%CI:0.52~0.924)高于Fudan模型(0.714,95%CI:0.53~0.898),见图3。
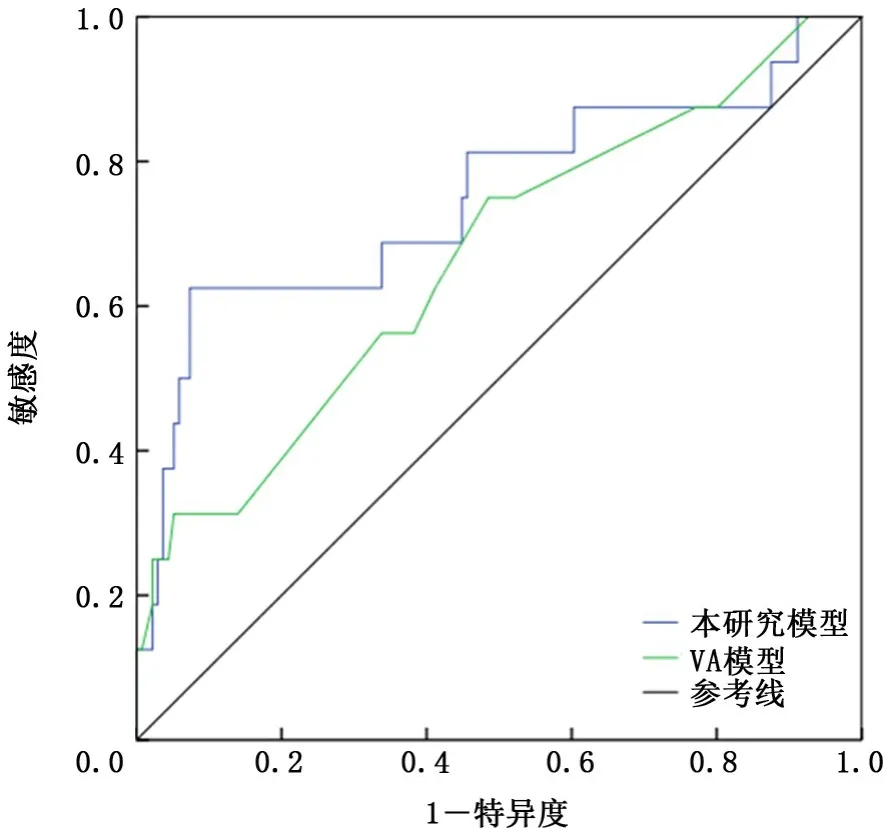
图2 验证组资料在本模型和VA模型中验证的受试者工作特征曲线比较
3 讨论
过去的30年中,疾病预测模型在公共卫生和临床医学领域不断发展,除了最初的心血管病外,高血压、糖尿病、癌症等其他疾病研究领域也都开始了对预测模型的探索[10]。预测模型很重要的一个应用是对人群疾病发病风险按照概率大小进行分层,如高危和低危,对风险概率不同的群体进行有针对性的处理。临床工作者在临床实践中应用预测模型,可以快速准确的筛选出高危患者,进行有针对性的干预。
本研究通过对建模组资料的分析,筛选出年龄、肿瘤部位(中央型或周围型)、肿瘤直径、胸膜牵拉征、病理类型这5项独立危险因素。我们发现年龄越小、肿瘤直径越大、中央型肿瘤、有胸膜牵拉征、腺癌或腺鳞癌的患者发生纵隔淋巴结转移的概率越大,这与国内外文献中相关报道类似[11-15]。但本研究较其他模型增加了影像学特征的分析,结果显示胸膜牵拉征是直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的独立危险因素。胸膜牵拉征是由于肿瘤内反应性纤维化、瘢痕形成,收缩牵拉临近脏层胸膜所致。有学者认为原发肿瘤病灶若发生局部胸膜侵犯会对淋巴结转移造成影响,这可能与肿瘤的局部微转移有关[14]。本研究中有胸膜牵拉征的患者纵隔淋巴结转移概率明显高于无牵拉征者(17.51%比8.60%,P=0.004)。
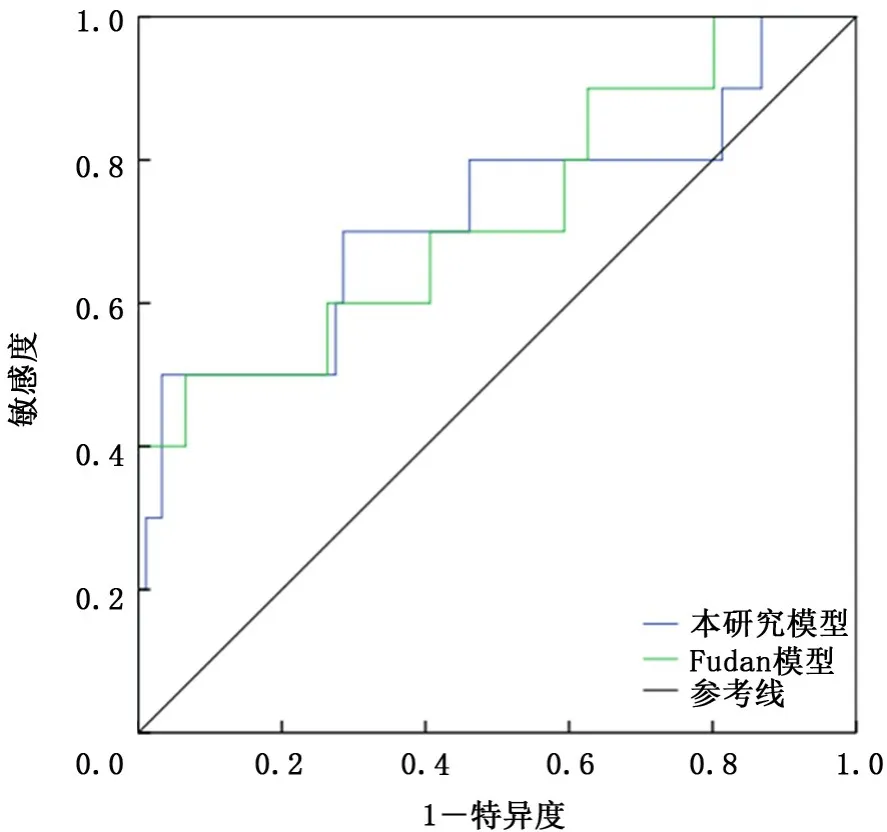
图3 验证组资料在本模型和Fudan模型中验证的受试者工作特征曲线比较
在与其他两个模型的比较中,我们发现本研究建立的数学预测模型的准确率更高。VA模型的样本中只有不到一半的患者接受了CT扫描。而X线胸片对纵隔淋巴结转移的敏感度及特异度均较低,这限制了其模型的预测能力和准确性。同时该模型认为肿瘤直径≥3.6 cm以及年龄≤65岁是纵隔淋巴结转移的独立危险因素,且在模型中这两个变量为二分类变量,这使得不同年龄、不同肿瘤大小的患者很难通过此模型得到一个精确的个体化预测概率值。而且本研究发现年轻的患者出现侵袭性的可能性更高,所以65岁的cut-off值可能导致较多的假阴性结果。Fudan模型研究对象是肿块直径≤3 cm的NSCLC患者,而本模型的研究对象是直径≤5 cm的临床早中期NSCLC患者,较Fudan模型适用范围更广。同时本模型较Fudan模型增加了影像学特征的分析,准确性较之更高。
本研究模型与用于计算孤立性肺结节良恶性的临床预测模型类似[17-18]。孤立性肺结节良恶性预测模型已广泛应用,并被肺结节诊治中国专家共识(2018年版)[19]推荐使用,甚至已有相关应用软件被开发。本研究设计的模型将在手术前给患者和临床医师提供治疗决策的支持。有研究表明,目前用于评估纵隔淋巴结转移的检查方式包括单一检查(胸部CT)、双重检查(胸部CT+PET/CT)或三重检查(胸部CT+PET/CT+有创检查)。尽管很多学者推荐采用双重或三重方法进行分期,但有数据显示采用双重方法分期的患者不到30%,而采用三重方法进行分期的患者仅为5%[20]。本预测模型对符合要求的NSCLC患者进行术前纵隔淋巴结转移的预测,对筛选出的高风险患者建议进一步明确纵隔淋巴结性质。对检查方法的选择,我们的建议是既要考虑所在医院的硬件设施及技术水平,又要考虑患者的经济、健康状况。
在设置cut-off值时,我们需要权衡假阳性和假阴性结果出现的危害。假阳性结果会造成不必要的有创检查和加重患者的紧张情绪。而假阴性结果往往会造成过度手术,增加患者的痛苦。本研究设置的cut-off值为0.3。对此不同的外科医师可能选择不同的cut-off值,但不可否认的是本模型提供了量化的预测概率,可以将其纳入决策过程,并有助于诊断策略的成本效益选择。
随着预测模型的不断深入研究,越来越多的影响因素将被纳入,模型的准确性将会大大提升。尽管数学预测模型并不能够代替病理诊断,但不容否认,它为直径≤5 cm的临床早中期NSCLC纵隔淋巴结转移的判断提供了更加客观的依据,成为一种重要的临床评估手段,对诊断与治疗方案的选择具有重要价值和临床应用潜力。
利益冲突所有作者均声明不存在利益冲突
