肺栓塞患者炎症指标与CT肺动脉阻塞指数的关系
2020-01-10周怀海秦志强覃少佳刘学冠陈桂荣冯广弘冯宗莲梁秋妹
周怀海 秦志强 覃少佳 刘学冠 陈桂荣 冯广弘 冯宗莲 梁秋妹
1广西壮族自治区人民医院呼吸内科,南宁530021;2广西来宾市人民医院呼吸内科546100;3广西河池市人民医院呼吸内科547000
肺栓塞(pulmonary embolism,PE)患者合并血液动力学紊乱或者严重并发症时,具有较高的病死率[1]。传统观点认为,血栓形成与炎症反应是两个相互独立的病理生理过程。随着对现代分子生物学的研究发现,血栓发生常伴有血管内皮细胞的损伤、血小板的活化及多种炎症因子的释放。可见,炎症反应与PE的发生、发展有非常密切的联系。研究发现,PE伴随血管内皮细胞的损伤、氧化应激等炎症反应,认为IL-6可用于PE早期诊断及预后评估[2]。中性粒细胞与淋巴细胞计数的比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞计数的比值(platelet to lymphocyte ratio,PLR)作为炎症评估的新指标,与白细胞计数(white blood cell,WBC)相比,NLR与PLR在炎症诊断及其风险评估中的作用更准确[3-4],在PE预后评估中也有重要价值[5]。CT肺动脉阻塞指数(pulmonary artery obstruction index,PAOI)主要通过CT肺动脉造影(computed tomographic pulmonary angiography,CTPA)检查评估,具有较好的可重复性和客观性,在评估PE的严重程度、治疗效果及预后等具有重要的临床意义[6-9]。因此推测,炎症指标与PAOI具有一定的相关性,甚至能作为PAOI的预测指标,评估急性PE的严重程度及指导治疗。但是,既往的研究尚未进一步明确炎症指标与PAOI的相关性。本研究通过检测急性PE患者WBC、中性粒细胞计数、淋巴细胞计数、NLR、PLR及IL-6水平,分析以上炎症指标与PAOI的关系。
1 对象与方法
1.1 研究对象 收集2015年6月至2017年2月在广西壮族自治区人民医院、广西来宾市人民医院、广西河池市人民医院呼吸内科住院的PE连续病例。入选标准:(1)年龄≥18岁;(2)CTPA检查首次确诊PE且未行溶栓或抗凝治疗;(3)完成14 d治疗及随访;(4)无溶栓和抗凝治疗禁忌证。排除标准:(1)拒绝治疗;(2)溶栓或抗凝治疗不足14 d,未完成随访;(3)合并溶栓或抗凝治疗禁忌证;(4)预期生存时间不足14 d;(5)合并其他可能影响血细胞计数的疾病,如肺炎、泌尿系统感染等,并结合临床表现、辅助检查等综合分析;(6)合并严重的肝肾疾病,以及目前接受免疫抑制治疗(包括类固醇)。本研究通过广西壮族自治区人民医院医学伦理委员会审查(伦理20150302),并获得患者及家属知情同意。
1.2 炎症指标检测与方法
1.2.1 WBC、中性粒细胞、淋巴细胞、血小板计数检测 (1)标本采集:治疗前24 h内和治疗后第14天空腹采集外周静脉血5 ml,分离标本低温保存待测。标本统一送至广西壮族自治区人民医院检测。(2)检测方法:流式细胞计数法,WBC正常参考值为(3.6~10.0)×109/L,中性粒细胞计数正常参考值为(1.7~7.0)×109/L,淋巴细胞计数正常参考值为(0.7~4.0)×109/L,血小板计数正常参考值为(100~400)×109/L。
1.2.2 IL-6的检测 (1)标本采集:治疗前24 h内和治疗后第14天空腹采集外周静脉血5 ml,离心取上清-80℃保存待测。(2)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测:选用Abcam IL-6 High Sensitivity Human ELISA试剂盒。
1.3 CTPA与PAOI评分
1.3.1 CTPA检查时间 治疗前24 h内及治疗后第14天行CTPA检查。
1.3.2 PE诊断标准 根据2014年欧洲心脏病协会急性PE诊断和治疗指南[1]。直接征象为肺动脉内造影剂充盈缺损,伴或不伴 “轨道征”的血流阻断,或完全充盈缺损,远端血管不显影;间接征象有肺动脉造影剂流动缓慢,局部低灌注,静脉回流延迟。
1.3.3 PAOI评分 采用Mastora评分[10]。根据肺动脉内有无栓子、血管阻塞程度及栓子的数量,对5支纵隔肺动脉、6支肺叶动脉和20支肺段动脉将血栓栓塞程度分为5个评分等级:1分,<25%;2分,25%~49%;3分,50%~74%;4分,75%~99%;5分,100%。PAOI=[∑(n×d)/S]×100%,n为血栓的肺动脉数量(1≤n≤31),d为肺动脉截面阻塞程度(1≤d≤5),S为最大阻塞分值(155分)。
1.4 治疗方案 根据2014年欧洲心脏病协会急性PE诊疗指南[11]制定分组及治疗意见。高危组溶栓+抗凝治疗:尿激酶20 KU/kg持续静脉滴注2 h,溶栓结束后每2~4 h测定1次血浆凝血酶原时间或活化的部分凝血溶酶时间,测定值水平低于正常值上限的2倍时,开始给予低分子肝素抗凝治疗。中低危组和低危组抗凝治疗:低分子肝素重叠使用华法林1~3 d,低分子肝素、华法林剂量根据每日复查国际正常比值调整,直至国际正常比值在2~3之间并持续2 d或者出现1次国际正常比值≥3,即停用低分子肝素,单用华法林。中高危组:根据PE患者个体差异选择溶栓+抗凝或单独抗凝治疗。
1.5 统计学分析 采用英文版SPSS 16.0统计分析。计量资料行正态性检验,正态分布资料以表示;同一指标治疗前后计量资料比较用配对t检验;两者之间的相关性分析选用Pearson相关性分析。PAOI变化率=(治疗前后PAOI差值的绝对值/治疗前PAOI)×100%。P<0.05为差异有统计学意义。
2 结果
2.1 人口统计学基线资料 本研究共收集到经CTPA首诊PE 67例,其中20例剔除出本研究(12例未完成随访,7例合并肺炎,1例合并泌尿系统感染)。最终47例符合入选标准纳入研究,其中男31例,女16例;年龄(65.72±15.43)岁,年龄范围为21~88岁。
2.2 治疗前后指标比较 治疗后第14天,PE患者WBC、中性粒细胞计数、NLR、IL-6等主要炎症指标较治疗前明显下降(P值均<0.001),淋巴细胞计数较治疗前明显升高(t=-3.886,P<0.001),PLR与治疗前比较差异无统计学意义(t=-0.812,P=0.421)(表1)。
2.3 炎症指标与PAOI的关系
2.3.1 治疗前炎症指标与PAOI的相关性 治疗前PAOI与WBC、中性粒细胞计数、NLR和IL-6水平均呈中度正相关性(P值均<0.05),见图1;与淋巴细胞计数、PLR均无相关性(P值均>0.05)。
表1 肺栓塞患者治疗前后炎症指标比较(n=47,)
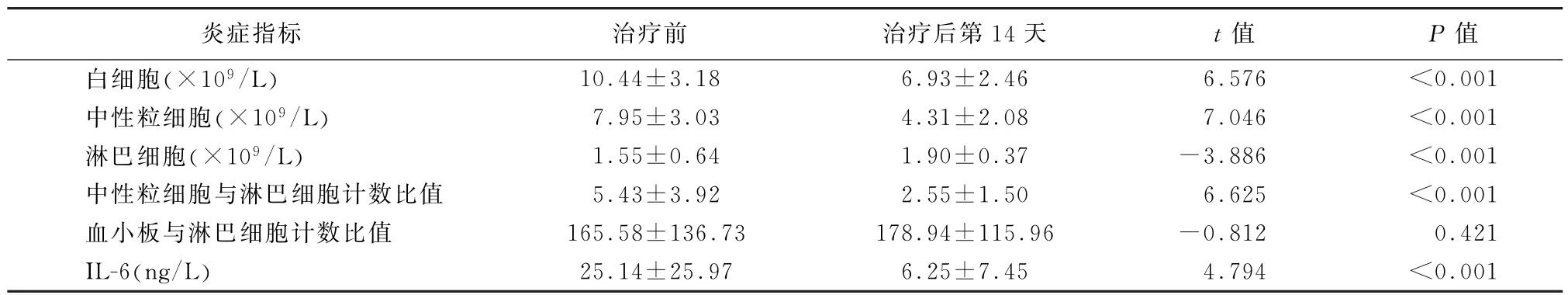
表1 肺栓塞患者治疗前后炎症指标比较(n=47,)
炎症指标 治疗前 治疗后第14天 t值 P值白细胞(×109/L) 10.44±3.18 6.93±2.46 6.576 <0.001中性粒细胞(×109/L) 7.95±3.03 4.31±2.08 7.046 <0.001淋巴细胞(×109/L) 1.55±0.64 1.90±0.37 -3.886 <0.001中性粒细胞与淋巴细胞计数比值 5.43±3.92 2.55±1.50 6.625 <0.001血小板与淋巴细胞计数比值 165.58±136.73 178.94±115.96 -0.812 0.421 IL-6(ng/L) 25.14±25.97 6.25±7.45 4.794 <0.001

图1 治疗前炎症指标与PAOI的相关性 A:白细胞计数与PAOI的相关性;B:中性粒细胞计数与PAOI相关性;C:NLR与PAOI相关性;D:IL-6水平与PAOI相关性
2.3.2 治疗后炎症指标与PAOI的相关性 治疗后PAOI与IL-6水平呈中度正相关性(r=0.498,P<0.001),见图2;与WBC、中性粒细胞计数、淋巴细胞计数、NLR和PLR均无相关性(P值均>0.05)。

图2 治疗后第14天IL-6水平与PAOI相关性
2.3.3 治疗前炎症指标与PAOI变化率的相关性 治疗前后PAOI变化率与治疗前NLR呈中度负相关性(r=-0.352,P=0.015),见图3;与治疗前淋巴细胞计数呈中度正相关性(r=0.335,P=0.021),见图4;与治疗前WBC、中性粒细胞计数、PLR和IL-6水平无相关性(P值均>0.05)。

图3 治疗前NLR与PAOI变化率相关性
3 讨论
WBC是全身炎症反应的标记。PE患者WBC可能通过损伤内皮细胞、释放炎症因子和趋化因子,激活凝血系统,从而促进血栓形成。同时,WBC与纤维蛋白原、凝血因子Ⅶ及Ⅷ的水平密切相关,WBC升高提示血液高凝状态,高凝状态的血液又能加重局部炎症反应,两者的相互作用形成级联放大效应,加快血栓形成[12]。Kundi等[13]对646例PE患者研究发现,高危组WBC明显高于低危组(P<0.001),多变量回归分析发现WBC与肺栓塞严重指数显著相关(r=0.495,P=0.015),认为WBC可作为PE严重程度的评估指标。同样,Venetz等[14]的研究报道,PE患者WBC<5.0×109/L或>12.6×109时,30 d累积病死率最高(P<0.001);逻辑回归分析显示,WBC<5.0×109/L(OR=1.34,95%CI:1.07~1.68)或>12.6×109/L(OR=1.29,95%CI:1.10~1.51)时,30 d再入院率显著增加(P=0.002),提出WBC是评估PE早期危险及其近期预后的重要指标。本研究发现PE患者治疗后第14天WBC较治疗前明显下降,推测PE发生早期伴随炎症反应,随着治疗的进行,肺动脉血栓的不断溶解减少,局部的炎症反应逐渐降低,相应治疗后的WBC呈下降趋势,从而使治疗后WBC较治疗前显著下降。本研究进一步发现,Paerson相关系数分析表明治疗前WBC与治疗前PAOI呈中度正相关性,而治疗后WBC与PAOI值无相关性(P=0.197),治疗前WBC与治疗前后PAOI变化率无相关性(P=0.915)。因此,PE患者治疗前WBC水平可以预测治疗前PAOI值,提示治疗前WBC越高,肺动脉阻塞程度越严重,而WBC水平能否预测治疗前后PAOI的变化情况有待进一步的观察研究。

图4 治疗前淋巴细胞计数与PAOI变化率相关性
NLR作为新的炎症指标,与WBC相比,涵盖了两类白细胞亚型的信息,反映了机体内中性粒细胞和淋巴细胞水平的平衡状态及全身性炎症反应程度,是全身炎症反应的重要标志。炎症反应可刺激中性粒细胞的产生,加快淋巴细胞的凋亡,因此相对较单一的白细胞亚型指标,NLR对疾病的病情及预后具有更高的预测价值[15]。Ates等[16]对639例PE患者的回顾性研究发现,中性粒细胞计数和NLR在大面积PE组、次大面积PE组和非大面积PE组的比较中均逐渐降低(P<0.01),大面积PE组淋巴细胞计数较次大面积PE组及非大面积PE组显著减少(P<0.01),受试者工作特征曲线分析发现NLR对大面积PE的诊断效率较高(AUC±SE=0.893±0.013,P<0.01),提出NLR对PE的诊断及其严重程度的评估具有重要意义。本研究发现PE患者治疗后第14天的中性粒细胞计数、NLR较治疗前均明显下降,淋巴细胞计数较前明显升高。同时,治疗前的PAOI与中性粒细胞计数及NLR呈中度正相关性,而与淋巴细胞计数无相关性。因此推测,PE形成初期伴随较高水平的炎症反应,中性粒细胞活化增殖明显,淋巴细胞作为抗炎细胞在抗炎症反应过程中被大量消耗减少,即使淋巴细胞不断增殖补充,但并不能完全抵消抗炎消耗的部分,从而使得NLR与PAOI呈正相关性。进一步分析发现,治疗前后PAOI变化率与治疗前NLR呈负相关性,与治疗前淋巴细胞计数呈正相关性,表明治疗前NLR越低,淋巴细胞计数越高,PE患者的近期血栓溶解效果越好。因此,中性粒细胞计数、淋巴细胞计数、NLR对PE患者的血栓栓塞严重程度预测及近期血栓溶解效果评估具有一定临床指导意义。
PLR是评价炎症反应的新指标[18]。近期研究发现,PLR与PE患者早期死亡风险有关,死亡组PLR明显高于存活组(P=0.01),表明PLR在PE早期死亡风险及其预后评估具有重要价值[5,13]。然而,本研究发现PE患者治疗前后PLR比较,差异无统计学意义,PE患者治疗前后PLR与治疗前后PAOI及其变化率均无相关性。同样,Günay等[18]对大面积组与次大面积组PE患者的血小板计数(platelet,PLT)比较,差异无统计学意义,相关性分析发现PLT与PAOI无相关性。此外,Ertem等[19]在对294例急性PE患者的早期病死率研究中发现,死亡组与存活组的PLT与PLR分别比较,差异均无统计学意义(P值均>0.05),提出PLR尚不能用于PE的预后评估。同样,Ma等[20]研究表明,PLR与PE患者30 d病死率有关,但多变量分析发现PLR不能作为PE预后的独立风险因子(OR=1.002,95%CI:0.997~1.008),认为PLR对PE预后预测能力下降,在单变量分析中观察到的PLR预后价值可能不是30 d病死率的独立预测因子。对于上述研究结果及结论的不一致,考虑可能与各研究分析PAOI与PLR关系的方法不同有关。因此,血栓形成与炎症反应并非两个完全独立的过程,PLT作为凝血纤溶系统指标在血栓形成过程中被大量消耗,淋巴细胞作为炎症指标在炎症反应过程中减少,PLR同时兼顾PE发病过程中的两种重要机制。此外,考虑到PE并发症的严重性,PLR在cut-off值的敏感度相对较低,所以推测PLR可能不是评估PE预后的良好指标。
IL-6主要由激活的单核巨噬细胞、Ⅱ型肺泡上皮细胞和T淋巴细胞等产生。Halici等[2]研究发现,PE患者IL-6水平明显高于健康对照组(P=0.038),治疗后IL-6水平较治疗前明显下降(P=0.05),认为炎症反应与内皮细胞损伤是血栓形成机制中的重要组成部分。本研究发现PE患者治疗后14 d IL-6水平较前明显下降,与虞宇楠等[21]和段亚敏等[22]的研究报道一致。因此认为,血栓形成初期,高水平的IL-6代表机体的早期炎症状态,IL-6可以用于PE的早期病情评估。多中心研究发现,中心静脉血栓患者IL-6水平比外周静脉血栓患者明显增高(P<0.05),并且IL-6水平与深静脉血栓形成患者的Villalta评分值呈正相关性,考虑到Villalta评分可直接反映深静脉血栓形成的严重程度,同时深静脉血栓形成患者血栓面积越大,IL-6浓度水平越高,提出IL-6水平可以评估血栓栓塞程度[23]。本研究发现,PE患者治疗前IL-6水平与PAOI呈中度正相关性,笔者分析认为,阻塞血管支配的远端肺组织因缺血、缺氧而发生病理生理改变,包括激活中性粒细胞、单核/巨噬细胞及淋巴细胞,并诱导细胞因子包括IL-6及肿瘤坏死因子等炎症因子的表达,从而激活凝血纤溶系统及促进血栓形成。同时在炎症初期,IL-6等细胞因子在中性粒细胞活化中起重要的作用,进一步加强机体的炎症损伤,形成恶性循环,促进血栓形成。本研究通过随访发现,随PE病情好转,IL-6水平较前显著下降,考虑PE血栓形成后促炎细胞因子的大量合成随着血栓的溶解吸收及炎症反应水平而降低,IL-6合成释放减少,血液高凝状态改善,机体抗栓能力增强。本研究还发现,PE患者治疗后IL-6水平与治疗后PAOI呈中度正相关性,表明治疗后IL-6水平可以反映PE患者治疗后的残余血栓栓塞程度,间接评估PE患者的近期血栓溶解效果,评估PE患者的预后。因此,IL-6不仅可以反映PE患者的血栓严重程度,而且可以在一定程度上预测肺动脉栓子溶解吸收及其残余血栓情况,为临床医师判断PE治疗效果及其预后提供新的量化指标。
综上所述,本研究发现PE患者WBC、中性粒细胞计数、NLR和IL-6水平均与PAOI存在一定相关性,尤其是IL-6水平与PAOI相关性较高,可以较好地反应PE患者的血栓栓塞严重程度。NLR越低、淋巴细胞计数越高,血栓溶解效果越显著,对于预测血栓溶解程度具有一定的临床意义。另外,本研究还发现PLR与PAOI无相关性,对于PLR可否作为PE严重程度的预测指标有待进一步的研究。
利益冲突所有作者均声明不存在利益冲突
