基于深孔板培养高通量筛选rakicidin B1高产菌的研究
2019-12-30周剑江红林风
周剑 江红 林风
(福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州 350007)
Rakicidins是微生物来源的15元环脂肽化合物,其结构中含1个极为罕见的4-氨基-2,4-戊二烯酸辛酰胺[1-2]。目前已分离的rakicidins类化合物主要含有rakicidin A、 A1、B、B1及H、I、J等[3-6]。研究表明rakicidins类化合物具有广谱抗肿瘤细胞、乏氧选择性抗肿瘤细胞、抗临床致病艰难梭菌及抗耐万古霉素肠球菌等活性[7-9]。现有研究中关于rakicidins类化合物的微生物发酵的研究报道较少,Mcbrien等[1]报道了rakicidins类化合物的摇瓶发酵及分离纯化工艺,其发酵液中的主要组分多为rakicidin A,rakicidin B的含量比较低。化合物rakicidin B1是本课题组首先发现的,经研究发现具有较好的生理活性[3]。如果要开发出具有自主知识产权海洋来源的微生物药物,就必须筛选出rakicidin B1的高产菌株。
近年来,常压室温等离子诱变技术(ARTP)在微生物菌种选育方面应用越来越广泛,并己成功运用到细菌、放线菌、真菌、微藻等微生物的菌种遗传改良方面[10-13]。ARTP诱变技术对微生物DNA突变谱系明显高于其它理化诱变方法[14]。核糖体工程是指利用庆大霉素、链霉素、利福平等抗生素与微生物核糖体或RNA聚合酶的相互作用,向微生物核糖体组分引入特定类型突变,调控代谢系统,从而影响次级代谢产物表达[15-16]。利用核糖体工程可以有助于快速、简便地筛选出对应的突变株,进而改进其环境耐受性,提高其次级代谢的产量或产生新的天然产物[17]。高通量筛选技术具有高效、自动、微量、微型、低成本等优点,已经广泛应用于工业微生生物菌种选育、酶活性优化、药理活性筛选等工作中,极大地提高工作效率[18-20]。
本文对实验室筛选保藏的海洋小单孢菌FIM02-523进行ARTP诱变处理,经庆大霉素抗性筛选及深孔板高通量筛选获得rakicidin B1高产菌株。
1 材料和方法
1.1 主要仪器设备
S30K型pH仪(瑞士Mettler公司);INNOVA-5000型双层摇床(New Brunswick Scientific);Agilent 1260 DAD高效液相色谱仪(美国Agilent公司);24/96深孔板(荷兰EnzyScreen BV公司);三明治盖板(荷兰EnzyScreen BV公司);接种器(荷兰EnzyScreen BV公司);8通道电动移液枪(德国Eppendorf公司)。
1.2 实验菌株
海洋小单孢菌FIM02523本课题组筛选获得并保藏。
1.3 培养基及培养条件
培养基及培养条件见参考文献[7]。
1.4 分析方法
发酵液中rakicidin B1效价的测定按文献[21]进行。
1.5 菌种诱变与筛选
1.5.1 最小抑菌浓度(minimal inhibitory concentration, MIC)的确定
取适量浓度为106~107CFU/mL的出发菌株孢子悬液分别涂布于含不同浓度庆大霉素的分离平板中,以不含抗生素平板为对照;于30℃恒温培养10~15d左右,观察菌落生长情况。以肉眼能够观察到未长菌落的抗生素最小浓度为庆大霉素对该菌株的MIC。
1.5.2 ARTP诱变
ARTP诱变条件[13]:工作功率120W,气源为Ar,气流量10L/min,照射时间为0、60、120、180、240、360s。诱变后的菌悬液适当稀释并涂布于分离平板,于30℃恒温培养15d左右,用于致死率计算和菌种筛选。
1.5.3 高通量深孔板筛选过程
将经过ARTP诱变处理的海洋小单孢菌孢子悬液适当稀释,分别涂布到的分离平板(含最小抑菌浓度),30℃恒温培养15d。将分离平板上长好的单菌落挑种到24深孔板中培养(每孔装有2.0mL固体培养基),每块板可以培养24个菌落。
培养好的新鲜斜面板用孔板接种器转接至对应的24深孔板(种子板),盖上三明治盖板后置于30℃、250r/min、湿度65%左右的摇床振荡培养,同时斜面板存于4℃冰箱待用;种子板培养48h后按5.0%的接种量移种到发酵板(装有2.5mL发酵培养基)上,于30℃、250r/min振荡培养4d左右。
培养好的发酵液按1:3的体积比例加入甲醇混匀并超声20min后离心。取上清液用于HPLC检测发酵液中rakicidin B1效价。每块发酵板挑选效价最高的1~2株菌株传二代斜面用于复筛。
1.5.4 菌株遗传稳定性实验
将筛选出的高产突变株用斜面连续传代培养5代,并进行摇瓶发酵测定rakicidin B1的产量,考察高产突变株的遗传稳定性。
2 结果与分析
2.1 深孔板发酵方法建立
取新鲜培养的种子液按5.0%接种量接种到发酵培养基中,然后用八通道电动移液枪吸取不同体积发酵液分装到24深孔板、96深孔板中,其中24深孔板装液量为1.0、1.5、2.0、2.5和3.0mL;96深孔板装液量为0.25、0.5、0.75和1.0mL;每个装量体积设置8个平行样;同时设置摇瓶对照,装液量分别为40、60、80、100、和120mL,每组5瓶。接种后于30℃、250r/min振荡培养4d。
由表1可以看出24深孔板发酵数据结果比较接近摇瓶,且数据变异系数较低,说明24深孔板可以用于替代摇瓶筛选。装液量2.5mL效价和变异系数均比较理想。96深孔板装液量0.25mL时部分效价接近摇瓶,但是波动较大,而且部分孔板出现结球现象,可能由于装液体积太少随着培养时间增加液体挥发以及微量接种无法保证接种量的一致性等因素影响,导致结果不理想。当96孔板装液量超过0.5mL后可能溶氧不足导致菌体生长不良,产量较低。综合考虑采用24深孔板发酵,装液量为2.5mL。
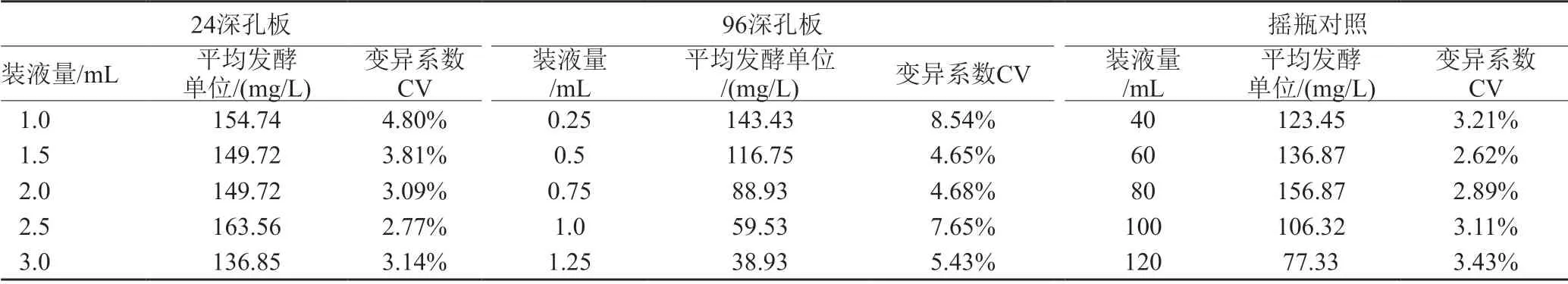
表1 不同装液量体积对rakicidin B1发酵单位的影响Tab.1 The effect of different volume of fermentation on the yield of rakicidin B1
以24深孔板装量2.5mL的发酵培养基,考察不同摇床转速对深孔板发酵的影响,对照为常规摇瓶发酵对应转速250r/min,结果见表2。
结果表明摇床转速在250~300r/min之间rakicidin B1发酵效价最高,在后面的筛选实验过程中可以选择250r/min的转速作为发酵培养条件。
2.2 庆大霉素抑菌浓度(MIC)的确定
取浓度为106~107CFU/mL的孢子悬浮液0.1mL分别涂布于含不同浓度庆大霉素的分离平板中,结果见表3。结果表明,平板培养基中添加庆大霉素后,菌落生长变慢,菌落较小。随着庆大霉素浓度的增加,菌株在分离平板上的单菌落逐渐减少,当庆大霉素浓度达到0.4μg/mL时,分离平板上无明显单菌落形成,此浓度即为此菌株的MIC。
2.3 ARTP诱变剂量的确定
按照“1.6.2”项方法对出发菌株进行ARTP处理,诱变后的菌悬液按一定倍数稀释并涂布于固体基础培养基中培养15d左右,统计菌落数绘制致死率曲线,结果如图1。ARTP处理的致死率和诱变剂量关联性比较好,随着诱变时间的增加致死率也上升。处理时间为60s时,致死率为33%左右;处理时间为180s,致死率达到77%左右;处理时间为240s时,致死率达到89%左右;处理时间超过300s时,致死率接近100%。

表2 不同转速对24孔板发酵产rakicidin B1的影响Tab.2 The effect of different rotation speed on the yields of rakicidin B1

表3 不同庆大霉素浓度对小单孢菌FIM02523生长的影响Tab.3 Effect of gentamicin concentration on the growth of strain FIM-02523
综合考虑致死率曲线变化规律及庆大霉素抗性选育需要足够量的菌落数,在诱变后期试验中采用致死率77%左右的诱变条件,即辐射处理时间为180s。
2.4 深孔板高通量筛选
按照“1.6.2”项方法对出发菌株进行ARTP辐射处理,处理条件为:离子源功率120kW,气源为氩气,气流量10L/min,按照射时间180s;处理后的菌悬液采用“1.6.3”项方法进行初步筛选。每个24孔板中只留1株效价最高的菌株传新斜面板,将生长好的斜面板菌株再次用24深孔板进行发酵复筛。获得的高产菌种再进行下一轮诱变筛选,经过3轮诱变及筛选,共获得20株效价提高100%以上的突变株,其中提高50%以上的12株,100%以上的5株,200%以上的3株。
对出发菌株(Wild type, WT)及效价提高200%的3株突变株(R5-9、R19-5、R36-27)在摇瓶上进行发酵验证(每株菌设置3个平行实验)结果如表4。
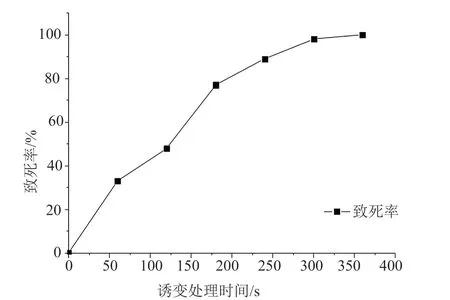
图1 海洋小单孢菌FIM02523的ARTP诱变致死率曲线Fig.1 The lethal rate of Micromonospora FIM02523 treated by ARTP
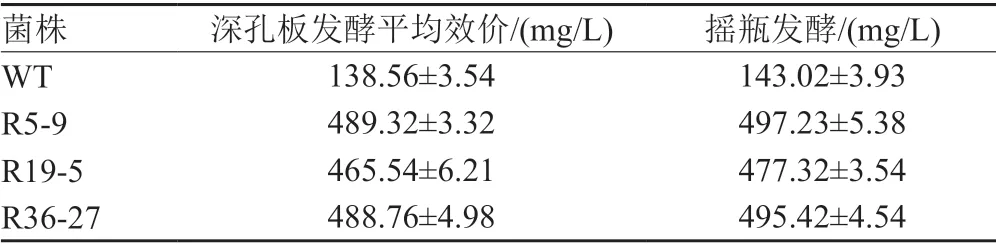
表4 24深孔板和摇瓶培养复筛高产突变株的发酵效价对比Tab.4 Rakicin B1 production by Marine micromonospora grown in 24 deep-well plates or in shaking flasks
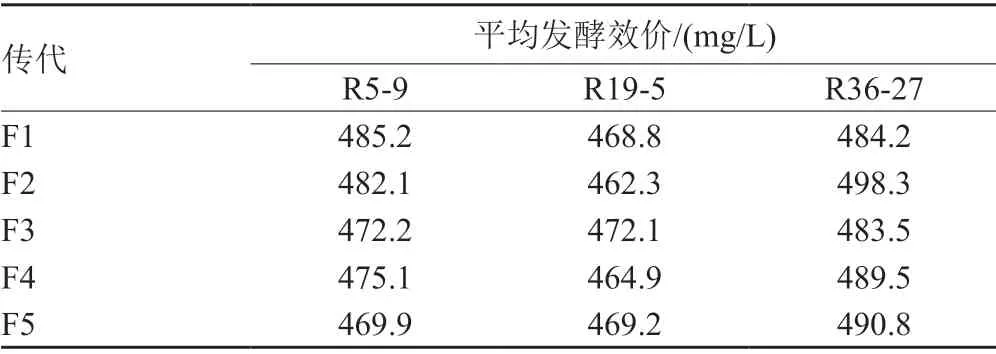
表5 突变株遗传稳定性考察Tab.5 Genetic stability analysis for high productive mutants to produce rakicidin B1
由表4可以看出不同菌株在摇瓶和24深孔板发酵培养时rakicidin B1的发酵单位变化趋势基本一致,也验证了24深孔板可用于海洋小单孢菌发酵产生rakicidin B1的发酵培养及菌株筛选。
2.5 遗传稳定性
选择产量最高的3株菌进行传代和遗传稳定性实验,结果见表5。由表5可以看出高产突变株R5-9、R19-5、R36-27遗传稳定性均较好,其中菌株R36-27最高比出发菌株效价提高约237.9%,效价达到490mg/L左右,可以将其作为后续诱变和发酵工艺优化的菌株,其余两株菌作为备选菌株暂时保藏。
3 讨论
优良的菌种是实现海洋来源微生物药物产业化的根本,而在海洋来源的微生物菌株选育中,高突变率的诱变手段及高通量的筛选方法更是至关重要。本文首次将ARTP诱变技术、庆大霉素抗性选育及高通量筛选技术综合应用于海洋来源的小单孢菌产rakicidin B1的高产菌株选育。建立基于深孔板发酵rakicidin B1高产菌种的高通量筛选方法,与传统摇瓶筛选方法相比,该方法操作简便,缩短了菌株筛选周期,加大了菌株初筛数量,可高效、低成本、快速筛选海洋来源小单孢菌rakicidin B1的高产菌株。
筛选获得的高产菌株R36-27效价由出发菌株的144mg/L提高到490mg/L左右,提高了237.9%,且遗传稳定性良好。表明了核糖体工程技术(庆大霉素抗性)、ARTP诱变技术及高通量筛选技术综合应用于rakicidin B1高产菌的筛选,是有效的、可行的。
