FK409类NO供体型他汀衍生物合成及活性评价
2019-12-30陈宇瑛薛雨艾林曾其炀
陈宇瑛 薛雨 艾林 曾其炀
(1 抗生素研究与再评价四川省重点实验室,四川抗菌素工业研究所,成都大学,成都 610052;2 四川抗菌素工业研究所金华分所,金华 321000;3 浙江海森药业股份有限公司,金华 322104)
当前,心脑血管疾病已成为危害人类健康的头号大敌,其病理基础是动脉粥样硬化(Atherosclerosis, AS),而脂肪代谢素乱、高脂血症以及高血压等正是AS形成和病变过程的决定性因素。具有强效调脂作用的他汀类药物在心脑血管疾病的预防及治疗中发挥着举足轻重的作用。
20世纪90年代以来,由于一氧化氮(NO)在医学方面所显示的巨大潜力而逐渐成为医药研究和生命科学的热点和前沿之一,为新药的发现开辟了一条新途径。
NO作为信使物质和效应分子,在心血管、神经及免疫等系统中发挥着极其重要的作用,如舒张血管平滑肌、抑制血小板黏附和聚集、抑制血管平滑肌的增生和迁移、抗炎、抗氧化等作用。21世纪以来,有关NO的研究可谓方兴未艾,其发展趋势也从单纯的基础研究逐渐向应用方面转化。从最早研究的有机硝酸酯类NO供体以来,迄今为止有数十类NO供体被研发出来,并广泛用于各种生物学研究,按其结构分类主要有以下几类:有机硝酸酯类、亚硝基硫醇类、呋咱氮氧类、偶氮鎓二醇盐类、N-芳基-N'-羟基胍类、亚硝胺类、金属卟啉配合物类、无机亚硝酸盐类、FK409衍生物类等[1-2]
心脑血管疾病诸如AS、心肌梗塞等常因内皮功能的损伤,使得体内NO的释放量降低。采用偶联得到NO供体型他汀类药物有望通过引入外源性NO来弥补内皮细胞释放NO的不足,从而在发挥他汀类药物降血脂作用的同时,能够发挥协同作用,增强药理活性,起到前药性质的作用。
本研究选择的FK409类NO供体,目前在国内未见相关研究报道。该类供体是在20世纪90年代前后,由日本大阪藤泽药业株式会社(Fujisawa harmaceutical Co Ltd.Osaka Factory in Japan)研究开发[3]。
FK409化学名为(E)-4-乙基-2-肟基-5-硝基-3-烯-己酰胺,结构如图1。文献报道显示[1-4],FK409代谢分解的同时,通过释放NO,在体外表现出良好的舒张血管、抗血小板聚集作用。FK409类似物结构通式如图2,其中X可为O、N、S,R1、R2和R3为取代基团,FK409类似物结构中需含有硝基、烯键、肟基3个参与活性物质释放的官能团,通过增长主链长度、改变取代基类型而得到的一系列FK409衍生物。
FK409类似物释放NO的限速步骤[1,7]是硝基α位质子被夺去,这主要取决于两个因素:一是α-H酸性的大小;二是质子旁空间位阻的大小。如具有给电子效应的基团如烷氧基或烃基,作为的取代R1、R2,会使硝基α-H酸性减小,可降低NO的释放速率;用大位阻基团如异丙基、叔丁基取代R1、R2,或者R1和R2连接成环状,增加α-H空间位阻,从而使其不易被夺走,也可达到缓慢释放NO的目的;以上两方面的结构修饰都可增长FK409类似物在体内的半衰期,从而有望延长该潜在药物的作用时间。
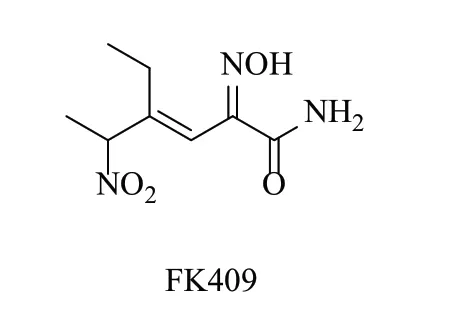
图1 FK409的结构Fig.1 The structure of FK409
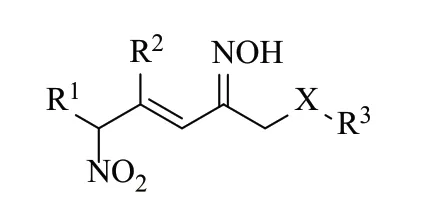
图2 FK409类似物结构通式Fig.2 The structure of FK409 analogues
R3取代基选择电负性较强的或空间位阻较大的基团来修饰,也一定程度对该类供体化合物释放NO的速率具有影响,但相比R1和R2的取代对其释放NO的影响要弱的多。R3位结构修饰的价值在于选择一些具有药理活性的化合物来取代,在保证原有药物药效的基础上,通过FK409类似物释放NO来增强或辅助原有药物的药理活性。
他汀类药物即羟甲基戊二酰单酰辅酶A(HMGCoA)还原酶抑制剂类药物,能够强效抑制HMGCoA还原酶的活性,降低总胆固醇和低密度脂蛋白的含量,具有调脂作用强、安全性高、毒副作用小的特点,是目前临床应用最广泛、疗效最好的调脂类药物。
通过成酯或酰胺的形式将FK409类NO供体的R3端与他汀类药物进行拼接,可以得到一类具有前药性质的化合物,通过体内酶的作用,分别代谢水解成各自成分,有望在发挥他汀类药物调脂及非调脂药理作用的基础上,利用FK409类NO供体释放一定量的NO来增强他汀类药物的药理活性,诸如舒张血管、抗炎、抗氧化等作用。
1 设计与合成
1.1 FK409类NO供体型他汀衍生物的设计
在上述讨论的基础上,设计了以下3种FK409类NO供体衍生物M、P和M',如图3所示,R3基团选择4-氯丁酰氯作为他汀与供体的连接链,当X为O时,R1为甲基、R2为乙基定义为M供体;R1为正丙基、R2为乙基定义为P供体;当X为N时,R1为甲基、R2为乙基定义为M'供体。通过R1基团大小的不同以及X电负性的差异,来控制硝基α-H的酸性,从而考查R1基团大小与NO释放活性的关系。
本文选用阿托伐他汀(Ato)、匹伐他汀(Pita)及瑞舒伐他汀(Rosu)3种他汀药物,通过与供体M、P偶联设计以下6个目标物。其中,目标物M-Ato、M-Pita和M-Rosu是M供体分别与上述3种他汀药物通过中间连接链4-氯丁酰氯偶联得到的FK409类NO供体型他汀衍生物,目标物P-Ato、P-Pita和P-Rosu是P供体分别与上述3种他汀药物通过中间连接链4-氯丁酰氯偶联得到的FK409类NO供体型他汀衍生物,各目标物结构如图4所示。
1.2 FK409类NO供体型他汀衍生物的合成设计
当X为O时,即M和P两种NO供体型他汀目标化合物的合成方法如图5所示。
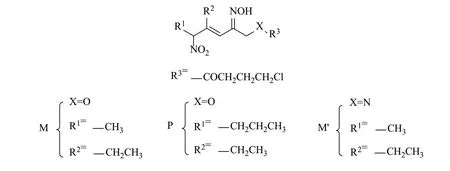
图3 设计的FK409类3种NO供体衍生物Fig.3 Design three types of FK409 NO donor derivatives
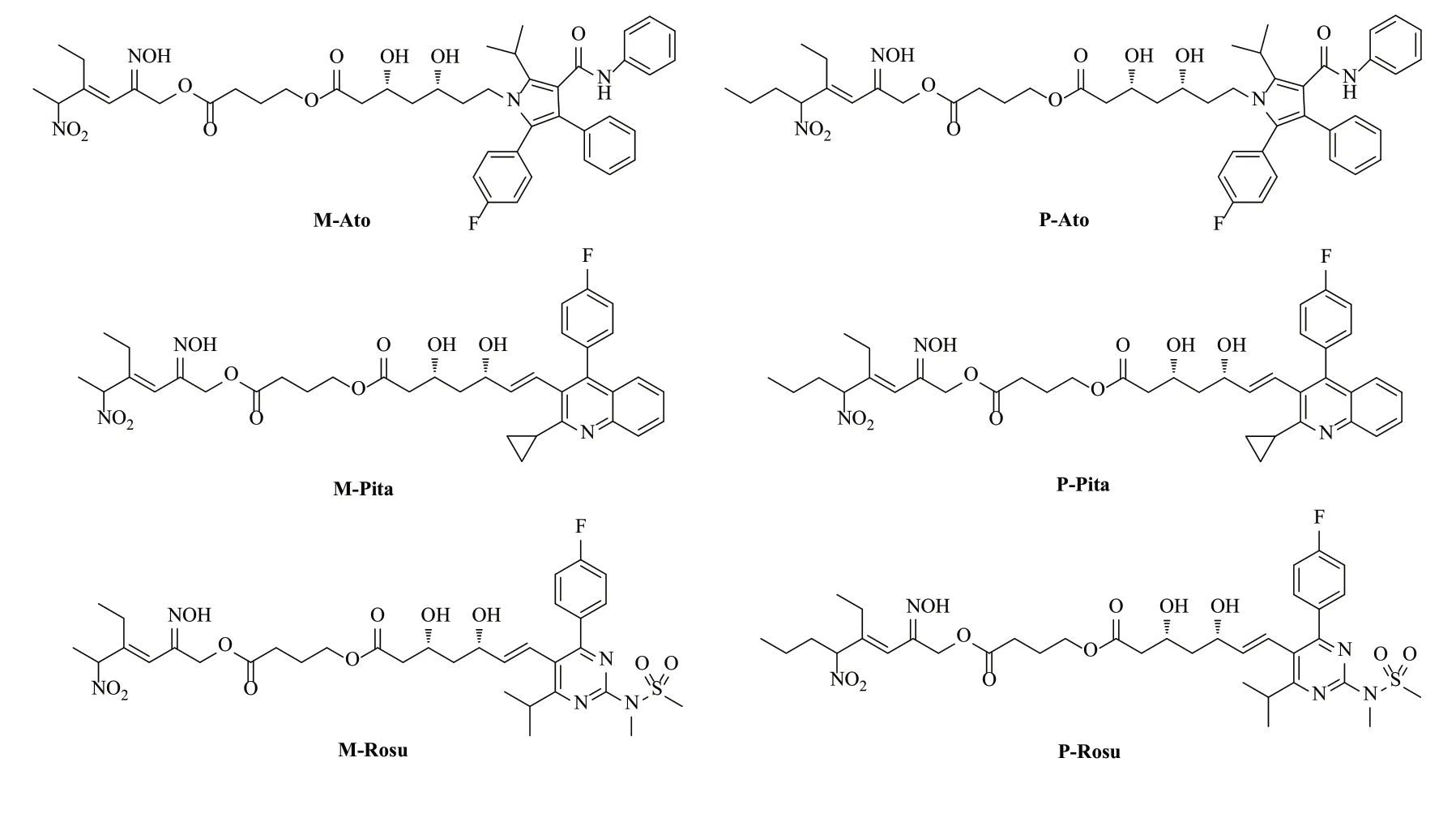
图4 设计的FK409类NO供体型他汀目标化合物Fig.4 Design FK409 NO donor target compounds for statins
以购买得到的两类烯醛即(E)-2-乙基-2-丁烯醛和(E)-2-乙基-2-己烯醛为原料,按文献报道方法[1,3,4,8],在氢化钠强碱作用下,将烯醛与磷酰基乙酸三乙酯通过Wittig-Horner烯化反应合成得到烯化产物1;再以乙醚为溶剂,氢化锂铝为还原剂,还原反应得中间体2。
中间体2在碱性条件下与中间连接链4-氯丁酰氯发生取代反应得氯代物3;然后他汀类化合物以盐的形式与氯代物3在碘化钾催化作用下生成化合物4;最后,通过硝化-亚硝化[8-9]反应生成目标产物5。
2 实验部分
2.1 仪器和试剂
Agilent 1100LC/MSD质谱仪(美国Agilent公司);INOVA400高分辨超导核磁共振仪(Unity);旋转蒸发仪(Rotavapor, R-114);WRS-1A数字熔点仪(上海物理光学仪器厂);81-2型恒温磁力搅拌器(上海司乐仪器厂)。所用原料中间体购自Astatech及TCI试剂公司;所用试剂购自成都科龙化工试剂厂,均为分析纯或化学纯;反应溶剂四氢呋喃和乙醚均作无水处理。
2.2 FK409类NO供体的制备
2.2.1 (E,E)-4-乙基-2,4-二烯-己酸乙酯(M1)的合成[3]
冰浴、氮气保护下,向150mL的无水THF溶液中加入60%的NaH(4.80g, 120mmol),搅拌均匀,再向里逐滴加入磷酰基乙酸三乙酯(20.16g, 90mmol)、(E)-2-乙基-2-烯-丁醛(5.00g, 51.00mmol)、20mL无水THF的混合溶液,搅拌15min后,撤出冰浴,室温条件下搅拌4.5h。反应液倾入冰水中,用乙酸乙酯萃取,有机相用饱和食盐水洗后,无水硫酸镁干燥,浓缩,硅胶柱层析(洗脱剂:乙酸乙酯/正己烷=1/30)得5.00g无色具有酯香味油状物(理论量为8.58g,收率为58.30%)。
2.2.2 (E,E)-4-乙基-2,4-二烯-1-己醇(M2)的合成[3]
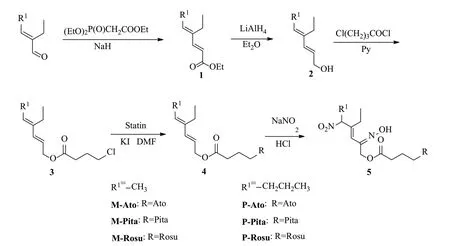
图5 M和P类NO供体型他汀衍生物合成路线Fig.5 The synthesis route of M and P-type NO donor for statin derivatives
室温、避光条件下,向加入氢化锂铝(0.74g, 19.52mmol)的无水乙醚混悬液中,逐滴加入(E,E)-4-乙基-2,4-二烯-己酸乙酯(5.00g, 29.76mmol)的乙醚溶液,搅拌2h后,TLC显示仍有原料存在,故又补加了约0.40g氢化锂铝,搅拌3h后处理。用乙酸乙酯淬灭反应,过滤,有机层用无水硫酸镁干燥,浓缩得粗品,采用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/4)得2.71g无色透明油状物。
2.2.3 [(E,E)-4-乙基-2,4-二烯-1-基]-4-氯-丁酸己酯(M3)的合成[3]
冰浴中,向(E,E)-4-乙基-2,4-二烯-1-己醇(2.87g, 22.78mol)、三乙胺100mL、二氯甲烷150mL的混合液中,滴加4-氯-丁酰氯(6.80g, 48.20mmol),冰浴搅拌4h,反应液用二氯甲烷萃取,二氯甲烷层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/30),得4.30g无色透明油状物。ESIMS(m/z):231.7[M+H]+, C12H19ClO2(MW=230.1)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):6.18(1H,J=15.6Hz, d);5.68~5.52(2H, m);4.62(2H,J=6.8Hz, d);3.60(2H,J=5.1Hz, t);2.51(2H,J=5.8Hz, t);2.23(2H,J=6.5Hz, q);2.13~2.06(2H, m);1.72(3H,J=14.8Hz, d);0.99(3H,J=4.2Hz, t)。
2.2.4 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-氯-丁酸己酯(M)的合成[1,3-6]
将[(E,E)-4-乙基-2,4-二烯-1]-4-氯-丁酸己酯(0.41g, 1.80mmol)、NaNO2(0.74g, 10.70mmol)、甲醇15mL、水10mL混合,向上述混合液中缓慢滴加6mol/L HCl(1.22mL, 7mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/4),得0.16g黄色油状物。1H NMR(400MHz, CDCl3, 25℃)δ(ppm): 6.00(1H, s);5.17(1H,J=6.8Hz, q);4.77(2H, s);3.61(2H,J=9.2Hz, t);2.54(2H,J=11.2Hz, t);2.23~2.08(4H, m);1.73(3H,J=16Hz, d);1.07(3H,J=8.7Hz, t)。
2.2.5 (E,E)-4-乙基-2,4-二烯-辛酸乙酯的(P1)合成[3]
氮气保护、冰浴条件下,向30mL的无水THF溶液中加入60%的NaH(1.20g, 30mmol),搅拌均匀,再向里逐滴加入磷酰基乙酸三乙酯(4.48g, 20mmol)、(E)-2-乙基-2-烯-己醛(1.50g, 11.90mmol)、10mL无水THF的混合溶液,搅拌15min后,撤出冰浴,室温条件下搅拌5h。反应液倾入冰水中,用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/30)得0.29g无色具有酯香味油状物。ESIMS(m/z):197.1[M+H]+, C12H20O2(MW=196.1)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.17(1H,J=16Hz, d);5.96(1H,J=7.4Hz, t);5.84(1H,J=16Hz, d);4.13(2H,J=8.2Hz, q);2.25(2H,J=9.6Hz, q);2.16(2H,J=11.2Hz, q);1.48~1.38(2H, m);1.25~1.18(3H, m);0.98~0.85(6H, m)。
2.2.6 (E,E)-4-乙基-2,4-二烯-1-辛醇(P2)的合成[3]
室温条件下,向加入氢化锂铝(1 8.5 4 m g, 0.49mmol)的无水乙醚混悬液中,逐滴加入(E,E)-4-乙基-2,4-二烯-辛酸乙酯(0.12g, 0.61mmol),搅拌2h。用乙酸乙酯淬灭反应,过滤,有机层用无水硫酸镁干燥,浓缩得粗品,硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/4)得0.07g无色透明油状物。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):6.05(1H,J=15.6Hz, d);5.69~5.63(1H, m);5.36(1H,J=16Hz, t);4.67(1H,J=16.2Hz, t);3.99(2H,J=14.6Hz, t);2.20~2.03(4H, m);1.40~1.31(2H, m);0.98~0.81(6H, m)。
2.2.7 [(E,E)-4-乙基-2,4-二烯-1-基]-4-氯-丁酸辛酯(P3)的合成[1,3]
冰浴、氮气保护条件下,向(E,E)-4-乙基-2,4-二烯-1-辛醇(0.14g, 0.88mmol)、碳酸氢钠(0.13g, 1.54mmol)、二氯甲烷10mL、水2mL的混合液中,滴加4-氯-丁酰氯(0.18g, 1.30mmol),搅拌过夜后,pH检测反应液呈较强酸性,用碳酸氢钠调反应液至中性。反应液用二氯甲烷萃取,二氯甲烷层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用乙酸乙酯/环己烷=1/30的洗脱剂进行硅胶柱层析,得到0.13g无色透明油状物(理论量为0.23g,收率为55.6%)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):5.93(1H,J=15.6Hz, d);5.72~5.64(1H, m);5.26(1H,J=7.4Hz, t);4.11(2H,J=7.0Hz, t);3.60(2H,J=3.0Hz, t);2.54~2.20(6H, m);2.15~2.05(4H, m);1.06~0.99(6H, m)。
2.2.8 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-氯-丁酸辛酯(P)的合成[1,3]
将[(E,E)-4-乙基-2,4-二烯-1]-4-氯-丁酸辛酯(0.77g, 3.00mmol)、NaNO2(1.33g, 19.20mmol)、甲醇30mL、水20mL混合,向上述混合液中缓慢滴加6mol/L HCl(2mL, 11.52mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥、浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/4),得0.12g黄色油状物。ESI-MS(m/z):357.1[M+Na]+, 373.0[M+K]+, C14H23ClN2O5(MW=334.1)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):6.03(1H, s);5.01(1H,J=4.4Hz, t);4.76(2H, s);3.60(2H,J=6.2Hz, t);2.53(2H,J=7.0Hz, t);2.25~2.04(1H, m);2.22~2.02(4H, m);1.96~1.82(1H, m);1.42~1.24(2H, m);1.06(3H,J=5.7Hz, t);0.98(3H,J=6.4Hz, t)。
2.3 FK409类NO供体型他汀衍生物的合成
2.3.1 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R)-7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸己酯(M3-Ato)的合成
将[(E,E)-4-乙基-2,4-二烯-1]-4-氯-丁酸己酯(0.21g, 0.91mmol)、阿托伐他汀钙(1.16g, 1.00mmol)、25mL的DMF混合,加入适量催化剂KI,室温搅拌30h,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得64.40mg油状物。ESI-MS(m/z):753.3[M+H]+, C45H53FN2O7(MW=752.4)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.20~7.14(9H, m);7.06(2H,J=8.0Hz, d);7.02~6.96(3H, m);6.87(1H, s);6.18(1H,J=16.0Hz, d);5.67~5.53(2H, m);4.62(2H,J=16.0Hz, d);4.15~4.04(4H, m);4.00~3.91(1H, m);3.78~3.68(1H, m);3.69~3.62(1H, m);3.61~3.55(1H, m);2.48~2.36(2H, m);2.41(2H,J=7.2Hz, t);2.23(2H,J=7.6Hz, q);2.05~1.95(2H, m);1.75~1.60(2H, m);1.72(3H,J=6.8Hz, d);1.59-1.42(2H, m);1.53(6H,J=7.2Hz, d);0.99(3H,J=7.4Hz, t)。
2.3.2 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R, 6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(M3-Pita)的合成
将[(E,E)-4-乙基-2,4-二烯-1]-4-氯-丁酸己酯(0.58g, 2.50mmol)、匹伐他汀钙(2.00g, 2.27mmol)、25mL的DMF混合,加入适量催化剂KI,室温搅拌30h,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得0.50g油状物。ESI-MS(m/z):616.2[M+H]+, C37H42FNO6(MW=615.3)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.95(1H,J=8.0Hz, d);7.60~7.56 (1H, m);7.35~7.28(2H, m);7.24~7.13(4H, m);6.63(1H,J=16.4Hz, d);6.19(1H,J=15.6Hz, d);5.68~5.53 (3H, m);4.63(2H,J=6.4Hz, d);4.45~4.35(1H, m);4.19~4.06(1H, m);4.17(2H,J=6.4Hz, t);2.49~2.37(2H, m);2.42(2H,J=3.2Hz, t);2.24(2H,J=7.6Hz, q);2.04~1.97 (2H, m);1.72(3H,J=6.8Hz, d);1.58~1.29 (2H, m);1.39~1.26 (1H, m);1.05~0.95 (4H,m);0.99 (3H,J=7.6Hz, t)。
2.3.3 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R, 6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(M3-Rosu)的合成
将[(E,E)-4-乙基-2,4-二烯-1]-4-氯-丁酸己酯(1.15g, 4.90mmol)、瑞舒伐他汀钠(5.00g, 9.93mmol)、25mL的DMF混合,加入适量催化剂KI,室温搅拌30h,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得0.56g油状物。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.66~7.62(2H, m);7.09(2H,J=8.6Hz, t);6.63(1H,J=16Hz, d);6.19(1H,J=15.6Hz, d);5.66~5.42(3H, m);4.62(2H,J=6.8Hz, d);4.46(1H, s);4.19~4.15(3H, m);3.75(1H, s);3.62(1H, s);3.57(3H, s);3.52(3H, s);3.38~3.34(1H, m);2.47~2.40(2H, m);2.42(2H,J=4.8Hz, t);2.23(2H,J=7.6Hz, q);2.03~1.97(2H, m);1.72(3H,J=6.8Hz, d);1.57~1.42(2H, m);1.26(6H,J=6.8Hz, d);0.99(3H,J=7.6Hz, t)。
2.3.4 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R)-7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸辛酯(P3-Ato)的合成
合成方法参照“2.3.1”项。
2.3.5 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R, 6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(P3-Pita)的合成
合成方法参照“2.3.2”项。
2.3.6 [(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R, 6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(P3-Rosu)的合成
合成方法参照“2.3.3”项。
2.3.7 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R)-7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸己酯(M-Ato)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R,5R)-7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸己酯(0.66g, 0.88mmol)、NaNO2(0.36g, 5.28mmol)、甲醇15mL、水10mL混合,向上述混合液中缓慢滴加6mol/L HCl(1.13mL, 6.50mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得104.20mg浅黄色油状物。ESI-MS(m/z):829.9[M+H]+, C45H53FN4O10(MW=828.4)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.27~7.12(9H, m);7.06(2H,J=8Hz, d);7.02~6.96(3H, m);6.87(1H, s);6.02(1H, s);5.15(1H,J=6.8Hz, q);4.75(2H,J=5.2Hz, t);4.22~4.06(4H, m);3.98~3.92(1H, m);3.80~3.65(2H, m);3.56(2H,J=7.2Hz, t);2.48~2.36(4H, m);2.22~2.18(2H, m);1.98~1.94(2H, m);1.75~1.60(2H, m);1.72(3H,J=6.8Hz, d);1.59~1.42(2H, m);1.53(6H,J=7.2Hz, d);1.06(3H,J=7.6Hz, t)。
2.3.8 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R, 6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(M-Pita)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R,5R,6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(0.52g, 0.85mmol)、NaNO2(0.35g, 5.10mmol)、甲醇24mL、水9mL混合,向上述混合液中缓慢滴加6mol/L HCl(0.68mL, 4.08mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得62.10mg浅黄色油状物。ESIMS(m/z):692.2[M+H]+, C37H42FN3O9(MW=691.3)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.96(1H,J=7.6Hz, d);7.59(1H,J=7.0Hz, t);7.36~7.28(2H, m);7.21~7.13(4H, m);6.63(1H,J=16.0Hz, d);6.03(1H, s);5.57(1H,J=16.0Hz, 6.4Hz, dd);5.16(1H,J=6.8Hz, q);4.76(2H,J=5.2Hz, t);4.40(1H, s);4.24~4.09(4H, m);3.82(1H, s);3.32(1H, s);2.50~2.24(2H, m);2.44(2H,J=8.6Hz, t);2.20(2H,J=1.2Hz, q);2.05~1.98(2H, m);1.72(3H,J=6.8Hz, d);1.64~1.42(2H, m);1.35~1.24(1H, m);1.08~0.95(4H, m), 1.07(3H,J=7.2Hz, t)。
2.3.9 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R, 6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(M-Rosu)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R, 6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸己酯(0.40g, 0.60mmol)、NaNO2(0.50g, 7.20mmol)、甲醇24mL、水9mL混合,向上述混合液中缓慢滴加6mol/L HCl(0.96mL, 5.76mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得84.30mg浅黄色油状物。ESI-MS(m/z):752.8[M+H]+, C34H46FN5O11S (MW=751.3)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.63(2H,J=8.0Hz, t);7.08(2H,J=8.6Hz, t);6.62(1H,J=15.6Hz, d);6.00(1H, s);5.44(1H,J=17.3Hz, 9.2Hz, dd);5.17~4.94(3H, m);4.46(1H, s);4.19(1H, s);4.17(2H,J=9.2Hz, t);3.56(3H, s);3.51(3H, s);3.39~3.32(1H, m);2.54~2.20(6H, m);2.15~1.95(2H, m);1.73(3H,J=7.2Hz, d);1.61~1.44(2H, m);1.25(6H,J=6.4Hz, d);1.14~1.02(3H, m)。
2.3.10 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R) -7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸辛酯(P-Ato)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R, 5R)-7-[2-(4-氟苯基)-5-异丙基-3-苯基-4-(苯胺羰基)吡咯-1-基]-3,5-二羟基庚酯基}-丁酸辛酯(1.60g, 2.05mmol)、NaNO2(0.85g, 12.30mmol)、甲醇30mL、水20mL混合,向上述混合液中缓慢滴加6mol/L HCl(1.67mL, 10mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得0.24g浅黄色油状物。ESI-MS(m/z):857.9[M+H]+, C47H57FN4O10(MW=856.4)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.20~7.12(9H, m);7.06(2H,J=8.0Hz, d);7.02~6.97(3H, m);6.87(1H, s);6.05(1H, s);5.00(1H,J=6.0Hz, q);4.74(2H, s);4.22~4.06(4H, m);3.98~3.90(1H, m);3.79~3.66(2H, m);3.57~3.53(2H, m);2.46~2.38(2H, m);2.43(2H,J=8.8Hz, t);2.29~2.16(3H, m);1.98~1.90(2H, m);1.92~1.82(1H, m);1.73~1.62(2H, m);1.59~1.42(2H, m);1.53(6H,J=7.2Hz, d);1.38(2H, m);1.05(3H,J=7.6Hz, t);0.98(3H,J=7.4Hz, t)。
2.3.11 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R, 6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(P-Pita)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R,5R,6E)-7-[2-环丙基-4-(4-氟代苯基)喹啉-3-基]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(1.40g, 2.18mmol)、NaNO2(0.90g, 13.06mmol)、甲醇30mL、水20mL混合,向上述混合液中缓慢滴加6mol/L HCl(1.67mL, 10mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得0.34g浅黄色油状物。ESIMS(m/z):720.8[M+H]+, C39H46FN3O9(MW=719.3)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.96(1H,J=8.4Hz, d);7.59(1H, s);7.36~7.28(2H, m);7.21~7.13(4H, m);6.63(1H,J=12Hz, d);6.06(1H, s);5.57(1H,J=15.8Hz, 6.2Hz, dd);5.00(1H,J=8.8Hz, q);4.75(2H, s);4.40(1H, s);4.24~4.09(4H, m);3.82(1H, s);3.32(1H, s);2.53~2.24(4H, m);2.30~2.12(3H, m);2.04~1.94(2H, m);1.96~1.82(1H, m);1.64~1.42(2H, m);1.42~1.24(3H, m);1.08~0.95(4H, m);1.07~0.85(6H, m)。
2.3.12 (4-乙基-2-肟基-5-硝基-3-烯-1-基)-4-{(3R, 5R,6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(P-Rosu)的合成
将[(E,E)-4-乙基-2,4-二烯-1-基]-4-{(3R,5R,6E)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)-5-嘧啶]-3,5-二羟基-6-庚烯酯基}-丁酸辛酯(0.60g, 0.85mmol)、NaNO2(0.35g, 5.11mmol)、甲醇15mL、水10mL混合,向上述混合液中缓慢滴加6mol/L HCl(0.84ml, 5.00mmol),室温搅拌30min,反应液用乙酸乙酯萃取,有机层用饱和食盐水洗后,无水硫酸镁干燥,浓缩,浓缩液用硅胶柱层析(洗脱剂:乙酸乙酯/环己烷=1/1),得38.60mg浅黄色油状物。ESI-MS(m/z):780.8[M+H]+, C36H50FN5O11S (MW=779.3)。1H NMR(400MHz, CDCl3, 25℃)δ(ppm):7.65(2H,J=8.4Hz, t);7.09(2H,J=8.6Hz, t);6.64(1H,J=16Hz, d);6.03(1H, s);5.45(1H,J=7.8Hz, d);5.01~4.89(1H, m);4.46(1H, s);4.40~4.08(3H, m);3.77~3.58(2H, m);3.57(3H, s);3.52(3H, s);3.40~3.34(1H, m);2.52~2.39(2H, m);2.46(2H,J=13.2Hz, t);2.43~2.41(2H, m);2.40~2.16(2H, m);2.05~1.98(1H, m);1.82~1.74(1H, m);1.61~1.44(2H, m);1.39~1.30(2H, m);1.26(6H,J=6.4Hz, d);1.15~0.92(6H, m)。
3 NO释放活性测定
目标化合物通过亚硝酸盐-硝酸盐法进行体外NO释放活性测定。有机硝酸酯类NO供体需在含巯基化合物如L-半胱氨酸或谷胱甘肽等的参与下才能释放NO,因其释放NO的机制是在助释剂的作用下通过巯基对硝酸酯基团的N原子进行亲核进攻,从而释放NO[9]。与有机硝酸酯类或其他类NO供体不同,根据以上讨论的FK409类供体NO释放机制,目标化合物的NO释放无需在含巯基化合物的参与下进行,仅需在弱碱性条件即可。释放出的NO化学性质活泼,在水溶液或富氧条件下很容易被氧化成亚硝酸盐,再发生重氮化、偶合反应产生玫瑰红色的化合物,该偶联产物在548nm波长处具有特定强吸收峰,根据测定的紫外吸收数据,从而间接计算出目标化合物释放NO的量。
分别测试6 个目标化合物,测试浓度为0.10mmol/L,将测得紫外吸收数据,通过标准溶液回归方程换算成NO浓度见表1。
从表1可以看出FK409类NO供体型他汀衍生物释放NO具有一定的梯度,在1~5h内随时间的增长,释放NO的总量在增加。选取释放NO量适当的目标物M-Rosu作图(图6)。
以6个目标化合物在6h内释放NO的总量计算释放百分率见表2。从表2可看出化合物M-Pita释放NO百分率比其他衍生物要高,能在较长时间内仍具有NO释放活性。
另外,通过以上FK409类NO供体型他汀衍生物NO释放结果的比较,R3位置的结构修饰对NO的释放发挥着至关重要的作用。
该类NO供体型他汀衍生物虽然释放NO百分率有差异,但在较长时间内均具有释放活性,这种特性对于延长潜在药物在体内代谢的半衰期,延长作用时间具有重要的研究意义。
NO释放机制[1,8,10]:本文合成的6个目标化合物,其NO供体部分在体内释放NO具有明确的机制,该类供体结构中,因硝基的强吸电子诱导效应而使α-H具有一定的酸性,在碱性(RS-, OH-)条件下α-H容易被夺去,生成一对互变异构体,再经过生物转化释放NO(图7)。根据以上机制,该类供体化合物设计主要是增大R1和R2位的空间位阻来控制α-H的酸性,从而延长供体在体内的半衰期,即延长作用时间。FK409类似物的构效关系决定了该类供体释放NO具有一定可控性。
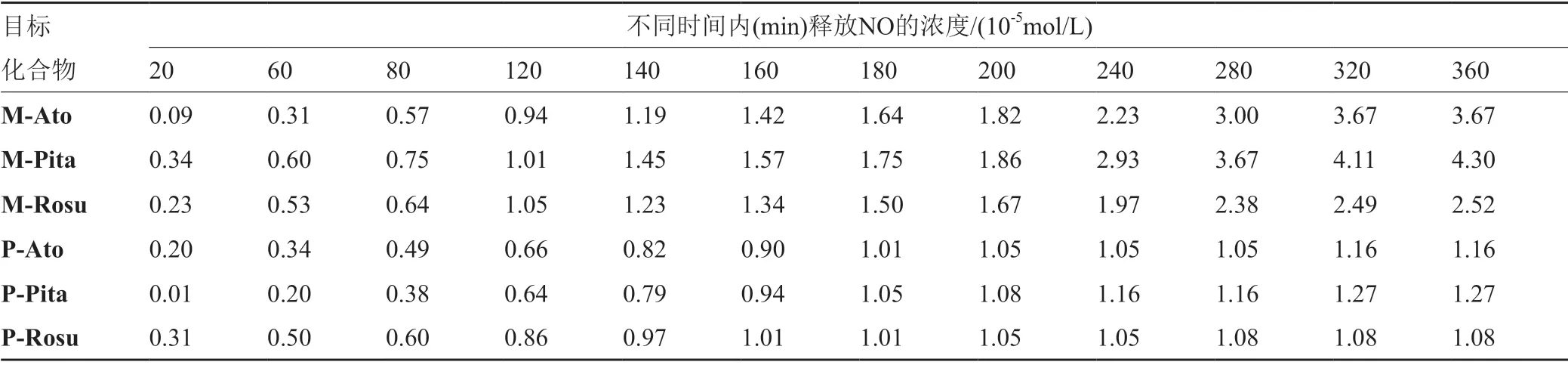
表1 不同时间内(min)释放的NO的浓度Tab.1 The concentration of the NO which target chemicals release in different time
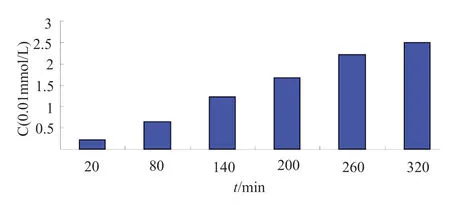
图6 化合物M-Rosu(7)释放NO总量随时间变化图Fig.6 The figure that the total amount of NO released by the compound M-Rosu (7) change over time
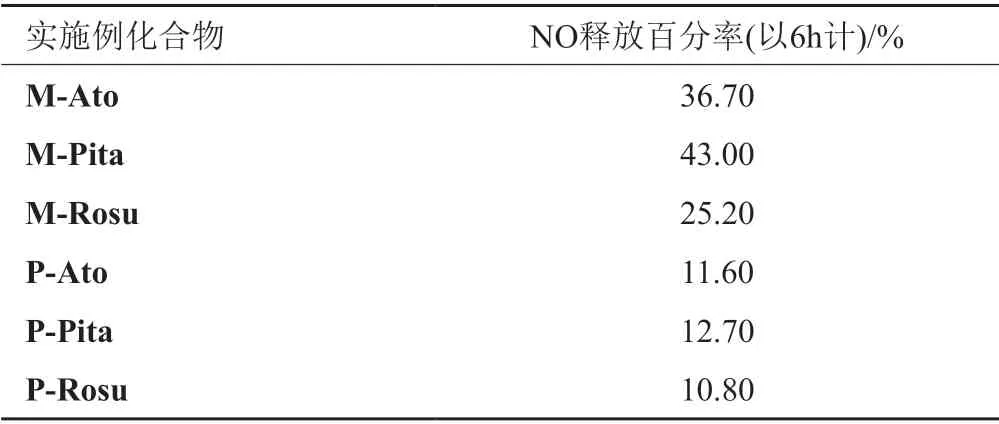
表2 目标化合物体外释放NO百分率Tab.2 The percentage of NO released by the target compound in vitro
4 结论
本文选择FK409类NO供体,设计其与他汀类降血脂药物(阿托伐他汀、匹伐他汀和瑞舒伐他汀)进行偶联的6个全新的NO供体型他汀类衍生物,并成功合成得到6个目标产物,部分中间体及目标产物的结构经ESI-MS、1H NMR确证。体外NO释放活性评价结果表明:目标化合物具有良好的NO释放活性,通过结构修饰可使其NO释放具有一定的可控性,为进一步研究新型NO供体型他汀药物提供参考。
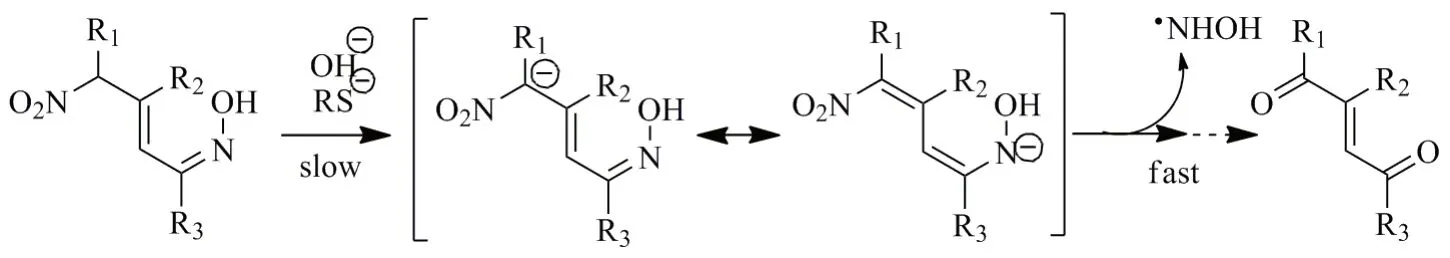
图7 NO释放机制Fig.7 The mechanism of NO release
