我院鲍曼不动杆菌临床分布及耐药性分析
2019-12-30耿荣华吴秀萍郑高艳曲芬
耿荣华 吴秀萍 郑高艳 曲芬
(航空总医院,北京 101200)
鲍曼不动杆菌(Acinetobacter baumannii, AB)是一种非发酵革兰阴性菌,属于条件致病菌,是院内感染的重要病原菌,可引起呼吸道感染、泌尿系感染、手术部位感染以及继发性脑膜炎等[1]。有研究表明,由于AB可形成生物膜,使之能够抵抗干燥剂和消毒剂,长期存活在医护人员的指尖、各种医疗器械的表面,从而导致机体反复感染、互相传播[2]。近年来,由AB引起的院内感染逐渐增多,特别是由于抗菌药物的大量使用,多重耐药(multidrug resistance, MDR)、广泛耐药(extensive drug resistance, XDR)AB检出率也不断增加,成为临床的棘手问题[3]。2010年在美国进行的一项全国性监测研究中,分别有44.7%和49.0%对亚胺培南和美罗培南耐药[4]。中国CHINET 13年监测结果显示亚胺培南及美罗培南耐药鲍曼不动杆菌(CRAB)从2005年的31.0%上升至2017的66.7%,并且多地区鲍曼不动杆菌对碳青霉素烯类药物耐药率大于80%,最高可达91.7%,导致临床治疗困难,感染死亡率增加[5]。近年来随着广谱抗生素的使用,AB已成为我国院内感染最重要的病原菌之一,耐药形势日益严峻,应引起各医疗机构高度重视。本文对我院2016年1月—2018年12月分离的824株鲍曼不动杆菌临床分布及耐药性变迁进行分析,为临床合理用药及预防院内感染提供指导。
1 材料与方法
1.1 菌株来源
2016年1月—2018年12月我院临床各科室送检标本中分离的鲍曼不动杆菌共计824株,感染患者均有感染的临床症状/体征,剔除同一患者相同部位的重复菌株。
1.2 仪器、试剂鉴定及药敏试验
严格按《全国临床检验操作规程》进行;分离出的细菌由法国生物梅里埃公司生产的Vitek-2 Compact全自动细菌鉴定及药敏系统进行实验,药敏折点按照CLSI 2018版执行[6]。质控菌株采用标准菌株大肠埃希菌ATCC-25922、铜绿假单胞菌ATCC-27853,由国家卫生健康委员会提供。
1.3 数据统计
分析试验数据采用WHONET 5.6软件进行统计分析,使用CHISS软件对计数资料进行χ2检验。
2 结果
2.1 我院2016—2018年分离细菌前10位排名
2016年1月—2018年12月我院从各类送检标本中共分离鲍曼不动杆菌824株,占同期全部分离菌的12.6%,位列第3。2016年鲍曼不动杆菌检出率10.0%(221/2216),2017年鲍曼不动杆菌检出率12.8%(296/2305),2018年鲍曼不动杆菌检出率13.8%(307/2225),检出率呈逐年上升趋势(χ2= 10.82,P=0.001),详见表1。患者年龄1月~101岁,平均年龄(66.4±21.88)岁,男性患者占72.6%。2017年CHINET中国细菌耐药监测网显示,呼吸道分离菌种主要为肺炎克雷伯菌(17.6%)、鲍曼不动杆菌(17.3%)、铜绿假单胞菌(14.5%)[5]。

表1 2016—2018年分离细菌前10位排名Tab.1 Top 10 bacteria isolated in clinical from 2016 to 2018
2.2 鲍曼不动杆菌在标本中的分布
824株鲍曼不动杆菌来自临床多种送检标本,以下呼吸道(吸痰、气管镜刷洗物)送检比例最高,占83.6%(689株),其次无菌体液(脑脊液、腹腔引流液、腹水、胸水等)占7.2%(59株),其他包括阴道分泌物、脐部分泌物、尿道分泌物42株(5.1%),中段尿液27株(3.3%),血液7株(0.8%)。
2.3 鲍曼不动杆菌在不同年龄组及病房的分布
由于儿科病房患者均为14岁以下,平均年龄(3.6±3.83)岁,检出数量少于20例,故不予以统计,其他年龄组在不同病区的分布见表2。
χ2=211.4428,P=0,各科室年龄分布具有显著性差异;呼吸内科、重症监护病房、综合外科及综合内科以30~90岁以上中老年人群为主,而神经外科以0~59岁青壮年脑外伤为主。
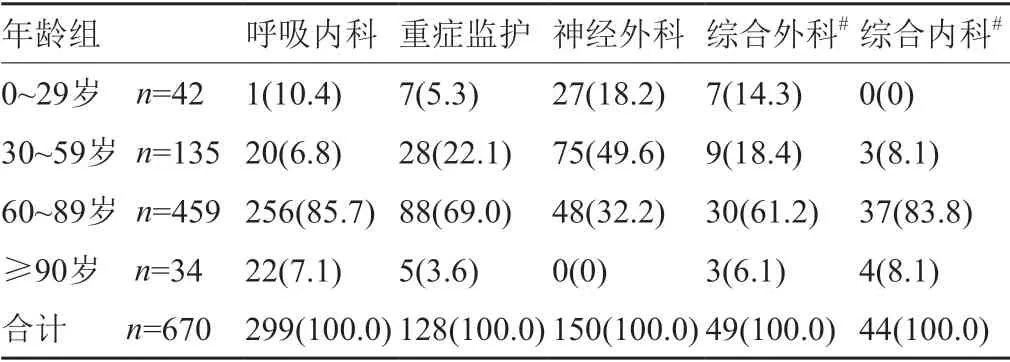
表2 824例感染患者鲍曼不动杆菌年龄分布情况[n(%)]Tab.2 Age distribution of 824 patients infected Acinetobacter baumannii [n(%)]
2.4 鲍曼不动杆菌对常用抗菌药物耐药率及其变化趋势
824株鲍曼不动杆菌对常用抗生素的整体耐药率由高到低依次是阿莫西林/克拉维酸(74.09%)、环丙沙星(68.30%)、亚胺培南(65.74%)、头孢吡肟(64.65%)、庆大霉素(62.37%)、妥布霉素(57.28%)、头孢他啶(56.07%)、复方磺胺甲噁唑(48.71%)、左氧氟沙星(48.56%)、氨苄西林/舒巴坦(47.57%)、头孢哌酮/舒巴坦(14.06%)和替加环素(5.83%)。同为氟喹诺酮类的左氧氟沙星对鲍曼不动杆菌的耐药率显著低于环丙沙星(χ2=66.38,P=0);同为舒巴坦复合制剂的抗生素头孢哌酮/舒巴坦显著低于氨苄西林/舒巴坦(χ2=216.77,P=0)。多重耐药菌占66.5%,泛耐药占14.3%,3年的耐药性比较见表3。
2016—2018年间鲍曼不动杆菌对头孢哌酮/舒巴坦的耐药率有持续增高,对左氧氟沙星的耐药2017年增高明显;而对头孢他啶、氨苄西林/舒巴坦、替加环素的耐药率有所下降,对其他抗生素的耐药趋势变化不明显。
2.5 不同标本中分离的鲍曼不动杆菌及其耐药率比较
824株鲍曼不动杆菌分离的主要标本包括下呼吸道、无菌体液、分泌物及中段尿分离株的耐药性比较见表4。
2.6 来自不同科室的鲍曼不动杆菌的耐药率比较
鲍曼不动杆菌主要分离自呼吸内科、重症监护病房、神经外科、儿科、综合外科和综合内科,整体耐药率较高的为呼吸内科、重症监护病房和神经外科病房,其中分离自儿科的46株鲍曼不动杆菌仅对头孢他啶、头孢哌酮/舒巴坦、复方磺胺甲噁唑有耐药,耐药率分别为6.2%、10.0%和2.2%,其他重点科室的耐药率比较见表5。
不同科室、不同抗生素之间鲍曼不动杆菌耐药率可有明显不同,对阿莫西林/克拉维酸、庆大霉素的耐药率呼吸内科及重症监护明显高于综合外科及综合内科;对头孢他啶的耐药率明显高于综合外科;对头孢吡肟、妥布霉素的耐药率呼吸内科、重症监护及神经外科明显高于综合内科;对环丙沙星的耐药率呼吸内科、重症监护及神经外科明显高于综合外科及综合内科,综合外科最低;对左氧氟沙星的耐药率呼吸内科最高;对氨苄西林/舒巴坦的耐药率重症监护显著高于其他科室;对头孢哌酮/舒巴坦的耐药率呼吸内科显著高于综合外科;复方磺胺甲噁唑的耐药率呼吸内科显著高于综合内科;亚胺培南的耐药率综合外科及综合内科显著低于其他科室,而综合内科又低于综合外科。综上所述不同科室之间各种抗生素耐药率存在明显不同,临床应严格根据药敏试验结果选择用药。

表3 824株鲍曼不动杆菌的耐药率及变化趋势Tab.3 Drug resistancerate and changing trend of 824 Acinetobacter baumannii solates

表4 不同标本分离的鲍曼不动杆菌的耐药率比较Tab.4 The comparison of drug resistance rates of Acinetobacter baumannii isolated from different specimens

表5 不同科室的鲍曼不动杆菌对抗生素的耐药率比较Tab.5 The comparison of antibiotic resistance rates of Acinetobacter baumanniiin different departments
3 讨论
AB广泛存在于医院环境中,随着医疗技术的发展,器官移植、有创检查及治疗手段的不断推广,以及广谱抗菌药物、糖皮质激素和免疫抑制剂在临床治疗中的广泛应用,AB引起的医院感染逐年增多,可导致包括下呼吸道、泌尿道、血液、腹腔及皮肤软组织等几乎所有系统的感染,近年来欧洲ICU感染患病率调查项目(EPIC)、美国医院感染监测系统(NNIS)及中国细菌耐药监测网(CHINET)数据均表明,AB所致的呼吸道感染已超过AB所致的其他感染,成为主要的医院获得性感染[7],我院AB同样为感染的优势菌。AB作为常见的条件致病菌,在人体定植比感染更常见;在健康人群中其定植率为15%~40%,而在住院患者中其定植率>40%[8]。虽然定植不是感染,但定植菌的存在可能是感染的重要来源和高危因素。AB定植患者发生AB感染的感染率在第1周为43.9%,第2周为84.3%,第4周以后为100%,可见AB定植患者感染率随住院时间延长而增加[9],所以临床应引起足够的重视。
我院2016—2018年连续3年病原菌分布显示,鲍曼不动杆菌在革兰阴性菌中的分离率排在第3位,前两位分别是大肠埃希菌、肺炎克雷伯菌;在科室检出中,主要来自呼吸科病房、重症监护病房及神经外科病房;而在张勇等[10]、涂盛等[11]的研究中,ICU 是发生鲍曼不动杆菌感染的主要科室,其次为神经外科及肝胆外科,可能与我院各科室的送检率、床位数以及医院神经外科为优势科室的特点不同相关。我院神经外科患者占全院患者的1/3,患者脑脊液感染鲍曼不动杆菌比例较高,这与脑外科患者外伤或手术导致血脑屏障破坏及术后留置引流管、术后脑脊液漏、广谱抗菌药物使用,患者住院时间长等有关。研究显示鲍曼不动杆菌神经系统感染较革兰阳性菌脑脊液感染预后较差[12-13];提示神经外科临床应高度警惕鲍曼不动杆菌脑脊液感染及混合感染[14]。脑脊液中的鲍曼不动杆菌的抗菌治疗不仅需要考虑感染菌的药物敏感性,而且必须选择易透过血-脑脊液屏障的抗菌药物,如替加环素、美罗培南、氨苄西林/舒巴坦等,多重耐药菌如MDRAB、XDRAB、PDRAB感染,推荐敏感药物及联合治疗及静脉加鞘内注射有较好的效果[15-17]。
鲍曼不动杆菌基因组研究发现其具有强大的获得耐药性和克隆传播的能力,多重耐药、广泛耐药、全耐药鲍曼不动杆菌已成为全球抗感染领域的挑战,更是目前我国最重要的“超级细菌”[18],临床上可供选择的有效抗菌药物甚少。加强鲍曼不动杆菌的耐药性监测,了解其耐药性变化趋势对有效治疗和预防该菌感染非常重要。本次研究的鲍曼不动杆菌耐药监测显示2016—2018年不同抗生素的耐药性变化,不同科室、不同标本来源的鲍曼不动杆菌的耐药率可有显著差异,考虑与各科室的患者免疫状况,基础疾病,抗生素使用时间的长短不同导致最终药敏结果不同,提示在不同科室临床用药应根据具体药敏结果针对性治疗。本次研究数据显示鲍曼不动杆菌对常用抗生素的整体耐药率较高,但对头孢哌酮/舒巴坦和替加环素的耐药率较低,对亚胺培南的耐药率65.9%与国内2017年胡付品等[19]耐药监测水平接近,但基于2017年胡付品等[19]19246株鲍曼不动杆菌对多黏菌素B耐药率0.1%分析,临床耐药菌株并不多见,这方面的实验数据期待以后进一步探讨、完善。另外对于敏感的鲍曼不动杆菌,根据感染部位及药敏试验结果选择单一有效的抗生素治疗就足够,但对于多重耐药株常需要联合治疗,国内目前多采用以头孢哌酮/舒巴坦为基础的联合方案如头孢哌酮/舒巴坦+多西环素(静滴)/米诺环素(口服);含碳青霉烯类抗生素的联合方案主要用于同时合并多重耐药肠杆菌科细菌感染的患者[20]。有研究发现多黏菌素与碳青霉烯类有很好的体外协同抗菌活性体外研究的系统评价表明,多黏菌素联合碳青霉烯的总体协同率在80.0%以上,仅有7.1%的菌株出现拮抗作用,即使对多黏菌素耐药的菌株,协同率也达79.9%;且联合后的杀菌活性可由多黏菌素单药时的26.2% 提升至71.8%[21]。在联合的碳青霉烯类中,多黏菌素与美罗培南和多利培南的协同率在85.0%左右,要高于与亚胺培南的协同率(66.8%)[21]。临床研究也提示多黏菌素联合碳青霉烯类对MDRAB感染有效。Shield等[22]报道对于器官移植后感染MDR-AB的患者,多黏菌素单药治疗后40.0%(4/10)出现多黏菌素敏感性下降,而多黏菌素联合碳青霉烯类的治疗成功率为80.0%(4/5),且多黏菌素耐药性并未发生变化。一项大规模回顾性队列研究表明,多黏菌素联合碳青霉烯类治疗MDR-AB感染患者的28d生存率为60.0%[23];Chaari等[24]的研究表明,多黏菌素联合亚胺培南组的重症监护室(intensive care unit, ICU)生存率为73.7%。联合治疗还应考虑影响抗生素治疗效果的各种因素,综合确定治疗方案,既要保证有效的抗感染治疗,又要阻止多重耐药的进一步发展,减少抗菌药物引起的不良反应。
鲍曼不动杆菌的临床感染率及耐药性的增长,耐药特点的变化,以及不同标本、不同科室分离的菌株的耐药性的差别,医院应加强鲍曼不动杆菌特别是多重耐药菌的监测,更精细化指导临床抗感染治疗以面对鲍曼不动杆菌的感染率及耐药率增高的严峻挑战,加强认识及耐药监测,正确治疗及防控,提高感染患者的治愈率并防止耐药性进一步传播是医务人员努力的方向,开发新的治疗药物也势在必行[25]。
