响应面法酶解藜麦蛋白制备α-淀粉酶抑制肽的工艺研究
2019-12-19叶凯李小强周金虎方尚玲陈茂彬
叶凯,李小强,周金虎,方尚玲,陈茂彬*
(1.湖北工业大学 生物工程学院,武汉 430068;2.发酵工程教育部重点实验室,武汉 430068;3.湖北省酿造工艺与装备工程技术研究中心,武汉 430068)
藜麦,原产于南美洲安第斯山区的一种伪谷物,一年生,叶子较宽,自花授粉[1]。藜麦具有耐寒、耐旱、耐盐碱和生长在贫瘠土壤的能力[2]。藜麦不含麸质,是素食主义者的理想食品。藜麦是一种全蛋白食品,蛋白质含量高达12%~23%[3],且氨基酸含量丰富,其中赖氨酸含量是普通谷物的2倍,氨基酸组成接近FAO推荐的理想蛋白比例,是一种很好的植物蛋白来源[4]。
藜麦富含淀粉、脂肪、膳食纤维和多种营养元素,有着“营养黄金”之称。藜麦及其种子可用于啤酒酿造,藜麦芽可加入沙拉中食用[5],此外,藜麦还可用于味噌[6]、酱粉、黄酒、饮料、饼干、面包等调味品和食品的制作。藜麦具有多种化学成分,包括皂素、植物甾醇、植物蜕皮激素、酚类物质和生物活性肽。因此,藜麦是一种功能性食品[7]。
研究表明,藜麦多肽液具有抗氧化、抑制血管紧张素转换酶活性[8]、降血糖等作用。目前,对藜麦的相关研究主要集中在黄酮、多酚、蛋白等提取分离和相关活性研究上,酶解藜麦蛋白制备功能活性肽的报道较少,Vilcacundo R等[9]模拟人体胃肠环境消化藜麦蛋白,分离出具有抑制二肽酶IV、α-淀粉酶、α-葡糖苷酶活性肽链。田旭静等[10]以风味蛋白酶和碱性蛋白酶为1∶1酶解藜麦糠蛋白制备抗氧化肽,其活性与剂量呈量效关系。
实验利用藜麦为材料,提取蛋白进行酶解,以酶解后的多肽液对α-淀粉酶的抑制率为评价指标,筛选出最佳蛋白酶,通过酶解条件优化实验获得最佳酶解工艺条件,为藜麦的相关研究和保健酒类饮料的开发及应用提供了参考[11]。
1 材料与方法
1.1 材料与试剂
藜麦:粉碎过60目筛脱脂、烘干,山西稼祺藜麦开发有限公司;牛血清蛋白:武汉华顺试剂耗材有限公司;正己烷、氢氧化钠、盐酸、酒石酸钾钠、三氯乙酸、可溶性淀粉:分析纯,国药集团化学试剂有限公司;中性蛋白酶(100 U/mg)、碱性蛋白酶(200 U/mg)、风味蛋白酶(20 U/mg)、胰蛋白酶(250 U/mg)、α-淀粉酶(2×104U/mL,用pH 6.9的磷酸盐缓冲溶液配成10 U/mL使用):上海源叶生物科技有限公司。
1.2 仪器与设备
AR313电子天平、FE20 pH计 梅特勒-托利多仪器(上海)有限公司;HK-04A粉碎机 广州市旭朗机械设备有限公司; Multifuge X1R高速冷冻离心机 赛默飞世尔科技(上海)有限公司;UV-1000 分光光度计 日本岛津科技有限公司;85-2型磁力搅拌机 上海司乐仪器有限公司。
1.3 方法
1.3.1 藜麦蛋白酶解工艺
称取一定量粉碎脱脂后的藜麦粉,采用碱溶酸沉法提取藜麦粗蛋白[12],将提取的粗蛋白样品配制成1%质量浓度的蛋白液,分别用不同的蛋白酶进行酶解,酶解完后沸水浴灭酶10 min,冷却,以8000 r/min离心10 min,收集上清液测其多肽含量,比较不同酶解条件制备的酶解液对α-淀粉酶活性的抑制率,以研究藜麦多肽制备的酶解工艺。
1.3.2 检测方法
1.3.2.1 多肽含量及得率测定
采用双缩脲法绘制牛血清蛋白标准曲线[13,14]。
多肽液样品多肽含量的检测:取3 mL样品溶液加入3 mL 15%(W/V)的三氯乙酸(TCA)水溶液于漩涡混合仪上混合均匀,然后在10000 r/min下离心10 min ,取上清液于540 nm下测定OD值,对照标准曲线求得样品溶液中的多肽浓度C(g/L),进而可求得样品中的多肽含量。

1.3.2.2 藜麦多肽液对α-淀粉酶活性抑制率的测定
样品管:取0.5 mL离心后的多肽液和等量的10 U/mL α-淀粉酶溶液于37 ℃加热10 min,然后加入2%可溶性淀粉1 mL,反应5 min,加入DNS试剂1 mL,沸水浴5 min冷却,稀释至25 mL,于520 nm测定吸光度OD。对照管:用蒸馏水代替多肽液,记作OD′,以蒸馏水代替淀粉液作空白[15],记作OD″。
1.3.3 藜麦蛋白酶解工艺优化
1.3.3.1 蛋白酶的筛选
选择中性蛋白酶、碱性蛋白酶、风味蛋白酶[16]、胰蛋白酶4种蛋白酶分别进行初步水解。水解条件:藜麦蛋白质量浓度1%,加酶量0.3×104U/g,在不同蛋白酶各自最适pH和温度条件下酶解(见表1),酶解时间为 60 min,以多肽得率和α-淀粉酶活性抑制率为评价指标,筛选出多肽得率高且活性抑制率高的蛋白酶,进行下一步试验。
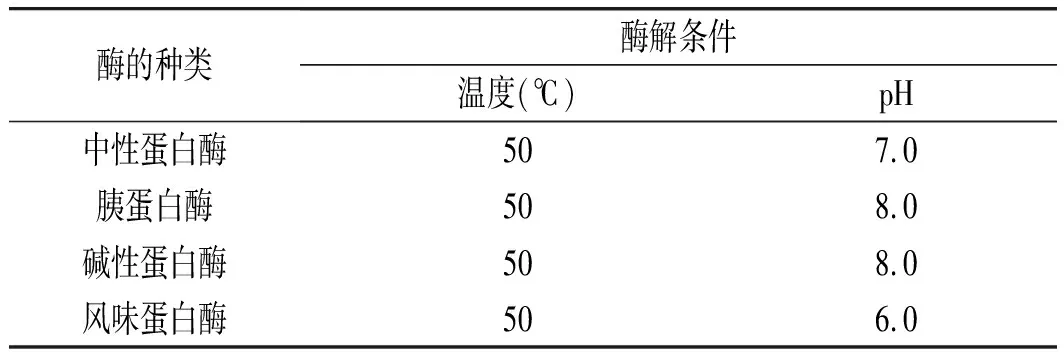
表1 不同酶所对应不同的酶解条件Table 1 Different enzymatic hydrolysis conditions fordifferent enzymes
1.3.3.2 藜麦蛋白酶解单因素试验
酶解时间对α-淀粉酶活性抑制率的影响:称取0.5 g藜麦粗蛋白粉5份,分别加入50 mL的水配制成1%的蛋白溶液,在pH 8.0、温度50 ℃、加酶量0.3×104U/g的条件下分别酶解1,1.5,2,2.5,3 h。
酶解温度对α-淀粉酶活性抑制率的影响:称取0.5 g藜麦粗蛋白粉5份,分别加入50 mL的水配制成1%的蛋白溶液,在温度30,40,50,60,70 ℃、pH 8.0、加酶量0.3×104U/g的条件下酶解2 h。
pH对α-淀粉酶活性抑制率的影响:称取0.5 g藜麦粗蛋白粉5份,分别加入50 mL的水配制成1%的蛋白溶液,设定酶解温度50 ℃,加酶量0.3×104U/g,分别在pH 6,7,8,9,10的条件下酶解2 h。
加酶量对α-淀粉酶活性抑制率的影响:称取0.5 g藜麦粗蛋白粉5份,加入50 mL的水配制成1%的蛋白溶液,设定pH 8,温度50 ℃,分别在加酶量0.2×104,0.3×104,0.4×104,0.5×104,0.6×104U/g的条件下酶解2 h。
1.3.4 响应面试验
依据蛋白酶解工艺的单因素试验结果,以温度、pH、加酶量、酶解时间4个因素为自变量,以α-淀粉酶活性抑制率为响应值,采用响应面法四因素三水平试验进行优化,按照Box-Behnken原理进行试验设计[17]。
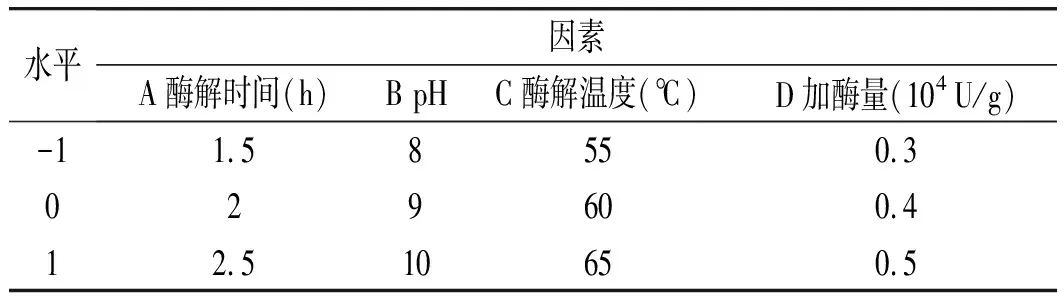
表2 酶解工艺响应面水平与因素设计表Table 2 Response surface levels and factors of enzymatic hydrolysis process
1.3.5 数据处理
采用Orign 8.5、Design Expert 8.0.6软件对试验数据进行处理。
2 结果与分析
2.1 藜麦提取蛋白酶解制备多肽结果
2.1.1 多肽含量标准曲线的绘制

图1 双缩脲法测得多肽标准曲线Fig.1 Standard curve of polypeptide determinedby biuret method
由图1可得线性方程为,y=0.1687x-0.0119,相关系数为R2=0.9946。
式中:y为吸光度A;x为牛血清蛋白浓度,mg/mL。
2.1.2 蛋白酶的筛选
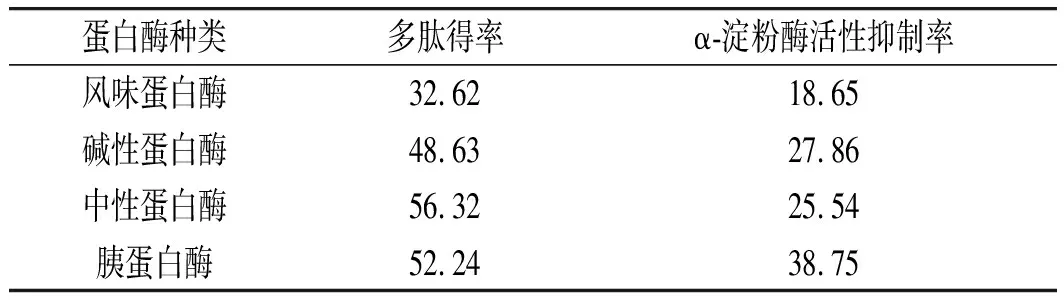
表3 不同蛋白酶对藜麦粗蛋白的酶解效果比较Table 3 Comparison of enzymatic hydrolysis effectsof quinoa crude protein by different proteases %
由表3可知,4种酶酶解后的多肽得率都超过了30%,对α-淀粉酶活性具有一定的抑制作用,说明4种酶对藜麦蛋白都具有明显的酶解效果,其中中性蛋白酶和胰蛋白酶的多肽得率超过50%,而碱性蛋白酶和胰蛋白酶酶解后的抑制率较风味蛋白酶和中性蛋白酶高,蛋白酶解程度越大,多肽得率也越高,生成的低分子肽段就越多,具有抑制活性的肽段容易被降解导致抑制活性降低。考虑到两种因素,选择胰蛋白酶进行下一步的酶解试验。
2.1.3 胰蛋白酶单因素酶解条件研究
酶解时间、酶解温度、pH、加酶量对α-淀粉酶活性抑制率和多肽得率作用效果见图2~图5。
2.1.3.1 酶解时间对酶解效果的影响

图2 酶解时间对多肽得率和α-淀粉酶抑制率的影响Fig.2 Effect of hydrolysis time on peptide yield and α-amylase inhibition rate
由图2可知,随着酶解时间的延长,多肽得率逐渐升高,这说明在蛋白液浓度一定的条件下,酶解时间的延长使酶与蛋白质的作用时间越充分,蛋白质被水解的程度大[18],生成小分子片段的短肽越多,从而其多肽含量逐渐升高。在1~3 h之间酶解速率逐渐增加,在酶解初期,蛋白液中残留的多糖、大分子蛋白会沉淀在烧杯底部,随着酶与底部大分子蛋白充分接触,酶解速率迅速增加。α-淀粉酶活性抑制率出现先升高后降低的趋势,在酶解时间为2 h 时,α-淀粉酶活性抑制率达到最大值27.1%,随着酶解的持续进行,之前酶解得到的α-淀粉酶抑制肽被酶解为更小分子的肽段,从而活性抑制率降低。考虑两种酶解试验结果,选择酶解时间2 h为最佳。
2.1.3.2 pH对酶解效果的影响

图3 pH对多肽得率和α-淀粉酶抑制率的影响Fig.3 Effect of pH on peptide yield andα-amylase inhibition rate
pH的改变影响了酶的最适反应条件,易使酶失活和降解,进而造成酶解反应的中止。由图3可知,多肽得率和α-淀粉酶活性抑制率都出现了先升高后下降的趋势,在pH 8.0时多肽得率和α-淀粉酶活性抑制率都达到最高值,之后α-淀粉酶抑制率迅速减小,多肽得率趋于平缓并略有减小,由于过酸过碱的环境会使酶的活性部位遭到破坏或解离,pH对酶解效果至关重要。因此,选定胰蛋白酶的酶解pH为8.0进行酶解。
2.1.3.3 酶解温度对酶解效果的影响

图4 酶解温度对多肽得率和α-淀粉酶抑制率的影响Fig.4 Effect of hydrolysis temperature on peptide yieldand α-amylase inhibition rate
由图4可知,多肽得率呈现持续升高趋势,由于温度的升高增大了酶与蛋白分子的接触机会,酶的活性也随之增强,多肽得率逐渐升高,α-淀粉酶活性抑制率也随之升高,在50 ℃达到最大值26.8%,随后出现降低,温度超过60 ℃可能会直接使活性肽进一步解离,丧失抑制活性,从而使α-淀粉酶活性抑制率下降。因此,选择酶解温度在50 ℃左右。
2.1.3.4 加酶量对酶解效果的影响
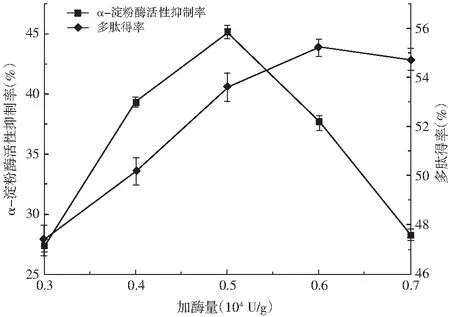
图5 加酶量对多肽得率和α-淀粉酶抑制率的影响Fig.5 Effect of the additive amount of enzyme on peptide yield and α-amylase inhibition rate
由图5可知,随着加酶量的增加,多肽得率逐渐上升,α-淀粉酶活性抑制率先上升后下降,增大加酶量使得酶与底物蛋白分子充分接触,一些沉淀在底部的大分子蛋白也随着被水解,而随之加酶量进一步增加,一些具有α-淀粉酶活性抑制的肽段也随之被水解为更小分子量的短肽,α-淀粉酶活性抑制率出现降低。当加酶量在0.5×104U/g时,α-淀粉酶活性抑制达到最大值45.1%。因此,选择加酶量在0.5×104U/g比较适宜。
2.2 胰蛋白酶响应面优化设计
2.2.1 响应面设计及结果
响应面试验结果见表4,采用Design Expert 8.0.6软件对表4中数据进行方差、显著性分析,结果见表5。

表4 响应面试验设计及结果Table 4 Design and results of response surface experiment

续 表
表5 回归方程分析Table 5 Analysis of the regression equation
以酶解时间、pH、温度、加酶量为响应变量,α-淀粉酶活性抑制率为响应值,通过响应面回归方程分析可知,藜麦多肽液具有α-淀粉酶活性抑制率的多元二次拟合回归方程为:
Y=44.09+2.53A-1.87B+4.39C+4.47D+1.86AB+1.61AC+7.67AD+9.20BC+1.90BD-4.19CD-9.11A2-12.84B2-1.78C2-9.79D2。
由表5可知,模型的P<0.0001,表示模型回归差异极显著,失拟项P=0.8453>0.05,不显著,说明拟合程度良好[19],能真实反映实际情况,模型可靠;模型回归决定系数R2=0.9728>0.9,说明α-淀粉酶活性抑制率结果与方程预测结果具有一致性,模型相关度好。试验模型校正系数RAdj2=0.9457,表明模型拟合程度较高[20]。说明有94.57%试验结果值可以用此模型来解释,因此结果可靠,模型可以对α-淀粉酶活性抑制率值进行分析和预测。由回归方程式中一次项系数可知,各因素对α-淀粉酶活性抑制率作用大小顺序为;加酶量(D)>温度(C)>酶解时间(A)>pH(B)。
2.2.2 响应面分析与条件优化
响应面曲线分析,各因素间等高线图和交互作用见图6。
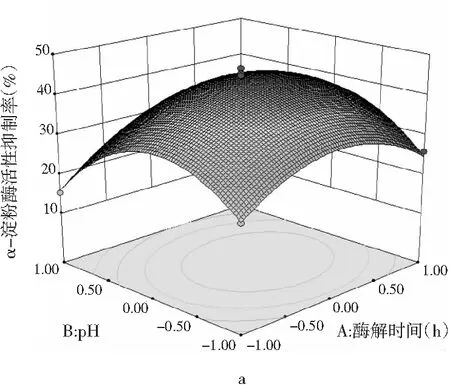
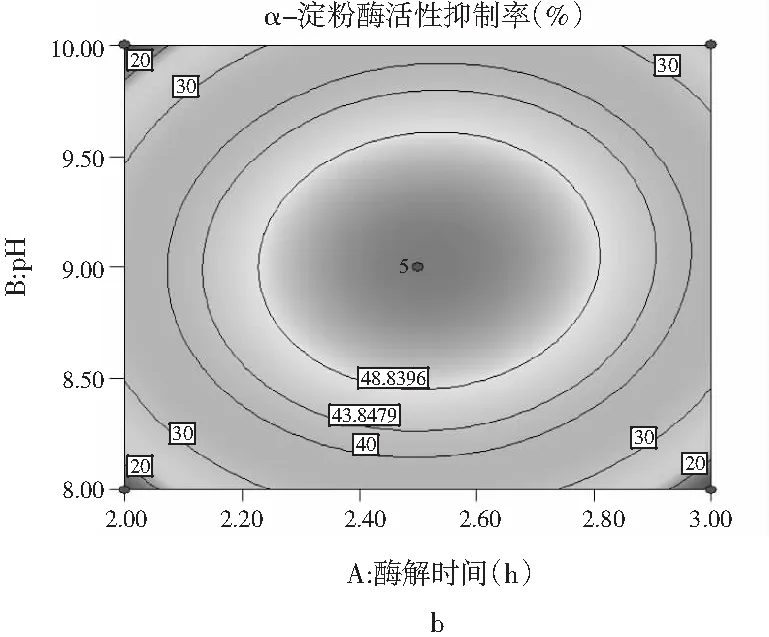



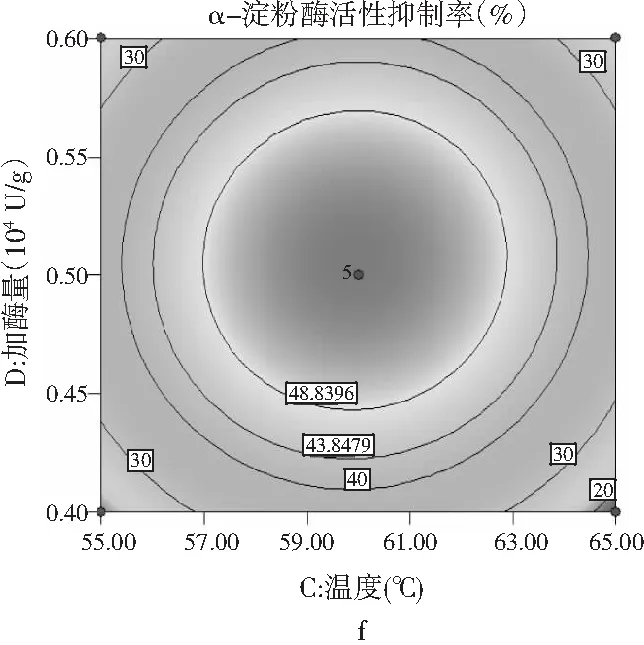
图6 各因素交互作用对多肽液抑制α-淀粉酶活性作用的响应面和等高线图Fig.6 Response surface and contour diagrams of theinteraction of various factors on peptidesinhibiting α-amylase activity
由图6可知,pH与时间、温度与pH、加酶量与温度交互作用的显著性与表5中交互项P值的分析结果一致。a,c,e均呈椭圆形,表明因素间交互作用显著,等高线的形状可以判断交互作用的强弱,3组等高线图中加酶量与温度交互作用最好,等高线中的曲线围绕着响应面在中间处形成顶点,即抑制率最大值。a,c,e响应面图开口都朝下,随着每个因素值的增加而响应值增大,在达到响应值最高点后,随着因素值的增大而响应值减小,响应面的顶点即为最大响应值。
经Design Expert 8.0.6软件分析得到优化条件为:酶解时间2.22 h、pH 8.95、温度60 ℃、加酶量0.53×104U/g,在此条件下,α-淀粉酶活性抑制率的理论最大值为47.82%,采用这一结果并结合实际条件,将酶解条件改为:酶解时间2 h、pH 9.0、温度60 ℃、加酶量0.5×104U/g,得到的试验结果为45.54%,与理论预测值基本一致,建立的模型可以较好地反映藜麦多肽液具有抑制α-淀粉酶活性的能力,同时多肽得率为63.54%。
3 结论
以藜麦蛋白为试验材料,研究酶解后的多肽对α-淀粉酶活性的抑制率,筛选出最适用酶。在单因素酶解条件下,选择酶解时间、pH、温度、加酶量进行Box-Behnken试验设计,优化结果显示:加酶量和酶解温度对α-淀粉酶活性的抑制作用比pH和酶解时间要强。试验结果表明:制备藜麦多肽的最佳提取工艺为:酶解时间2 h、pH 9、温度60 ℃、加酶量0.5×104U/g,在此条件下α-淀粉酶活性抑制率为45.54%。为了提高多肽液对α-淀粉酶的活性抑制作用,还需对酶解多肽液进行进一步的纯化处理。
