Nisin产生菌株的筛选及产物初步探究与鉴定
2019-12-19李俊辉王燕周宝琳李丕武赵鑫君王婷
李俊辉,王燕,周宝琳,李丕武,赵鑫君,王婷*
(1.齐鲁工业大学(山东省科学院),山东省微生物工程重点实验室,济南 250353;2.山东省中医药大学,济南 250353)
细菌素(bacteriocin) 是细菌在代谢过程中由核糖体合成并分泌到环境中的一类具有抑(杀)菌活性的代谢产物, 通常是低分子量的多肽或者蛋白类物质[1,2]。自1925年Gratia发现第一个细菌素以来,已发现上百种细菌可以产生细菌素[3,4]。而乳酸链球菌素(Nisin)是由某些乳酸乳球菌产生的具有34个氨基酸残基的多肽类物质[5,6],能对某些革兰氏阳性菌,尤其对金黄色葡萄球菌(Staphylococcusaureus)等食源性致病菌起到强烈的抑制作用[7]。作为天然的抑菌剂,可以减少或避免化学防腐剂所带来的安全隐患, 提高食品品质,是一类极具开发潜力的天然食品防腐添加剂[8]。
Nisin是由乳酸乳球菌产生的,但并非所有的乳酸乳球菌只产生Nisin,还有热敏感的双球菌素(diplococcin)、乳球菌素(lactococcin)等多种细菌素[9,10]。如今虽然许多文章对Nisin产生菌的筛选进行了研究,但大多停留在生理生化试验的基础上进行初步的断定,在鉴定产生Nisin菌株的方法上尚不够严谨。因此,能够快速、准确地筛选到产Nisin的乳酸菌株,为天然抑菌物质与乳酸菌在发酵食品相结合的应用方面开辟更广阔的前景,为生物食品抑菌剂提供理论基础[11]。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及指示菌
市售新鲜小白菜叶;Nisin标准品:Sigma公司;H103大孔吸附树脂:陕西乐博生化科技有限公司;金黄色葡萄球菌:由本实验室提供。
1.1.2 培养基
改良GM17培养基(发酵培养基):酪蛋白胨5 g,大豆蛋白胨2.5 g,牛肉粉5 g,酵母浸粉5 g,蔗糖5 g,抗坏血酸0.5 g,β-甘油磷酸钠,硫酸镁0.25 g, 蒸馏水1000 mL,自然pH,若配制固体培养基则加入1.5%琼脂。
筛选培养基:在改良的GM17培养基中添加0.004%溴甲酚紫和1500 IU/mg的Nisin标准品。
指示菌培养基:1% K2HPO4牛肉膏蛋白胨培养基: 牛肉膏3 g,蛋白胨10 g,NaCl 5 g,K2HPO410 g,琼脂15 g,蒸馏水1000 mL,自然pH。
1.1.3 试剂
三乙胺(分析纯)、磷酸:天津市富宇精细化工有限公司;乙腈(色谱纯):上海星可高纯溶剂有限公司;pH 3.0的水为用盐酸溶液将超纯水调至 pH (3.0±0.1)而得。
1.2 仪器与设备
ZHJH-C1214C垂直流超净工作台 上海智城分析仪器制造有限公司; BPH-9042恒温培养箱 上海一恒科学仪器有限公司;HVE-50全自动高压灭菌锅 华粤集团有限公司;Rotavapor R-210 型旋转蒸发仪 瑞士 Buchi 公司;LC-VP岛津液相仪 日本岛津公司;Inertsil ODS-3 C18色谱柱(250 mm×4.6 mm,5 μm ) 日本GL Sciences公司;实验用水为 Milli-Q 纯水仪制备的超纯水。
1.3 方法
1.3.1 乳酸链球菌素母液的配制
称取0.01 g Nisin标准品(原始效价为1000 IU/mg),溶于20 mL 0.02 mol/L盐酸溶液中,此时效价为5000 IU/mL, 使用前需经孔径为0.22 μL的微孔滤膜过滤除菌。
1.3.2 样品处理
取市售新鲜小白菜叶,无菌水去除表面泥垢后,切片,大小在1 cm2为宜。
1.3.3 分离方法
将处理好的白菜叶片置于5 mL液体筛选培养基中,30 ℃静置培养24 h。将该富集培养液制备成10-4、10-5、10-6稀释度的菌悬液,分别吸取0.1 mL涂布于固体筛选培养基上,30 ℃培养48 h,挑取明显使培养基变黄的单菌落,转接到液体培养基中培养24 h,测定发酵液的酸度,将产酸的菌做革兰氏染色镜检,最终得到革兰氏阳性、球形、具有Nisin耐受性的乳酸菌菌株,以进行下一步的抑菌活性测定。
1.3.4 抑菌活性的测定1.3.4.1 指示菌悬液的制备
将金黄色葡萄球菌于1% K2HPO4牛肉膏蛋白胨液体培养基中振荡培养,取生长量为107CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。
1.3.4.2 菌株发酵液的预处理
使用5 mol/L的HCl将30 ℃培养24 h的乳球菌发酵液调至pH 3,于90 ℃水浴30 min,6000 r/min离心8 min,去除沉淀,收集上清液备用。
1.3.4.3 牛津杯法测定抑菌活性
取0.2 mL指示菌悬液涂平板,待干燥后用无菌镊子放置牛津杯(内径6.0 mm,高8.0 mm)中。取经预处理后的发酵上清液50 μL加入牛津杯内,并做阴性和阳性对照,37 ℃培养48 h,观测抑菌圈大小。
1.3.5 菌株鉴定
将具有抑菌特性的菌株提取基因组,由生工生物工程(上海)股份有限公司进行16S rDNA鉴定,数据提交美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI),通过基本本地队列搜索工具(Basic Local Alignment Search Tool, BLAST)进行同源性比较,用Mega 7.0软件构建系统发育树。
1.3.6 抑菌物质特性的初步探究与鉴定1.3.6.1 发酵时间对抑菌性的影响
将筛选的菌株接种到发酵培养基中,30 ℃发酵培养48 h,培养过程中分别在12~48 h期间,每4 h取发酵液,以牛津杯法做抑菌圈试验(重复3次,取平均值)。
1.3.6.2 热处理和pH对抑菌物质活性的影响
使用盐酸溶液将30 ℃培养24 h的乳球菌发酵液分别调至pH 2~pH 9,于90 ℃水浴30 min热处理,以未热处理的发酵液做对照,以牛津杯法做抑菌圈试验,测定抑菌物质的活性(重复3次,取平均值)。
1.3.7 高效液相色谱法(HPLC)分析1.3.7.1 发酵液浓缩纯化
将30 ℃下培养24 h的发酵液调至pH 3.0,于90 ℃热处理30 min并于冰上迅速放凉,离心10 min去除沉淀。然后通过摇瓶吸附的方法[12],加入1%的H103大孔吸附树脂,于37 ℃下摇动吸附8 h后装入层析柱。使用pH 3的75%乙醇溶液进行洗脱,洗脱液用 Nisin 活性 Buffer(pH 3的盐酸水溶液)稀释2倍,于旋转蒸发仪上在低温(30 ℃)悬蒸30 min,待乙醇除净后,将温度调至50 ℃将多余的水分悬蒸出去,最终得到稀释前溶液体积的1/3,该溶液即为Nisin纯化液。
1.3.7.2 流动相配制
缓冲液A:48 mmol/L三乙胺水溶液,用磷酸调至pH 3.0。
缓冲液B:缓冲液A与乙腈的混合液(缓冲液A体积含量为22.5%)。
1.3.7.3 标准品和样品前处理
精确称取0.01 g Nisin标准品,用0.02 mol/L盐酸溶液溶解,使效价为10000 IU/mL,用孔径0.22 μm的水相微孔滤膜过滤。纯化液样品,同样用孔径0.22 μm的水相微孔滤膜过滤。
1.3.7.4 色谱条件
流动相A,B两相:0~15 min,缓冲液B由30%上升到50%;15~20 min,缓冲液B维持50%。
色谱柱:反向C18柱;柱温:35 ℃;流速:1 mL/min;检测波长:235 nm;进样量:20 μL。
2 结果与分析
2.1 Nisin产生菌的平板初筛
在初筛过程中,通过设定4个筛选条件从样品中定向筛选Nisin产生菌,以尽可能减少杂菌对试验的影响。首先,基于Tsai H J等[13]的研究,编码乳酸链球菌素前体的基因(nip+)和其抗性基因(nis+)以及蔗糖发酵基因(suc+)紧密连锁。因此,以蔗糖作为唯一碳源,用于Nisin产生菌的筛选。其次,将培养基中添加一定效价的Nisin,可以减少部分革兰氏阳性菌的生长,减少杂菌污染,而对于要筛选的产Nisin的乳酸乳球菌来讲,由于其本身可以产生Nisin,因此,可以在具有一定效价的培养基上正常生长。再者,由于Nisin是由乳酸乳球菌产生的,因此,配以溴甲酚紫作指示剂,可以快速找到产酸的单菌落,将其挑出,划线培养,见图1。最后,通过革兰氏染色,镜检(见图1中B),筛选革兰氏阳性、细胞形态为球形的菌株。综上,选择同时具备上述4个条件特征的菌株进行下一步的抑菌试验。
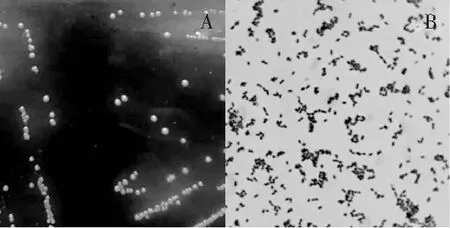
图1 菌落形态A和细胞形态BFig.1 Colony morphology A and cell morphology B
2.2 菌株抑菌活性检测
将初步筛选到的菌株进行抑菌圈试验,验证其发酵产物是否具有抑菌特性,见图2。4个样品均通过相同的处理, 1号为发酵培养基做阴性对照,4号是发酵培养基中加入了Nisin标准品的阳性对照。可以看到不含有Nisin的1号没有产生抑菌圈,而加入Nisin的3号产生了最大的抑菌圈,2号和4号为筛选到的具有较好抑菌效果的两株菌,其中4号的抑菌圈更大,表现出更好的抑菌效果,将其命名为L-217。

图2 两株菌株的抑菌效果图Fig.2 Antibacterial effect of two strains
2.3 菌种鉴定
将筛选到的具有较好抑菌效果的L-217菌株提基因组,PCR纯化后,送到生工生物工程(上海)股份有限公司进行测序分析,将得到的测序结果在NCBI中进行同源性比较,同源性较高的为乳酸乳球菌属(Lactococcuslactis),同源性大于99%。将其与搜索到的同源性大于97%的菌株,用Mega 7.0软件构建系统发育树,见图3。发现L-217菌与乳酸乳球菌属(Lactococcuslactis)最近,与山羊奶乳球菌属(Lactococcushircilactis)、富士山乳球菌(Lactococcusfujiensis)和象白蚁乳球菌(Lactococcusnasutitermitis)亲缘关系则较远,结合菌株形态和生理生化特征等综合分析, 鉴定该菌为乳酸乳球菌(Lactococcuslactis)。
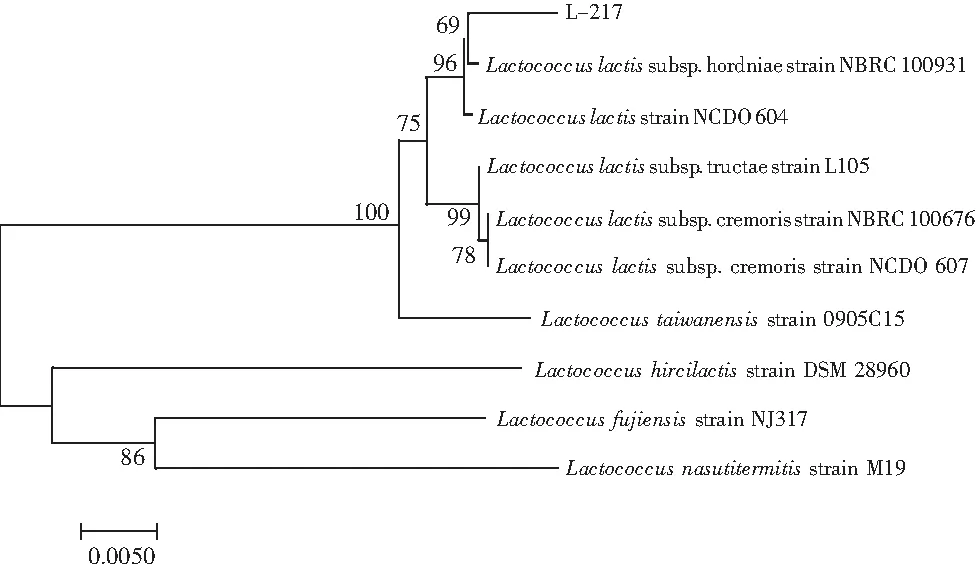
图3 菌株L-217的16S rDNA 的系统发育树Fig.3 Phylogenetic tree of 16S rDNA of strain L-217
2.4 产物的初步探究与鉴定
2.4.1 发酵时间对抑菌效果的影响
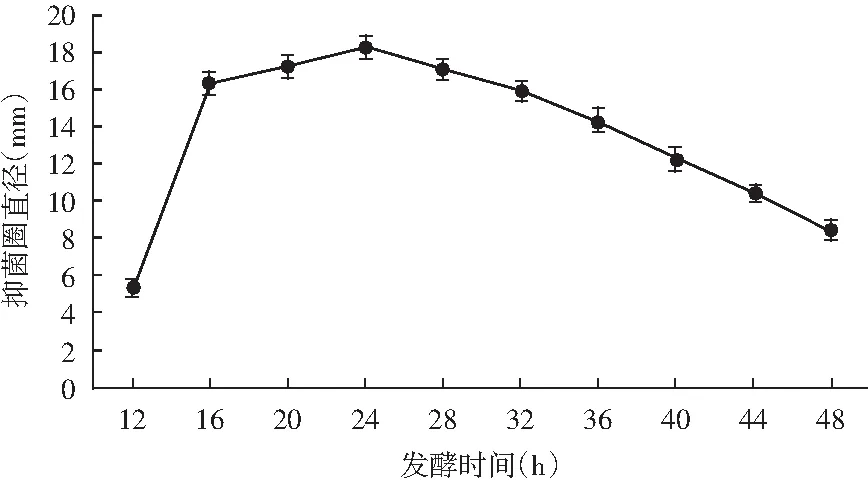
图4 发酵时间对抑菌效果的影响Fig.4 Effect of fermentation time on antibacterial effect
由图4可知,该菌在培养至12 h时开始产生抑菌物质,随时间增加,抑菌活性快速提高,在生长至24 h时,表现出最大的抑菌活性。随后,其抑菌活性呈现缓慢下降趋势,这可能是培养基中的营养物质不足,该菌开始利用自身产生的抑菌物质。因此,将发酵培养24 h作为该菌抑菌活性测定的最佳发酵时间。
2.4.2 热处理和酸处理对抑菌物质活性的影响
Nisin具有亲水和疏水两重性,即在N-末端存在大量的疏水残基,在C-末端存在着亲水基团,其表现出阳离子多肽的特性,等电点在碱性范围;其溶解度和稳定性等与溶液的pH值密切相关[14]。Nisin的溶解度随pH值的下降而提高,而在碱性条件下几乎不溶解。热稳定性与其在不同pH值下的溶解度有关。溶液在pH 2.5或更低值的盐酸溶液中煮沸,其活性不发生变化,即使在115 ℃加热一定时间还很稳定。121 ℃加热30 min,尚未完全失去活性。当pH值超过4时,温度升高会使它在水溶液中迅速失活。根据这一特点,对筛选到的菌株产生的抑菌物质进行研究,可对抑菌物质是否为Nisin 进行初步的鉴定。

图5 pH和热处理对发酵液中抑菌物质的影响Fig.5 Effects of pH and heat treatment on bacteriostatic substances in fermentation broth
由图5可知,未热处理过的样品,随着pH的升高,抑菌物质的活性呈下降趋势,在中性环境甚至是碱性环境下,不再具有抑菌活性,这与Nisin的溶解性特点相符合,随着pH的升高,溶解度降低,其活性也不稳定。此外,在pH 6时的抑菌圈直径并没有太大幅度的降低,从这一点可以排除是某些有机酸干扰下造成的假阳性,侧面验证了起到抑菌效果的物质就是细菌素。而在热处理条件下,可以发现在pH 2、pH 3的条件下,90 ℃热处理30 min,抑菌物质的活性和未热处理过的样品活性基本一致,说明该物质在pH 2~3的条件下,具有极高的耐热性。这一点可以说明不是由乳酸乳球菌产生的不具有耐热性的大分子双球菌素,进一步证实该抑菌物质极有可能就是具有热稳定性的Nisin。同时热处理的发酵液也可以排除过氧化氢对抑菌效果造成的假阳性干扰。
2.4.3 发酵液中抑菌物质的初纯化
通过大孔树脂动态吸附纯化后,得到纯化液中抑菌物质的浓度增大,表现出更好的抑菌活性,见图6。

图6 发酵液纯化过程中各样品抑菌效果图Fig.6 Antimicrobial effect of each sample in the purificationprocess of fermentation broth
A,B,C,D对应的样品分别是发酵液、吸附残液、洗脱液、旋蒸浓缩液,将4个样品做抑菌圈试验,可以看到发酵液本身存在抑菌物质,表现出抑菌特性;经大孔树脂吸附后的残液中不再具有抑菌活性,说明大孔树脂将抑菌物质全部吸附;而用pH 3.0的75%酒精洗脱后,加入Nisin活性Buffer稀释得到的洗脱液,产生了抑菌圈,说明抑菌物质被洗脱下来;最后通过旋蒸浓缩,去除溶液中酒精的同时,提高了样品中抑菌物质的浓度。由图6可知,旋蒸浓缩后的样品,抑菌圈又显著增大,为HPLC检测做好了准备。
2.4.4 HPLC对产物的分析鉴定
目前国内外关于 Nisin 的检测方法主要包括琼脂扩散法、生物荧光法、电泳法、比浊法和免疫吸附法等[15-19],而HPLC法用于测定Nisin含量不仅简便快速、精密度高而且重现性和稳定性好,因此,本文釆用的检测方法是Chan等[20]利用48 mmol/L三乙基胺磷酸盐在232 nm下对Nisin的检测方法。
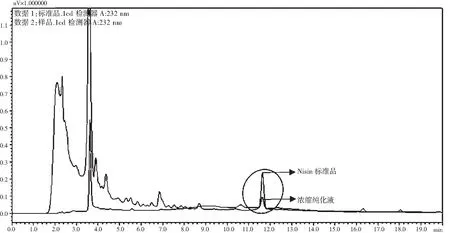
图7 浓缩纯化液与Nisin标准品对比图谱Fig.7 Contrast map of concentrated purified solution and Nisin standard sample
由图7可知,Nisin标准品在11.4 min左右出现了吸收峰,出峰时间与所提供方法的出峰时间基本一致。因此,确定了Nisin的出峰时间;通过样品与Nisin标准品的对比可以看出,在纯化的样品中虽然仍存在着许多杂质,但是它与标准品出现了同样的吸收峰,证明该样品中确实存在Nisin,印证了筛选到的就是产Nisin的乳酸乳球菌。
3 结论
本文根据乳酸乳球菌的特点先快速、准确筛选到具有抑菌特性的菌株,根据形态特征和生理生化特性,并通过16S rDNA序列分析技术,将其确定为乳酸乳球菌(Lactococcuslactis),命名为L-217。再进一步通过热处理和酸处理试验对抑菌物质性质进行初步的探究,最后通过HPLC法与Nisin标准品进行比对发现:该菌株产生的抑菌物质与Nisin标准品在同样的时间具有吸收峰。综合这两方面的结果,可以认定该菌株为具有产Nisin特性的乳酸乳球菌。本文从乳酸菌的筛选、Nisin的吸附、浓缩、纯化,HPLC检测进行分析,建立了一套快速、准确筛选Nisin产生菌株的方法,为从自然界中Nisin产生菌株的筛选和鉴定提供了有效依据,为天然食品添加剂Nisin的生产以及以此菌株为基础的功能食品、医用食品等领域提供了重要的菌株资源。
