检测β淀粉样肽不同构象的生物电化学传感器的研究进展
2019-11-12王健行田梦舒桐苏磊刘国东张学记
王健行 田梦 舒桐 苏磊 刘国东 张学记
摘 要 阿尔茨海默症是一种不可逆转的神经系统退行性疾病,随年龄增长,发病率近似呈现指数式增高,因此受到广泛关注。遏制阿尔茨海默症在人群中的蔓延,当前有效的方法是预防和早期诊断。目前,β淀粉样肽是研究最广且公认的可用于阿尔茨海默病早期诊断的重要生物标志物。近年来,电化学生物传感方法由于其操作简单、灵敏度高、稳定性好和对β淀粉样肽不同构象的信号响应快等优点,引起了研究者的广泛关注。本文从β淀粉样肽的生物识别单元的角度评述了近五年β淀粉样肽单体、低聚物和纤维检测的电化学生物传感方法的研究进展,并对该领域的发展趋势进行了展望。
关键词 阿尔茨海默症; 早期诊断; β淀粉樣肽; 电化学生物传感器; 评述
1 引 言
阿尔茨海默症是一种不可逆转的神经系统退行性疾病。该疾病患者常伴有认知衰退和记忆力丧失,严重时可发生运动障碍,并逐步丧失自理能力[1~4]。随年龄增长,阿尔茨海默症发病率近似呈指数式增高。据估计,到2025年,全世界约有3400万人罹患阿尔茨海默症,并且,伴随着如今日益加剧的世界人口老龄化趋势,老龄人数将以每20年翻一番的速度增长[4]。遗憾的是,目前尚无有效的治疗方法可延缓阿尔茨海默症的发病及发展,而对于遏制阿尔茨海默症在人群中的蔓延,当前更加有效的方法是预防和早期诊断[5]。然而,在阿尔茨海默症早期阶段,其患者的认知功能并无明显衰退,在常规临床检查过程中面临难确诊、易耽误有效医治时机的严峻问题。近期大量的研究指出[6],在血液或脑脊液等体液中存在可通过生物化学分析方法检测到的、与阿尔兹海默症早期阶段有关的特殊生物物质。这些生物物质也称为与阿尔兹海默症相关的生物标志物。目前,β淀粉样肽(Aβ)是研究最广且公认的可用于阿尔茨海默病早期诊断的重要生物标志物[7]。
Aβ单体由β 和γ 分泌酶水解淀粉样前体蛋白产生,通常由40或42个氨基酸(Aβ1-40或Aβ1-42)构成[8,9]。Aβ1-40和Aβ1-42可自发聚集[10],逐步形成可溶性Aβ低聚物和不可溶的Aβ纤维状高聚物。Aβ纤维可进一步形成不可溶的Aβ老年斑,即阿尔茨海默症的主要病理特征之一[11]。与Aβ1-40相比,Aβ1-42的聚集速度更快,能对神经细胞造成更大的自由基损伤,具有更强的神经毒性,其聚集产生的Aβ纤维可通过诱导大脑中的免疫应答,过度激活小胶质细胞,释放大量神经炎症因子,长期累积后,对神经造成有害的影响[11~13]。此外,有报道指出,与Aβ纤维相比,可溶性Aβ低聚物也可能具有更高的细胞毒性,可通过与突触后膜的神经元结合引发与阿尔茨海默症相关的突触功能障碍,是导致神经细胞毒性的主要Aβ构象[14,15]。因此,上述3种Aβ构象(Aβ单体、Aβ低聚体和Aβ纤维)均是早期诊断阿尔茨海默症的重要生物标志物。
目前,已发展出多种检测不同Aβ构象的技术手段,如酶联免疫吸附试验(ELISA)[16~18]、扫描隧道电子显微镜[19]、磁共振成像[20]、荧光成像[21]和电化学方法等。但是,这些方法大多操作复杂、耗时长且成本高。近年来,电化学生物传感方法由于具有操作简单、灵敏度高、稳定性好和对不同Aβ构象的信号响应快等优点,引起了研究者的广泛关注。电化学生物传感器的构建大多基于某些特定的、可特异性结合Aβ的生物小分子作为生物识别单元,如抗体、适配体、蛋白质和肽等。本文从Aβ生物识别单元的角度,综述了近五年Aβ单体、Aβ低聚物和Aβ纤维检测的电化学生物传感方法的研究进展,并对该领域的发展趋势进行了展望。
2 Aβ单体的检测
2.1 抗体识别单元
基于抗体 抗原特异性结合的电化学免疫传感器由于具有操作简单、灵敏度高等优点,已成为检测Aβ单体的主要电化学传感平台。如利用可特异性识别Aβ40单体的抗体构建电化学传感器,可在Aβ40低聚物、Aβ40纤维和Aβ40单体存在时选择性地检测Aβ40单体。最近,Xiang研究组利用Aβ40单体及其抗体构建了多种电化学传感器[22~24]。根据报道,在修饰有Aβ40单体抗体的纳米金颗粒与电极表面间增加通过静电力诱导的双链DNA的弹性缩合,可有效放大电化学检测信号,实现对Aβ40单体的高灵敏和高选择性检测[22]。他们还发现,Aβ40单体抗体对Aβ40单体和磷酸化Aβ40单体具有相近的亲和力,并在Aβ40单体抗体固定的金电极上实现了Aβ40单体和磷酸化Aβ40单体的共免疫捕获和电化学定量分析[23]。此外,抗体固定化对电化学免疫传感器的发展起着重要的作用。出色的抗体固定化方法不仅能固定高密度的抗体,还能使抗体的生物活性免遭破坏。Carneiro等[25]利用通过结合Aβ部分结构(1 17氨基酸)而特异性识别Aβ1-42的大鼠单克隆抗体(DE2B)作为识别单元,通过硫醇化作用使抗体DE2B功能化,促进具有适当取向的抗体固定,以增加抗体和Aβ1-42的接触机率,从而构建出无标记的、可检测Aβ1-42的电化学免疫传感器。该特异性检测Aβ1-42的电化学免疫传感器的灵敏度高,在阿尔兹海默症早期诊断中具有应用前景。Yoo等[26]利用交叉微电极传感器系统作为阿尔兹海默症血液诊断的传感平台,开发了一种阻抗免疫传感器,用于检测Aβ。该传感器系统通过结合信号处理系统和血浆到缓冲液的介质更换技术,展现了高度的灵敏性,可检测到血液中超低的Aβ浓度(pg/mL),而且,该具有更换介质能力的传感系统可用于野生型和转基因型大鼠血浆样品中Aβ的检测,展现出在阿尔茨海默症血液诊断中区分健康人和患者的潜力。在另一种阻抗免疫传感器的构建中,Zakaria等[27]发展了一种新型抗体固定方法,是将盘形Pt/Ir微电极与导电芳香族聚合物电聚合后,通过戊二醛交联以固定单克隆的Aβ抗体。与基于吸附、被动修饰抗体的策略相比,该抗体固定方法在检测精度、稳定性和灵敏度等方面,极大地提升了Aβ1-40的阻抗检测性能。该免疫传感器对Aβ1-40检出限为4.81 pg/mL。该免疫传感器通过测试感染阿尔茨海默症的大鼠脑组织样品,证实其在阿尔茨海默症的早期诊断中具有实际应用价值。
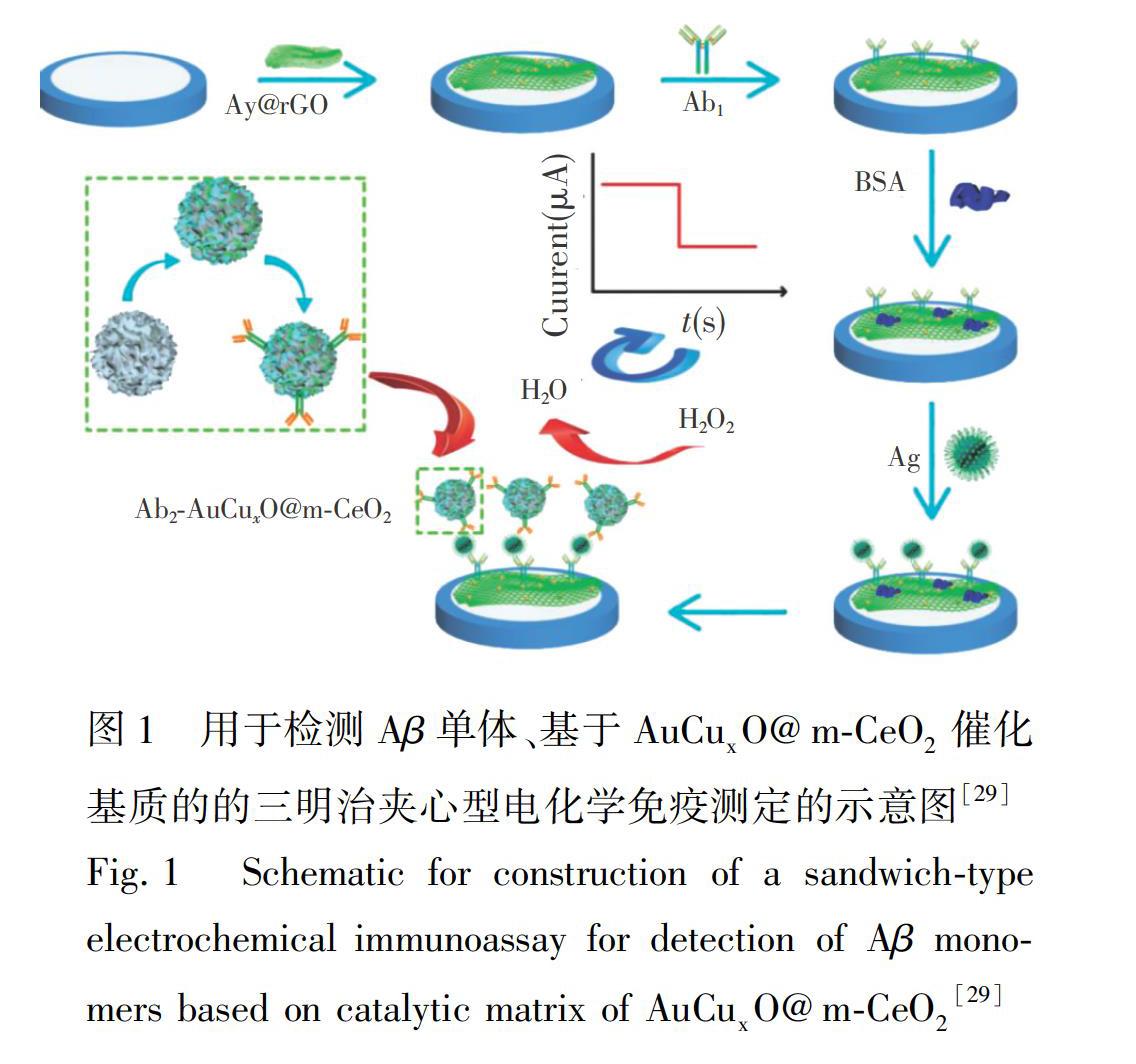
用于检测Aβ的三明治夹心型电化学免疫传感器通常还需进行抗体固定化操作,如固定抗体所需连有标记物的纳米颗粒。Han等[28]利用封装在锌 金属 有机框架(Zn MOF)中的电化学活性分子(二茂铁,Fc)作为信号标签,设计了一种可检测Aβ的电化学三明治夹心型免疫传感器。该传感器在极性有机溶剂和酸/碱环境中仍能表现出良好的稳定性。在该Fc Zn MOF结构上进一步修饰金纳米颗粒(Au nanoparticles, Au NPs),以作为固定抗体(Ab2)的装载平台,所制得的免疫传感器在Aβ检测中展现出高灵敏性,其线性检测范围为0.0001~100 ng/mL,检出限为0.03 pg/mL。最近,Gao等[29]利用介孔CeO2包埋AuCuxO(AuCuxO @m CeO2)纳米复合材料作为催化基质,构建了基于修饰有Au NPs的还原氧化石墨烯(Au@rGO)传感平台的三明治夹心型电化学免疫传感器,用于Aβ单体的检测。如图1所示,在该传感器中,通过m CeO2与抗体的羧基官能团的桥接键合固定高密度的抗体。该传感器对Aβ具有极高的灵敏度和较宽的检测范围(100 fg/mL~10 ng/mL)。另外,Diba等[30]报道了一种三明治夹心型电化学免疫分析方法。在该方法中,抗体(12F4和1E11)需固定在用硫醇修饰的聚乙二醇(PEG SH)和3 巯基丙酸(MPA)功能化的金纳米粒子上。该电化学免疫传感器对Aβ检测具有超高灵敏度,其线性响应范围较宽(100 fmol/L~25 pmol/L),检出限较低(100 fmol/L)。
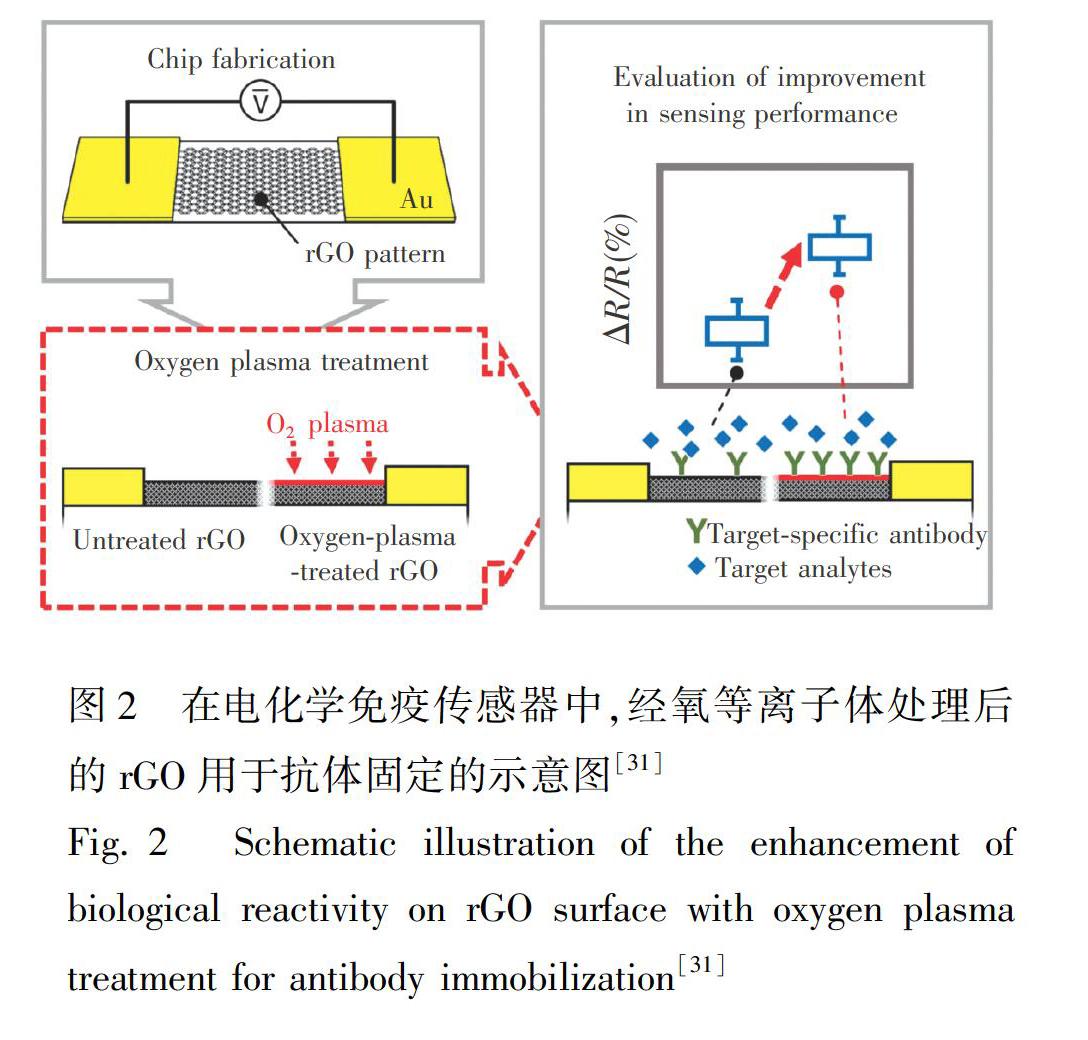
此外,近年还出现了无需复杂操作步骤的的抗体固定方法。如利用经过氧等离子体处理的rGO可直接固定抗体,并构建出新型电化学免疫传感器,并特异性检测Aβ[31]。rGO经过氧等离子体处理可改善其表面在生物作用中的敏感程度(图2),rGO表面的特异性靶向作用增强了3.33倍,而且,与基于未经处理的rGO构建的免疫传感器相比,该免疫传感器的电信号响应增强了3.94倍。
2.2 凝溶胶蛋白识别元件
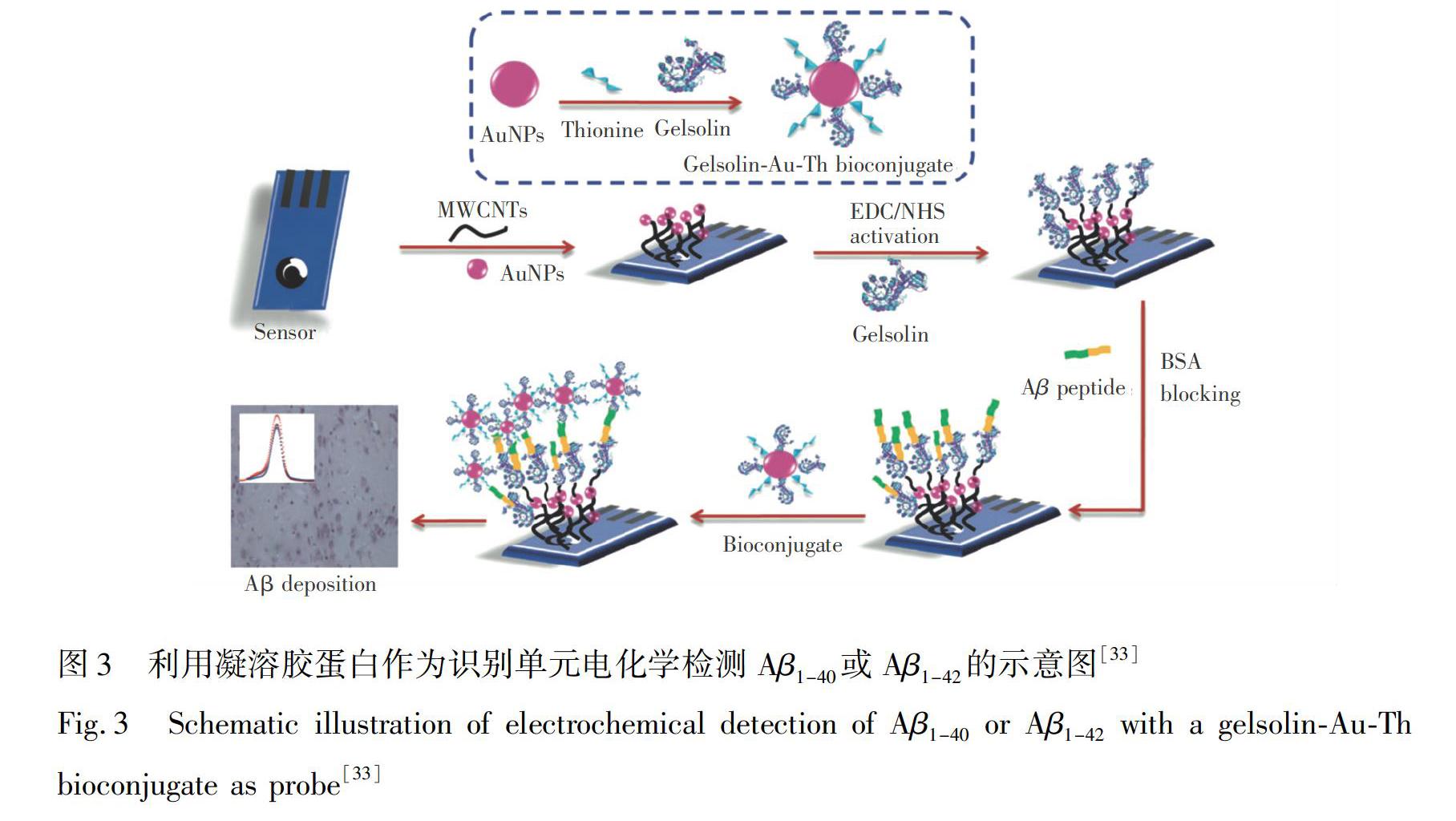
1990年首次报道了凝溶胶蛋白对Aβ的识别能力。凝溶胶蛋白是一种分泌蛋白,可特异性结合Aβ1-40和Aβ1-42单体[32],但无法识别Aβ的低聚体构象,是一种新型可代替抗体的特异性检测Aβ1-40或Aβ1-42单体的生物识别元件。因此,凝溶胶蛋白可用于构建无昂贵抗体的检测Aβ1-40/1-42单体的新型电化学传感器。如Yu等[33]利用金纳米颗粒(Au NPs)和多层碳纳米管(MWCNTS)为电极基底,以改善传感过程中的电子转移,将凝溶胶蛋白受体固定在电极表面。具体地,凝溶胶蛋白特异性结合Aβ1-40/1-42单体后,再与凝溶胶蛋白和硫堇(Thionine, Th)标记的金纳米颗粒结合。然后,通过电化学检测Th的还原,以定量分析Aβ1-40/1-42单体浓度。电化学传感原理如图3所示。该传感器的检测范围为0.2~40 nmol/L, 检出限约为50 pmol/L。
利用该传感器检测感染阿尔茨海默症大鼠的脑脊液(CSF)和大脑中的Aβ1-40/1-42单体发现,其Aβ1-40/1-42单体浓度水平低于正常大鼠。最近,Yu等[34]设计了另一种可特异性检测Aβ1-40/1-42单体的基于凝溶胶蛋白的电化学传感器。具体地,Aβ1-40/1-42单体与电极表面固定化的凝溶胶蛋白结合后,再附着辣根过氧化物酶(HPR)标记的Au NPs,在H2O2存在时通过催化3,3,5,5′ 四甲基联苯胺(TMB)放大电化学信号,以产生可测量的信号。该传感器对Aβ1-40/1-42具有较高的灵敏度,其线性检测范围为0.1~50 nmol/L,检出限为28 pmol/L,具有检测正常大鼠和感染阿尔茨海默症大鼠脑内Aβ1-40/1-42水平的能力。
3 Aβ低聚物的检测
3.1 适配体识别元件 适配体是一种短的单链DNA或RNA分子,可利用指数富集的配体系统进化技术在体外筛选获得[35,36]。与抗体相比,适配体具有功能修饰简单的特点,在选择性结合各种目标分子时更为高效[36]。适配体还具有合成容易、稳定性好和成本低等优点,在阿尔茨海默症的早期诊断中是替代昂贵抗体的新一代生物识别元件。Tsukakoshi等[37]首次报道了一种能选择性结合Aβ低聚物,但不能识别Aβ单体或纤维的DNA适配体。该DNA适配体可通过辅以竞争性筛选方法的凝胶阻滞实验方法分离得到。随后,Zhou等[38]利用该适配体和可特异性识别Aβ低聚物的抗体作为识别元件、Th修饰的Au NPs作为检测元件,以电化学检测Aβ低聚物。由于适配体和抗体皆对Aβ低聚物具有高特异性识别能力,而且将Th加载到Au NPs表面放大了电化学信号,该电化学传感器对Aβ低聚物具有极高的灵敏度,其检出限为100 pmol/L。该传感器可用于检测人造脑脊液中的Aβ低聚物浓度。最近,Zhang等[39]利用ssDNA适配体作为識别元件,构建了一种用于Aβ低聚物检测的无标记电化学传感器,其原理是使用电化学阻抗谱监测氧化还原电对[Fe(CN)6]3/4的电荷转移电阻的变化。如图4所示,ssDNA适配体可通过识别AuS键结合在金电极表面形成自组装单分子层,以特异性结合Aβ低聚物。由于ssDNA核酸适配体识别元件的高灵敏性,该电化学传感器具有较宽的线性检测范围(0.1~500 nm),检出限为0.03 nmol/L。另外,该适配体传感器还能监测Aβ蛋白的聚集和检测人造脑脊液中Aβ低聚物的浓度。
3.2 姜黄素识别元件
姜黄素是一种从姜黄植物中提取的天然多酚。由于其具有抗糖尿病、抗癌、和抗淀粉样蛋白活性等多种生物活性,姜黄素是糖尿病、癌症和神经退行性疾病(尤其是阿尔茨海默病)等多种疾病的候选药物[40,41]。最近的研究还表明,姜黄素的疏水基团可与Aβ低聚物的非极性区域通过疏水作用产生强烈的相互作用[41,42]。因此,姜黄素可作为电化学传感器的生物识别元件,选择性地检测Aβ低聚物。近年来,Qin等[43]利用姜黄素作为生物识别元件,设计了一种检测Aβ低聚物的电化学传感器。如图5所示,姜黄素 镍聚合物通过电化学聚合作用沉积在泡沫镍基体上。姜黄素中存在镍,有助于增加电导率和粘附泡沫镍基体的能力。泡沫镍基体是一种多孔结构,可促进电子传输并提高电化学性能。该电化学传感器具有极高的灵敏度,对Aβ低聚体浓度线性检测范围为0.001~5 nmol/L。此外,该传感器能检测人造脑脊液中的Aβ低聚体浓度,在阿尔茨海默病早期诊断中具有应用潜力。
3.3 肽识别元件
近年来,蛋白质结合肽由于其氨基酸的化学多样性而具有广泛的靶标范围,是一种颇有前景的适配体替代物[44,45]。2012年,Li等[46]报道了具有特定氨基酸序列(RGTWEGKWK)的寡肽可用作Aβ 1-42低聚物的识别元件。通过氨基酸侧链间的疏水相互作用,该寡肽可通过脊 槽匹配的方式捕获Aβ低聚物[47]。此外,修饰有Fc的寡肽可修饰在电极表面,以构建检测Aβ低聚物的电化学传感器[46]。该传感器的检测范围为480 pmol/L~12 nmol/L。Li等[48]还将该具有Aβ低聚物结合能力的寡肽与一种信号读出技术结合,构建出另一种检测Aβ低聚物的电化学传感器。该传感器可通过寡肽和电化学识别元件间的非共价耦合,以获得可靠并有效的电化学信号。这种基于肽识别元件的电化学传感器具有较低的检出限,约为0.048 nmol/L。
3.4 细胞朊蛋白识别元件
细胞朊蛋白(PrPC)是一种存在于中枢神经系统的膜结合糖蛋白,因其可特异性识别Aβ低聚物,引起了广泛关注[49,50]。与Aβ低聚物相互作用的PrPC核心区域是带有THSQWNKPSKPKTNMK氨基酸序列的PrP(95-110),位于非结构化的N 末端区域。PrPC与Aβ低聚物间相互作用的离解常数能通过细胞结合实验、表面等离子体共振检测、解离增强镧系元素荧光免疫检测等多种技术分析。一些研究表明,PrP(95-110)对Aβ低聚物具有极高的特异识别能力,而且无法结合Aβ单体和Aβ纤维[51]。因此,PrP(95-110)可作为一种颇有前景的、选择性检测Aβ低聚物的生物识别元件。 Rushworth等[52]报道了基于PrP(95-110)识别元件可特异性检测Aβ低聚物的电化学传感器, 利用含有PrP(95-110)片段的合成肽作为识别元件,设计了一种无标记的电化学传感器以检测Aβ低聚物。生物素化的PrP(95-110)识别元件通过强生物素和NeutrAvidin相互作用,生物素化的PrP(95-110)受体通过生物素和中和亲和素的强烈相互作用层层自组装在建在聚合物涂覆的丝网印刷金电极的表面。利用循环伏安法、电化学阻抗谱法和扫描电子显微镜证实该组装过程的完成。该传感器在Aβ低聚物或Aβ单体存在时通过电化学阻抗谱进行测试。由于其使用的识别元件,PrP(95-110)具有特异性识别Aβ低聚物的特点,该电化学传感器能在Aβ浓度为100 pmol/L时区分Aβ单体和Aβ低聚物。而且,该传感器对Aβ低聚物具有较高的灵敏度,其检出限约为0.5 pmol/L。该传感器还能检测复杂基质中呈现的天然细胞衍生的Aβ低聚物,展现出其在阿尔茨海默症早期诊断中的巨大潜力。Liu等[53]使用另一种含有PrP(95-110)片段的合成肽,构建了用于检测Aβ低聚物的灵敏且具有选择性的电化学传感器。将连有PrP(95-110)片段的半胱氨酸修饰在金电极表面,用于特异性捕获Aβ低聚物。捕获的Aβ低聚物可进一步由碱性磷酸酶偶联的PrP(95-110)特异性识别。此外,为了提高Aβ低聚体特异性传感器的灵敏度,在检测时使用“从外层到内层”电化学 化学 化学(ECC)氧化还原循环反应放大电化学信号,传感器能达到较低的检出限(3 pmol/L)。该传感器还可用于分析生物基质(如血清)中的Aβ低聚物浓度。
此外,利用Aβ低聚物抑制PrP(95-110)诱导的金属纳米颗粒聚集,可用于Aβ低聚物的电化学检测。如Xia等[54]以金刚烷(Adamantine, ADA)标记的PrP(95-110)作为识别元件,银纳米颗粒(Ag NPs)作为氧化还原元件,设计了另一种灵敏的、可选择性检测Aβ低聚物的电化学方法。ADA PrP(95-110)诱导Ag NPs聚集形成ADA PrP(95-110) Ag NPs网络结构。然后将该网络结构通过ADA和β 环糊精(β CD)间的主客体相互作用固定在β 环糊精(β CD)修饰的电极表面。ADA PrP(95-110) Ag NP通过银纳米颗粒的固态Ag/AgCl反应放大电化学信号。当存在Aβ低聚物时,ADA PrP(95-110) Au NPs网络结构中的PrP(95-110)将与Aβ低聚物作用,失去与Ag NPs结合的能力,从而在电极表面有Ag NPs网络形成(图6)。伴随着Aβ低聚物浓度从20 pmol/L升高至100 nmol/L,该传感器呈现出减弱的电化学信号,其检出限为8 pmol/L。随后,Xing等[55]也利用Aβ低聚物抑制PrP(95-110)诱导的Ag NP聚集现象构建了另一種可特异性检测Aβ低聚物的电化学传感器。将PrP(95-110)固定在电极表面以诱导溶液中的Ag NPs在电极表面的原位聚集,从而放大电化学信号。当Aβ低聚物存在时,PrP(95-110)可与Aβ低聚体相互作用,并将电极表面结合的Ag NPs重新释放到溶液中,产生相对较弱的电化学信号。该传感器的具有较低的检出限(6 pmol/L),并能分析复杂生物基质(包括血清和人造脑脊液)中的Aβ低聚物浓度。此外,Xia等[56]还发现PrP(95-110)能引起Au NPs的聚集,而Aβ低聚物可通过与PrP(95-110)结合阻止Au NPs的聚集。在上述电化学传感器中将Ag NPs替换成Au NPs,可设计出类似的检测Aβ低聚物的电化学方法。
值得注意的是,这些基于PrP(95-110)识别元件的可检测Aβ低聚物的电化学传感器需要标记肽底物和氧化还原介体,以获得放大的电化学信号,这可能导致有限的检测范围和复杂的制备过程。最近,Qin等[57]研发了一种无需标记物和氧化还原介体的、基于PrP(95-110)的新型电化学传感器。他们首次使用了导电的聚合物聚乙二醇(吡咯 2 羧酸)(Poly (pyrrole 2 carboxylic acid),PPyCOOH),用于PrP(95-110)识别元件的连接。该传感器具有极较高的灵敏度,其检出限为104pmol/L,在阿尔茨海默症的早期诊断中具有较好的应用前景。
3.5 塑性抗體识别元件
塑性抗体具有模拟生物识别的能力,由于其具有合成简单、成本低廉等优点,是新一代的抗体及适配体替代物。
最近,Moreira等[58]采用改进的蛋白质印迹方法合成出可特异性识别Aβ低聚物的塑性抗体。如图7所示,在Aβ低聚物存在时电聚合α 环糊精(α Cd)形成α Cd聚合物膜,通过酸处理除去包埋在α Cd聚合物膜中的Aβ低聚物,从而得到可特异性结
合Aβ低聚物的塑性抗体。采用方波伏安法和电化学阻抗谱法测定该塑性抗体、α Cd聚合物膜与Aβ低聚物再结合的能力。该聚合物膜展现出良好的分析性能,在方波伏安法测试中的检出限为0.20 ng/mL,在电化学阻抗谱法测试中的检出限为0.25 ng/mL。他们尝试将塑性抗体组装在电活性膜表面,构建了无需氧化还原元件的检测Aβ低聚物的新型电化学传感器[59]。所用塑性抗体可通过在Aβ低聚物存在时电聚合苯胺得到。而包埋在苯胺聚合物膜Aβ低聚物随后通过酸处理除去,从而在聚合物膜中产生空位。该空位在电化学检测时可重新结合Aβ低聚物,即实现对Aβ低聚物的特异性识别。该传感器由于缺少氧化还原元件,在方波伏安法测试中性能更优,其检出限低至(0.40±0.03) pg/mL。
4 Aβ纤维的检测(抗体识别元件)
用于构建检测Aβ纤维的电化学传感器的生物识别元件主要是抗体。常见的用于特异性识别Aβ纤维的抗体是一种通过对家兔使用Aβ1-42纤维免疫处理后获得的免疫血清(OC)[60]。抗体OC可与Aβ纤维特异性结合,但不能识别Aβ单体或可溶性Aβ低聚物,因此可作为电化学传感器中的生物识别元件,以特异性检测Aβ纤维。如Veloso等[61]利用抗体OC和A11作为生物识别元件构建了一种电化学免疫传感器,以监测Aβ纤维和其低聚物的分布情况。该免疫传感器能通过动态分析Aβ低聚物和其纤维的分布变化,快速地综合评估均三嗪源性聚集分子(TAE 1、TAE 2)对Aβ聚集的影响。近期,Jeong等[62]研发了一种电化学多路免疫传感器,该传感器基于还原氧化石墨烯(rGO),能在同一Aβ流体样本中分别检测Aβ1-40单体、Aβ低聚物和Aβ纤维。该传感器使用3种不同的抗体(6E10、A11和OC)作为生物识别元件,固定在修饰有官能团的rGO表面,分别用于3种构象的Aβ1-40特异性识别。该传感器对每种Aβ1-40构象均展现出较高的分析灵敏度,其具有较宽的动态检测范围(1 pg/mL~10 ng/mL)。最近出现了基于双抗体(A11和OC)的双通道电化学免疫传感器,能同时检测Aβ低聚物和Aβ纤维(图8)[63]。该传感器可通过定量分析Aβ低聚物和Aβ纤维的浓度比例,追踪感染阿尔茨海默症的大鼠脑脊液和脑组织中Aβ的聚集过程,在阿尔茨海默病早期诊断中具有良好的应用前景。
5 总结和展望
许多电化学传感器严重依赖特定的抗体 抗原相互作用,尤其是用于检测Aβ单体和Aβ纤维的传感器。然而,由于抗体的生产复杂且昂贵,通常导致利用抗体作为生物识别元件的电化学方法需要较高的成本。因此,具有特异性靶向作用的新的生物识别元件赋予了电化学传感器新的发展空间。近期,对于检测Aβ单体,抗体和凝溶胶蛋白是电化学传感器常用的生物识别元件; 对于电化学检测Aβ低聚物,目前已发现适配体、姜黄素、肽、PrP(95-110)和塑性抗体等多种生物分子对其均具有特异性结合能力,可替代昂贵的抗体; 对于检测Aβ纤维,现今可用的生物识别元件较少,这方面的研究有望成为将来的研究热点。总体而言,基于生物受体的Aβ电化学传感器的研究仍处于初步阶段,亟需新的识别原理、新的识别元件的设计和高分析性能检测方法上的突破。另一方面,目前很少有研究关注通过使用电化学方法分析单个液体样品中的3种Aβ构象,以监测动态Aβ聚集过程。而监测人脑中的Aβ聚集过程对于与阿尔茨海默病相关的发病机理的实时评估具有重要意义。未来的研究应致力于设计基于多个生物受体的新型电化学传感器,以便在单个分析系统中同时检测不同Aβ构象。
References
1 Rauk A. Chem. Soc. Rev., 2009, 38: 2698-2715
2 Mount C, Downton C. Nat. Med., 2006, 12: 780-784
3 Claeysen S, Bockaert J, Giannoni P. ACS Chem. Neurosci., 2015, 6: 940-943
4 Brookmeyer R, Johnson E, Ziegler Graham K, Arrighi H M. Alzheimers Dement., 2007, 3: 186-191
5 Selkoe D J. Science, 2012, 337: 1488-1492
6 Forlenza O V, Diniz B S, Gattaz W F. BMC. Med., 2010, 8: 89
7 Shui B Q, Tao D, Florea A, Cheng J, Zhao Q, Gu Y Y, Li W, Jaffrezic Renault N, Mei Y, Guo Z Z. Biochimie, 2018, 147: 13-24
8 Ling Y, Morgan K, Kalsheker N. Int. J. Biochem. Cell. Biol., 2003, 35: 1505-1535
9 Findeis M A. Pharmacol. Therapeut. 2007, 116: 266-286
10 Spies D S P E, Sjgren J M C, Kremer B P H, Verhey F R J, Olde Rikkert M G M, Verbeek M M. Curr. Alzheimer Res., 2010, 7: 470-476
11 Meyer Luehmann M, Spires Jones T L, Prada C, Garcia Alloza M, de Calignon A, Rozkalne A, Koenigsknecht Talboo J, Holtzman D M, Bacskai B.J, Hyman B T. Nature, 2008, 451: 720-724
12 Simard A R, Soulet D, Gowing G, Julien J P, Rivest S. Neuron, 2006, 49: 489-502
13 Brown G C, Neher J J. Mol. Neurobiol., 2010, 41: 242-247
14 Gong Y, Chang L, Viola K L, Lacor P N, Lambert M P, Finch C E, Krafft G A, Klein W L. Proc. Natl. Acad. Sci. USA, 2003, 100: 10417-10422
15 Sakono M, Zako T. FEBS J., 2010, 277: 1348-1358
16 Song L, Lachno D R, Hanlon D, Shepro A, Jeromin A, Gemani D, Talbot J A, Racke M M, Dage J L, Dean R A. Alzheimers Res. Ther., 2016, 8: 58
17 Bruggink K A, Jongbloed W, Biemans E A, Veerhuis R, Claassen J A, Kuiperij H B, Verbeek M M. Anal. Biochem., 2013, 433:112-120
18 Yang T, Hong S, O'Malley T, Sperling R A, Walsh D M, Selkoe D J. Alzheimers Dement., 2013, 9: 99-112
19 Kang D Y, Lee J H, Oh B K, Choi J W. Biosen. Bioelectron., 2009, 24: 1431-1436
20 Higuchi M, Iwata N, Matsuba Y, Sato K, Sasamoto K, Saido T C. Nat. Neurosci., 2005, 8: 527-533
21 Lee D, Kim S M, Kim H Y, Kim Y. ACS Chem. Neurosci., 2019, 10: 2647-2657
22 Deng C Y, Zhang M M, Liu C Y, Deng H H, Huang Y, Yang M H, Xiang J, Ren B. Anal. Chem., 2018, 90: 11446-11452
23 Yin Z Z, Wang S H, Shen B C, Deng C Y, Tu Q Y, Jin Y, Shen L, Jiao B, Xiang J. Anal. Chem., 2019, 91: 3539-3545
24 Zhang M, Zhai Q Y, Wan L P, Chen L, Peng Y, Deng C Y, Xiang J, Yan J W. Anal. Chem., 2018, 90: 7422-7427
25 Carneiro P, Loureiro J, Delerue Matos C, Morais S, do Carmo Pereira M. Sens. Actuators B, 2017, 239: 157-165
26 Yoo Y K, Kim J, Kim G, Kim Y S, Kim H Y, Lee S, Cho W W, Kim S, Lee S M, Lee B C, Lee J H, Hwang K S. Sci. Rep., 2017, 7: 8882
27 Zakaria N, Ramli M Z, Ramasamy K, Meng L S, Yean C Y, Singh B K K, Zain Z M, Low K F. Anal. Biochem., 2018, 555: 12-21
28 Han J, Zhang M F, Chen G J, Zhang Y Q, Wei Q, Zhuo Y, Xie G, Yuan R, Chen S P. J. Mater. Chem. B, 2017, 5: 8330-8336
29 Gao Z Q, Li Y Y, Zhang C Y, Zhang S, Jia Y L, Li F Y, Ding H, Li X J, Chen Z W, Wei Q. ACS Appl. Mater. Interfaces, 2019, 11: 12335-12341
30 Diba F S, Kim S, Lee H J. Catal. Today, 2017, 295: 41-47
31 Chae M S, Kim J, Jeong D, Kim Y, Roh J H, Lee S M, Heo Y, Kang J Y, Lee J H, Yoon D S, Kim T G, Chang S T, Hwang K S. Biosens. Bioelectron., 2017, 92: 610-617
32 Chauhan I R V P S, Chauhan A, Wisniewski H M. Biochem. Biophys. Res. Commun., 1999, 258: 241-246
33 Yu Y Y, Zhang L, Li C L, Sun X Y, Tang D Q, Shi G Y. Angew. Chem. Int. Ed., 2014, 53: 12832-12835
34 Yu Y Y, Sun X Y, Tang D Q, Li C L, Zhang L, Nie D X, Yin X X, Shi G Y. Biosens. Bioelectron., 2015, 68: 115-121
35 Tuerk C, Gold L. Science, 1990, 249: 505-510
36 Liu Y N, Liu N, Ma X H, Li X L, Ma J, Li Y, Zhou Z J, Gao Z X. Analyst, 2015, 140: 2762-2770
37 Tsukakoshi K, Abe K, Sode K, Ikebukuro K. Anal. Chem., 2012, 84(13): 5542-5547
38 Zhou Y L, Zhang H Q, Liu L T, Li C M, Chang Z, Zhu X, Ye B X, Xu M T. Sci. Rep., 2016, 6: 35186
39 Zhang Y T, Figueroa Miranda G, Lyu Z Y, Zafiu C, Willbold D, Offenhusser A, Mayer D. Sens. Actuators B, 2019, 288: 535-542
40 Esatbeyoglu T, Huebbe P, Ernst I M A, Chin D, Wagner A E, Rimbach G. Angew. Chem. Int. Edit., 2012, 51: 5308-5332
41 Nagahama K, Utsumi T, Kumano T, Maekawa S, Oyama N, Kawakami J. Sci. Rep., 2016, 6: 30962
42 Kumaraswamy P, Sethuraman S, Krishnan U M. J. Agric. Food Chem., 2013, 61: 3278-3285
43 Qin J, Park J S, Jo D G, Cho M, Lee Y. Sens. Actuators B, 2018, 273: 1593-1599
44 Schlippe Y V G, Hartman M C T, Josephson K, Szostak J W. J. Am. Chem. Soc., 2012, 134: 10469-10477
45 Katz C, Levy Beladev L, Rotem Bamberger S, Rito T, Rüdiger S G D, Friedler A. Chem. Soc. Rev., 2011, 40: 2131-2145
46 Li H, Cao Y, Wu X L, Ye Z H, Li G X. Talanta, 2012, 93: 358-363
47 Sato T, Kienlen Campard P, Ahmed M, Liu W, Li H, Elliott J I, Aimoto S, Constantinescu S N, Octave J N, Smith S O. Biochemistry, 2006, 45: 5503-5516
48 Li H, Xie H N, Cao Y, Ding X R, Yin Y M, Li G X. Anal. Chem., 2012, 85: 1047-1052
49 Laurén J, Gimbel D A, Nygaard H B, Gilbert J W, Strittmatter S M. Nature, 2009, 457: 1128-1132
50 Balducci C, Beeg M, Stravalaci M, Bastone A, Sclip A, Biasini E, Tapella L, Colombo L, Manzoni C, Borsello T, Chiesa R, Gobbi M, Salmona M, Forloni G. Proc. Natl. Acad. Sci. USA, 2010, 107: 2295-2300
51 Guillot Sestier M V, Sunyach C, Ferreira S T, Marzolo M P, Bauer C, Thevenet A, Checler F. J. Biol. Chem., 2012, 287: 5021-5032
52 Rushworth J V, Ahmed A, Griffiths H H, Pollock N M, Hooper N M, Millner P A. Biosens. Bioelectron., 2014, 56: 83-90
53 Liu L, Xia N, Jiang M S, Huang N B, Guo S, Li S J, Zhang S L. J. Electroanal. Chem., 2015, 754: 40-45
54 Xia N, Wang X, Zhou B B, Wu Y Y, Mao W H, Liu L. ACS Appl. Mater. Interfaces, 2016, 8: 19303-19311
55 Xing Y, Feng X Z, Zhang L, Hou J, Han G C, Chen Z. Int. J. Nanomed., 2017, 12: 3171-3179
56 Xia N, Wang X, Yu J, Wu Y Y, Cheng S C, Xing Y, Liu L. Sens. Actuators B, 2017, 239: 834-840
57 Qin J L, Jo D G, Cho M, Lee Y. Biosens. Bioelectron., 2018, 113: 82-87
58 Moreira F T C, Sales M G F. Sens. Actuators B, 2017, 240: 229-238
59 Moreira F T C, Rodriguez B A G, Dutra R A F, Sales M G F. Sens. Actuators B, 2018, 264: 1-9
60 Kayed R, Head E, Sarsoza F, Saing T, Cotman C W, Necula M, Margol L, Wu J, Breydo L, Thompson J L, Rasool S, Gurlo T, Butler P, Glabe C G. Mol. Neurodegener., 2007, 2: 18-29
61 Veloso A J, Chow A M, Ganesh H V S, Li N, Dhar D, Wu D C H, Mikhaylichenko S, Brown I R, Kerman K. Anal. Chem., 2014, 86: 4901-4909
62 Jeong D, Kim J, Chae M S, Lee W, Yang S H, Kim Y, Kim S M, Lee J S, Lee J H, Choi J, Yoon D S, Hwang K S. Sensors, 2018, 18: 1738-1751
63 Yu Y Y, Yin T X, Peng Q W, Kong L N, Li C L, Tang D Q, Yin X X. ACS Sens., 2019, 4: 471-478
Electrochemical Sensors Based on Bioreceptors for Detecting
Different Conformations of Amyloid β Peptides
WANG Jian Xing2, TIAN Meng1, SHU Tong2, SU Lei*2, LIU Guo Dong1, ZHANG Xue Ji*3
1(Research Center for Biomedical and Health Science, Anhui Science and Technology University, Fengyang 233100, China)
2(Beijing Advanced Innovation Center of Materials Genome Engineering, Beijing Key Lab for Bioengineering
and Sensing Technology, School of Chemistry and Biological Engineering,
Beijing Science and Technology University, Beijing 100083, China)
3(School of Biomedical Enginering, Shenzhen University, Shenzhen 518055, China)
Abstract Alzheimer's disease (AD) has attracted extensive attention because it is a fatal and irreversible progressive neurological disorder and its incidence exponentially increases with age. The early diagnosis of AD has become an urgent prerequisite for its treatment. At present, one of the most important biomarkers for the early diagnosis of AD is amyloid β peptides (Aβ). Owing to the advantages of electrochemical detection, lots of electrochemical biosensors have been developed for detection of Aβ. In the present review, from the standpoint of Aβ bioreceptors, we summarize the progresses in the electrochemical sensors for detection of Aβ monomers, Aβ oligomers and Aβ fibrils, respectively in the recent five years.
Keywords Alzheimer's disease; Early diagnosis; Amyloid β peptides; Electrochemical biosensors; Review
