单一神经囊泡的电分析化学研究
2019-11-12齐擦毛吉沙正悦李鲜婵
齐擦毛吉 沙正悦 李鲜婵

摘 要 近年来,神经活动过程中化学递质的储存、释放和作用规律成为研究热点。神经囊泡作为执行化学递质储存和释放的主要亚细胞器,一直备受关注。与常见的囊泡分析技术相比,电分析化学方法由于具有较高的时间分辨率和灵敏度,特别是微纳米电极的使用,使电分析化学在单一神经囊泡的分析方面显示出独特的优势。近年来,单囊泡电化学计数法和阻抗脉冲法在单囊泡分析方面的研究进展迅速。单囊泡电化学计数法基于电场作用下囊泡膜在电极表面破裂,可实现单一囊泡内储存神经递质的定量分析。阻抗脉冲法可通过测定囊泡通过微纳米孔时引起的离子电流信号的变化,研究囊泡的尺寸、表面电荷、浓度及柔韧性等参数或特性。本文以单一神经囊泡分析为切入点,介绍了近年来单囊泡电化学计数法与阻抗脉冲法在单一囊泡分析领域的重要进展,展望了这两种方法在神经化学和生物医学等领域的应用前景。
关键词 脑科学; 神经囊泡; 电分析化学; 单囊泡原位电化学计数法; 阻抗脉冲法; 评述
1 引 言
近年来, 脑科学的研究得到了越来越广泛的关注。利用化学、物理和数学等现代技术和方法,研究神经活动中化学物质的释放和作用规律,已成为在分子水平上研究脑及整个神经系统结构及其功能物质基础的重要领域。
神经元细胞间的信号传递是高等生物(包括人类)发挥其高等认知功能的基础,如感知、识别和记忆等。在神经系统中,胞吐是神经元间化学信息传递的关键过程。囊泡在突触前神经元内装载神经递质,如多巴胺、肾上腺素、去甲肾上腺素、血清素、神经肽等,随后通过多步复杂的生理学过程,包括锚定、成熟、膜融合、释放等,将装载的神经递质释放到突触间隙,完成细胞胞吐过程; 被释放的神经递质在突触间隙中被突触后神经元膜受体识别并摄入,从而完成了神经元间化学信息的传递。由此可见,囊泡是执行胞吐的主要亚细胞器,在神经信号转导方面发挥着至关重要的作用[1,2]。
神经囊泡的物理化学性质,如形态、大小、表面电荷及储存和释放神经递质等,与其生理功能密切相关。研究者通过引入光学标记分子,采用光谱成像的方法对胞吐过程进行研究,这些光学方法在研究胞吐过程中突触前膜与囊泡膜相互作用、特异蛋白的参与等方面发挥了重要作用[3~5]。但上述方法也存在一些不足,如时间分辨率低(亚秒级至毫秒级)、标记率低、荧光分子易淬灭、定量困难等。1991年, Wightman等建立的单细胞电流法,实现了胞吐过程中单囊泡释放神经递质的定量、动态、快速分析[6,7]。随后的20多年来,研究者用此方法研究了药物、环境因素等对囊泡释放神经递质的影响[8~14]。
近年来,单囊泡电化学计数法的建立和发展,使得单囊泡储存神经递质的定量检测成为可能; 同时,阻抗脉冲法在单囊泡分析方面的初步进展,也促进了其在单囊泡研究领域的应用。本文综述了近年来这两种电分析方法在单囊泡分析中的主要研究进展及发展前景。
2 单囊泡原位电化学计数法
2013年,J.E. Rothman, R.W. Schekman 和 T.C. Südhof教授由于研究细胞胞吐主要过程的杰出贡献而被授予了诺贝尔生理医学奖,但是关于胞吐的最后一步,即囊泡中的所有递质在最后一刻是否全部被释放到突触间隙,仍存在很大的争议。为了回答此问题,需要比较囊泡内储存神经递质的量以及胞吐过程中囊泡释放神经递质的量两个参数。单细胞电流法的长足发展及应用使得胞吐过程中单囊泡释放神经递质的定量分析技术已很成熟。在以往的研究中,研究者通常直接用测得的囊泡释放神经递质的量作为其储存神经递质的量进行分析,也就是说一般认为胞吐过程中神经递质会被全部释放到突触间隙(全释放模式)。而越来越多的文献报道,不同条件下,如不同生理条件[15~19]、刺激物种类和刺激的间隔不同[20~22], 胞吐释放神经递质的量是不同的,这也表明胞吐并不是“全有或全无”的过程。因此,发展单囊泡储存神经递质的直接定量分析方法对于研究胞吐过程中神经递质的释放行为至关重要。
近十年来,瑞典哥德堡大学的Ewing等组在单囊泡内包被神经递质的定量分析研究方面做出了一系列原创性的工作[23~34],先后发展了毛细管电泳电化学计数法、单囊泡电化学计数法和单囊泡原位电化学计数法,用于单囊泡的电化学分析。
2.1 毛细管电泳 电化学计数法
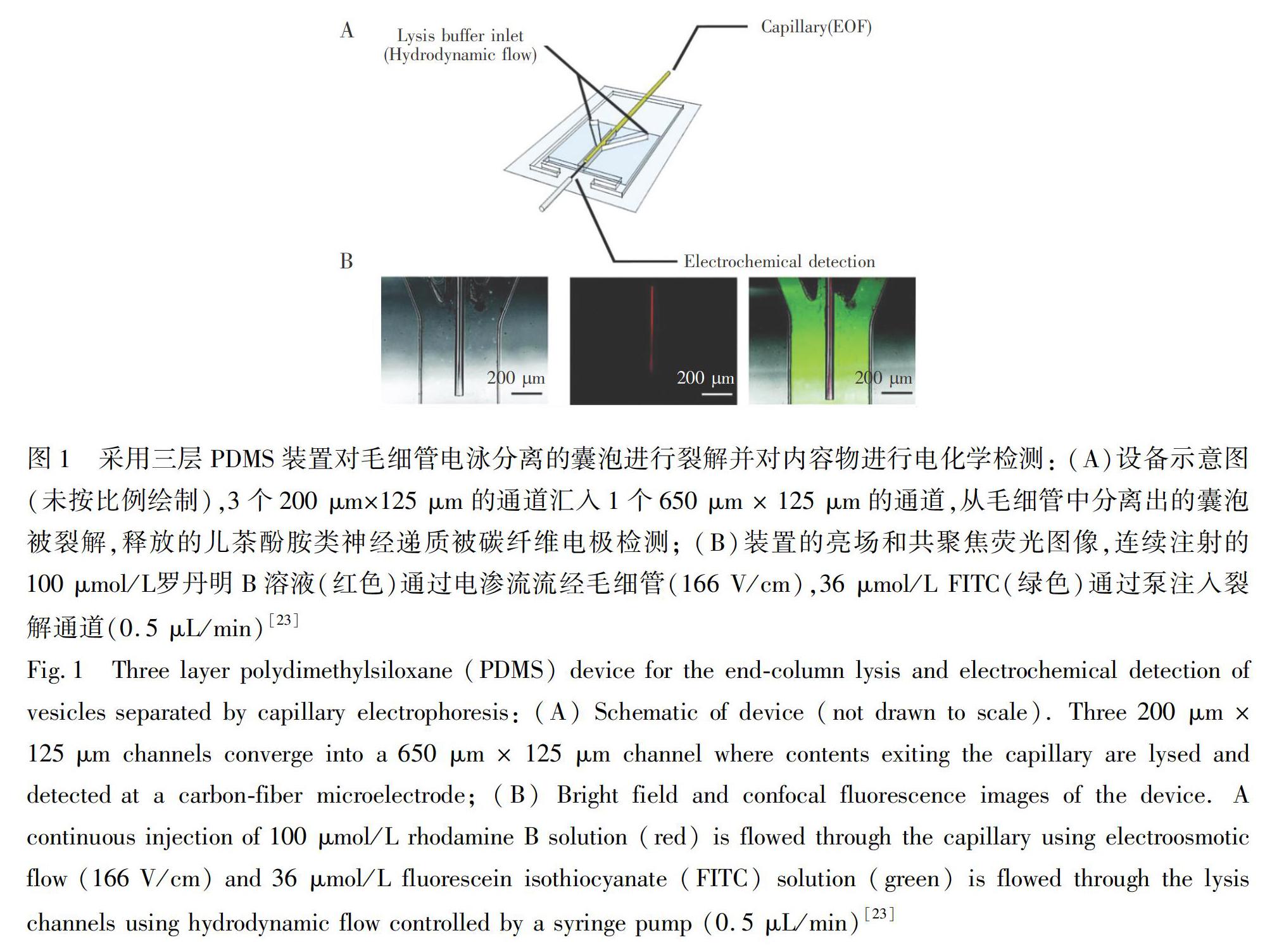
2008年,Omiatek等[23]结合毛细管电泳(CE)、微流控芯片和电化学检测技术,搭建了首套单囊泡包被神经递质的定量分析装置(图1),将CE分离囊泡、表面活性剂破囊泡膜及微电极检测包被于囊泡内的神经递质三个步骤有效地整合在一起。此系统的关键在于将CE的毛细管出口固定在PDMS制备的微流控芯片上。此外,在出口处引入高浓度的十二烷基磺酸钠的囊泡膜裂解液,并巧妙放置柱状碳纤维微电极,使得在毛细管内通过电场分离出的单个囊泡,被裂解液破膜,随后神经递质被电极完全检测,从而通过多步过程实现了单一囊泡储存神经递质的定量测定。采用此方法成功地實现了大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)和鼠脑组织中分离出的神经囊泡内包被神经递质的定量分析[24,25]。然而,此装置复杂、难于操控,很难推广。
2.2 单囊泡电化学计数法
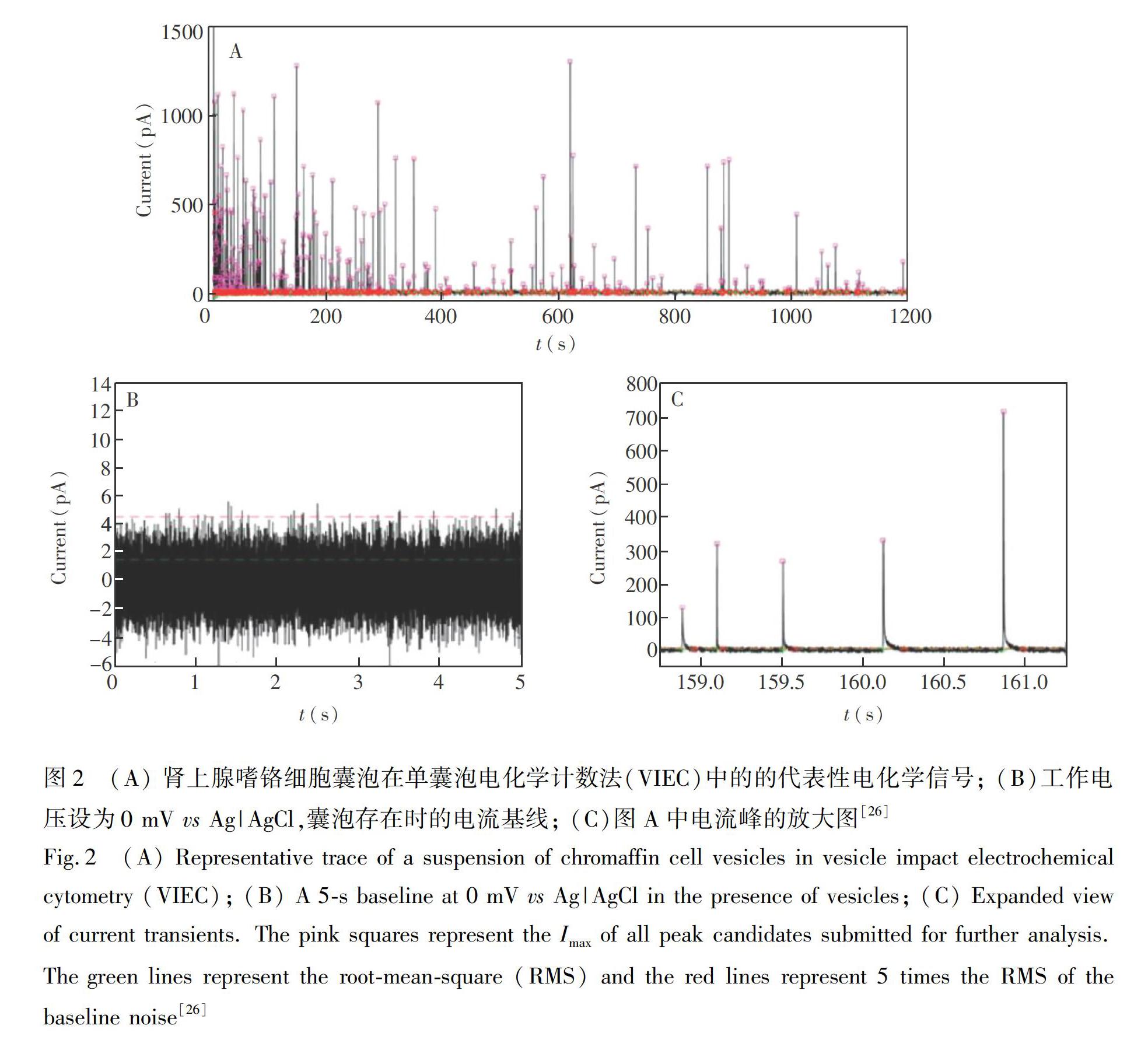
2015年,Dunevall等[26]发展了一种更简单、可靠的分析方法,即单囊泡电化学计数法(Vesicle impact electrochemical cytometry, VIEC),不需要预先进行电泳分离即可裂解电极表面的单个囊泡,实现单囊泡内包被神经递质的定量分析。在此方法中,从肾上腺髓质中分离出的肾上腺嗜铬囊泡在直径33 μm的盘状碳电极上发生反应,囊泡内包被的儿茶酚胺类神经递质被电极电化学氧化,从而实现检测(图2), 图2中每个电化学电流峰对应于1个囊泡在电极上破裂。采用法拉第方程(N=Q/nF)可计算出单个囊泡内储存神经递质的量。与胞吐过程中肾上腺嗜铬细胞释放神经递质的量进行统计学比较发现,囊泡中包裹儿茶酚胺类神经递质的量远比胞吐释放的量多。研究者还进行了石英晶体微天平实验,为囊泡的吸附和破裂提供了证据。
此后,研究者陆续开发了一系列的单囊泡电化学计数法[27~39]。美国德克萨斯州大学奥斯汀分校的Bard研究组[35]与英国牛津大学的Compton研究组发展了相似的方法,定量分析了人工磷脂囊泡内包被化学物质的量[36~38]。研究单囊泡电化学计数法中囊泡破裂、电化学检测的原理对于确认此方法是否能准确测定囊泡的全部内容物至关重要,同时对于囊泡膜生物物理学研究具有重要意义。
分析VIEC中电流峰发现,相当比例的电流峰起始部分存在与胞吐电流峰类似的前肩峰 (Pre spike foot),提示在VIEC过程中,囊泡在电极表面形成了一个短暂的纳米小孔[31]。数学模拟实验结果显示,不同形状、尺寸的电极上,纳米小孔发生的位置对电极上检测到释放神经递质的比例(收集效率)有不同程度的影响[33]。例如,对于直径33 μm的碳纤维盘电极,开孔发生在囊泡的任何位置上,收集效率均接近100%,这是因为纳米级囊泡相对于33 μm的碳纤维盘电极很小,无论囊泡膜哪个位置破裂形成小孔,释放的神经递质都会被电极捕获; 然而,在碳纤维锥电极(长度约4 μm, 底部直径约1.5 μm)上,开孔发生在电极近端收集效率达到100%,但是开孔发生在电极远端时收集效率约为75%。 Li等[33]的研究结果表明, 在两种电极上检测到的囊泡内容物基本吻合,这也就说明VIEC过程中开孔发生在电极表面。另外,Lovric等[29]的研究表明,VIEC中记录到的峰频率随电极上施加电位(500~900 mV,参比电极为Ag/AgCl)的增大而增高。 这两方面的结果提示, 在VIEC过程中,电穿孔可能是囊泡膜破裂的主要驱动力。
利用荧光基团修饰膜脂质,可以使囊泡膜在电极表面更容易发生电穿孔。进一步研究发现,荧光基团连接在脂质尾部比连在脂质头部,会促使囊泡更容易在电极表面破裂。这可能是因为荧光基团在激发光作用下,诱导产生活性氧,从而导致膜磷脂性质发生改变和/或形成水缺陷,使电穿孔更容易发生,而荧光基团处于膜磷脂双分子层内部时这种作用最强[30]。
此外,通过比较人工磷脂囊泡、人工肽修饰囊泡和哺乳动物囊泡在VIEC中的电流峰的动力学参数,研究者发现,随着膜内多肽或者膜蛋白比例的增大,囊泡在电极上破裂释放神经递质的速度减慢,其中,肾上腺嗜铬囊泡比人工磷脂囊泡的破裂速度慢10倍以上,表明膜蛋白的存在阻止了电穿孔的发生[29]。将实验温度从6℃提高到30℃后,囊泡在电极上破裂的可能性增大约1倍,这可能是因为温度升高使得囊泡膜内膜蛋白在磷脂双分子层中运动速率增大,因而使得膜磷脂与电极紧密结合的可能性增大,从而更容易诱发电穿孔的形成[31]。同时,研究发现,尺寸较大的囊泡在VIEC电极上破裂得更早、更频繁; 同样地,用多巴胺合成前体L DOPA处理细胞,从而改变囊泡的尺寸,也观察到了同样的趋势。这可能是因为囊泡与电极接触面积越大,囊泡膜磷脂与电极形成紧密结合的点位越多,更容易发生电穿孔[31,39]。
对VIEC原理进行小结,通过扫描电镜表征、尺寸分析、施加电位分析、理论模拟及数据分析等,推导出VIEC中囊泡在电极表面可能经历了吸附、膜蛋白迁移、电穿孔、神经递质释放和电化学定量检测5个主要步骤(图3)[31,33]。
2.3 单囊泡原位电化学计数法
为了在活细胞内直接检测神经囊泡内容物,Li等[27]通过有效地设计和利用纳米尖端碳纤维锥电极,进一步发展了单囊泡原位电化学计数法(Intracellular vesicle impact electrochemical cytometry, IVIEC),在活PC12细胞内,实现了囊泡内包被的神经递质多巴胺的定量检测。在此方法中,使用纳米尖端的碳纤维锥电极插入细胞膜,电极侧壁有足够的反应场所供囊泡在其表面发生一系列过程,释放出的神经递质在电极上发生电化学反应而实现了定量检测(图4)。此方法是目前可以在活细胞内对纳米级尺寸囊泡包被神经递质定量分析的唯一方法。通过与单细胞电流法检测的胞吐中囊泡释放神经递质的量比较,发现PC12细胞胞吐过程中,大部分囊泡未释放出其所包被的全部神经递质,平均释放比例为64%。此研究结果揭示了胞吐并不是“All or None”的量子过程,且部分释放模式是胞吐的主要方式。
单囊泡原位电化学计数法与单细胞电流法结合,有助于了解胞吐机制及影响该过程的不同因素[28,32,34,40],可以为神经信号转导的研究提供强有力的技术手段。目前,这两种方法的结合被越来越多地应用于研究活细胞的分子过程中[28,41,42],如用于研究Zn2+[32]、姜黄素、抗肿瘤药物顺铂[43, 44]、麻醉剂可卡因与中枢兴奋剂利他灵[45,46] 等对神经信号转导的调控或影响,并发现这些化学物质对胞吐中囊泡释放神经递质的比例有不同程度的影响,且这种影响可能与神经功能密切相关。这意味着胞吐中囊泡释放神经递质的比例和速度,可作為神经可塑性研究中一个新的作用靶点。相关内容不是本文评述的重点,这里将不再详述。
3 阻抗脉冲法
关于囊泡尺寸的测量,目前常用的方法有透射电镜(Transmission electron microscope,TEM)、动态光散射仪(Dynamic light scattering, DLS)和纳米示踪仪(Nanoparticle tracking analysis, NTA)三种技术。但是,这些方法在单一神经囊泡分析方面存在各种不足。如TEM需要对囊泡进行化学固定,可能会引起囊泡尺寸的变化。DLS和NTA可提供囊泡群的信息,但对单一囊泡的分析仍然很困难。Li等[47]基于纳米碰撞原理,发展了一种新的针对纳米尺寸人工磷脂囊泡的尺寸定量分析方法。在此方法中,他们利用纳米颗粒碰撞到超微电极时,有效电极面积的减少与纳米颗粒尺寸直接相关的原理,建立了大批量单人工磷脂囊泡的尺寸定量分析方法。以上4种方法虽各有优缺点,但均是对大批量囊泡的尺寸进行整体的定量分析,不能对单一囊泡进行可控性分析。
由于阻抗脉冲分析法具有简单、免标记、快速、低成本等优点,基于电阻脉冲原理的纳米孔或纳米通道传感器已成为基础研究和实际应用中对单一囊泡分析的潜在重要技术。多项基于阻抗脉冲法的研究使我们对单一囊泡的多方面性质有了深入的了解,如囊泡尺寸、表面电荷、变形现象及囊泡柔韧性等。
3.1 阻抗脉冲法的原理
阻抗脉冲法的基本原理为:通过在充满电解质的孔隙中施加电势,测量通过孔隙产生的离子电流来监测纳米颗粒的易位过程。以纳米囊泡为例,使用锥形玻璃纳米孔对囊泡进行原位检测。使用玻璃毛细管纳米孔内的Ag/AgCl电极作为工作电极,本体溶液中正对纳米孔外端的Ag/AgCl电极作为参考电极,对纳米孔施加偏压负电位,囊泡在电场作用下在孔隙中发生易位,取代了孔隙中的电解质溶液,降低了电解质通过孔隙的流量从而改变离子电流(图5)[48]。单个电流脉冲的振幅ΔI、易位时间Δt与单粒子的物理性质有关(如形态和表面电荷)。利用恒压下离子电流脉冲信号的周期性变化,可对单个囊泡在锥形玻璃纳米孔中的原位动态易位进行清晰的观察和计算。以电流作为时间的函数,可确定囊泡的浓度、电荷、形状和大小,以及与孔隙的化学和物理相互作用[49]。
3.2 基于阻抗脉冲法的囊泡性质研究进展
3.2.1 囊泡易位的温度依赖性 Holden等[49]基于阻抗脉冲法,采用单个锥形纳米孔实现了多层磷脂囊泡易位过程的直接测量,为了解磷脂囊泡随温度变化的特性提供了依据。他们主要研究了半径为190~450 nm的多层磷脂囊泡通过嵌入在玻璃膜中的单个锥形纳米孔的易位行为,发现通过调整纳米孔的尺寸和溶液温度,可实现不同尺寸多层磷脂囊泡的可控性通过。因人工磷脂囊泡通过纳米孔时阻抗增大,使得离子电流发生显著性降低,利用此原理可以逐一检测单一囊泡通过纳米孔的动态过程。多层磷脂囊泡在纳米孔中的易位具有温度依赖性,在高于其转变温度(41℃)时,脂质双分子层处于一种柔性的流体状态,能够变形和易位,而在转变温度以下,脂质双分子层相对来说是刚性的,能够堵塞孔隙。该研究结果表明,人工磷脂囊泡与传统的无机或有机硬纳米颗粒通过纳米孔的易位行为不同,利用阻抗脉冲法可定量研究囊泡易位的机理和动力学过程。
3.2.2 施加电压可改变囊泡易位分析的灵敏度 研究发现,人工磷脂囊泡在纳米孔中的易位过程受施加电位的驱动和控制[50]。研究者采用直径约250 nm的单锥孔纳米管,在单电位驱动下对直径为140 nm的人工磷脂囊泡进行了易位实验。当囊泡从本体溶液侧接近纳米管孔并进入锥形侧时,在靠近尖端的感应区占据了电解质溶液的有限位置,导致离子电流下降,记录的电流脉冲的高度、宽度和频率可反映粒子的大小及浓度。他们利用阻抗脉冲原理,建立了纳米磷脂囊泡电压驱动计数原理,系统地研究了外加电压对易位事件频率、易位速度和停留时间的影响(图6)。研究结果表明,静电场是磷脂囊泡通过纳米管孔易位过程的主要控制因素之一,施加电压对囊泡分析的灵敏度有显著影响,可作为一個重要的调节参数。研究结果为磷脂囊泡的易位和分析提供了新的视角,同时证明了纳米孔可作为一种操作简便的囊泡计数平台,有望用于可植入的活细胞囊泡分析方法。
3.2.3 囊泡易位过程中的电致形变现象 Darvish等[51]比较了聚乙烯纳米球和人工磷脂囊泡在相同条件下通过纳米孔电极的过程,发现人工磷脂囊泡通过纳米孔时引起的离子电流降显著低于硬聚乙烯纳米球。外加电位1 V时,直径75 nm聚乙烯纳米球通过纳米孔引起的电流降是同尺寸人工磷脂囊泡的3倍。此结果说明,人工磷脂囊泡通过纳米孔时与硬聚乙烯纳米球行为不同。
纳米级人工磷脂囊泡通过纳米孔时电流脉冲信号的电压依赖行为,说明磷脂囊泡在纳米孔内可能存在电致形变现象,即纳米磷脂囊泡通过纳米孔时,受到一个类似于直流脉冲的强电场,而这种强直流脉冲可使磷脂囊泡发生形变。为了更好地了解人工磷脂囊泡通过纳米孔的变形程度及变形的基本机理,研究者以直径100 nm的人工磷脂囊泡为模型分析物,通过改变囊泡膜磷脂组成制备了不同硬度的磷脂囊泡,研究了其通过纳米孔时的电致形变现象(图7)[51]。结果表明,柔韧性不同的人工磷脂囊泡通过纳米孔的电流脉冲特征有显著差异。通过对不同电压下电流脉冲高度进行归一化处理并进行比较,研究者发现磷脂囊泡通过纳米孔的变形现象是由孔内电场引起的。另外,研究者采用有限元模拟方法求解了人工磷脂囊泡在纳米孔内变形的有效长径比,量化了磷脂囊泡在纳米孔内的变形程度。
此项研究表明,固体纳米孔的阻抗脉冲传感技术可以很好地用于表征纳米磷脂囊泡的机械刚性。从中也可知道,纳米孔内磷脂囊泡的形状(近似椭球形)可能与溶液中磷脂囊泡的形状(球形)有很大的不同,这将影响阻抗脉冲传感技术用于神经囊泡的尺寸测量。这些发现有可能将纳米孔阻抗脉冲传感技术转变为一种新的分析工具,用于研究纳米尺度囊泡的生物物理性质,特别是了解软纳米颗粒的变形及柔韧性等特性。
3.2.4 纳米孔表面特性影响囊泡易位过程 Chen等[48]采用阻抗脉冲法研究了单层磷脂囊泡(SUVs,直径约50~60 nm)在锥形玻璃纳米孔(直径约14~72 nm)中易位的动力学过程。SUVs作为囊泡模型进,其易位行为可能不同于多层磷脂囊泡,且SUVs的结构更接近于神经囊泡。研究发现,SUVs的易位受纳米孔大小、溶液pH值、囊泡浓度和施加电压等影响。特别值得一提的是,作者研究了纳米孔内表面性质对囊泡易位过程的影响,发现使用缩水甘油醚氧基丙基三甲氧基硅烷(GPTMS)或聚 L 组氨酸(PLH)对玻璃纳米孔内表面改性后,囊泡易位发生显著变化(图8)。当纳米孔内表面不经修饰时,表面带负电荷,SUVs通过纳米孔时的电流 时间振荡曲线规则,表明单个完整的SUV依次地易位通过纳米孔(图8A)。在PLH修饰的玻璃纳米孔中,纳米孔内表面带正电荷,由于带负电的SUVs与带正电的纳米孔表面之间的静电相互作用,锥形玻璃纳米孔内表面可能会捕获并破坏SUVs的完整结构,从而导致纳米孔内易位的只是被洗脱的不规则的小囊泡或破碎的片段(而非完整的SUVs),这反映为电流 时间曲线中的“反向”小而快的电流振荡 (图8C)。然而,经GPTMS改性后,玻璃纳米孔的内表面呈中性,但界面略呈疏水性。因为SUVs表面的磷酸基团使其在pH 7.4的水溶液中呈亲水性,所以将单个SUV驱赶出GPTMS修饰的疏水纳米孔需要更长的时间,如图8B所示。此研究表明不同的带电表面会影响SUVs在玻璃纳米孔中的易位行为。该检测平台为利用SUVs 与纳米孔相互作用的不同来区分不同类型的SUVs 提供了可能。
4 總结与展望
单囊泡原位电化学计数法和阻抗脉冲分析法在单囊泡神经递质的定量检测、囊泡的尺寸及表面性质的研究等方面有了一些突破性的进展,在单一神经囊泡的电化学分析研究中表现出巨大的研究潜能,为在单囊泡水平研究神经信号转导提供了新的研究手段和发展契机。未来,将这些电化学分析方法与其它先进的分析手段有效结合,更好地发挥电化学分析方法高时空分辨的优点,实现单一囊泡的原位、动态、高通量分析是单囊泡分析领域重要的研究方向之一。这些研究将有助于理解神经囊泡在生理及病理过程中的重要功能,为研究脑科学及其它生物医学领域重要过程提供强有效的研究手段。
References
1 Huang H, Liu S, Kornberg T B. Science, 2019, 363(6430): 948-955
2 Awasthi A, Ramachandran B, Ahmed S, Benito E, Shinoda Y, Nitzan N, Heukamp A, Rannio S, Martens H, Barth J, Burk K, Wang Y T, Fischer A, Dean C. Science, 2019, 363(6422): eaav1483
3 Wilhelm B G,Mandad S, Truckenbrodt S, Kroehnert K, Schaefer C, Rammner B, Koo S J, Classen G A, Krauss M, Haucke V, Urlaub H, Rizzoli S O. Science, 2014, 344(6187): 1023-1028
4 Willig K I, Rizzoli S O, Westphal V, Jahn R, Hell S W. Nature, 2006, 440(7086): 935-939
5 Saviane C, Silver R A. Nature, 2006, 439(7079): 983-987
6 Kawagoe K T, Jankowski J A, Wightman R M. Anal. Chem., 1991, 63(15): 1589-1594
7 Wightman R M, Jankowski J A, Kennedy R T, Kawagoe K T, Schroeder T J,Leszczyszyn D J, Near J A, Diliberto E J, Viveros O H. Proc. Natl. Acad. Sci. USA, 1991, 88(23): 10754-10758
8 Finnegan J M,Pihel K, Cahill P S, Huang L, Zerby S E, Ewing A G, Kennedy R T, Wightman R M. J. Neurochem., 1996, 66(5): 1914-1923
9 Mosharov E V, Sulzer D. Nat. Methods, 2005, 2(9): 651-658
10 Trouillon R, Ewing A G. Anal. Chem., 2013, 85(9): 4822-4828
11 Li Y T, Zhang S H, Wang X Y, Zhang X W, Oleinick A I, Svir I, Amatore C, Huang W H. Angew. Chem. Int. Ed., 2015, 54(32): 9313-9318
12 Majdi S, Berglund E C, Dunevall J, Oleinick A I, Amatore C, Krantz D E, Ewing A G. Angew. Chem. Int. Ed., 2015, 54(46): 13609-13612
13 Li X, Mohammadi A S, Ewing A G. J. Electroanal. Chem., 2016, 781: 30-35
14 Wang K, Zhao X, Li B, Wang K, Zhang X, Mao L, Ewing A, Lin Y. Anal. Chem., 2017, 89(17): 8683-8688
15 Sombers L A, Maxson M M, Ewing A G. J. Neurochem., 2005, 93(5): 1122-1131
16 Borges R, Travis E R, Hochstetler S E, Wightman R M. J. Biol. Chem., 1997, 272(13): 8325-8331
17 Camacho M, Machado J D, Montesinos M S, Criado M, Borges R. J. Neurochem., 2006, 96(2): 324-334
18 Haynes C L, Siff L N, Wightman R M. BBA Mol. Cell Res., 2007, 1773(6): 728-735
19 Machado J D, Morales A, Gomez J F, Borges R. Mol. Pharmacol., 2001, 60(3): 514-520
20 Calvo Gallardo E, López Gil , Méndez López I, Martínez Ramírez C, Padín JF, García A G. J. Neurochem., 2016, 139(5): 722-736
21 Pothos E N, Mosharov E, Liu K P, Setlik W, Haburcak M, Baldini G, Gershon M D, Tamir H, Sulzer D. J. Physiol., 2002, 542(2): 453-476
22 Elhamdani A, Palfrey H C, Artalejo C R. Neuron, 2001, 31(5): 819-830
23 Omiatek D M, Santillo M F, Heien M L, Ewing A G. Anal. Chem., 2009, 81(6): 2294-2302
24 Omiatek D M, Dong Y, Heien M L, Ewing A G. ACS Chem. Neurosci., 2010, 1(3): 234-245
25 Omiatek D M, Bressler A J, Cans A S, Andrews A M, Heien M L, Ewing A G. Sci. Rep., 2013, 3: 1447
26 Dunevall J, Fathali H, Najafinobar N, Lovric J, Wigstrm J, Cans A S, Ewing A G. J. Am. Chem. Soc., 2015, 137(13): 4344-4346
27 Li X, Majdi S, Dunevall J, Fathali H, Ewing A G. Angew. Chem. Int. Ed., 2015, 54(41): 11978-11982
28 Li X, Dunevall J, Ewing A G. Acc. Chem. Res., 2016, 49: 2347-2354
29 Lovric J, Najafinobar N, Dunevall J, Majdi S, Svir I, Oleinick A, Amatore C, Ewing A G. Faraday Discuss., 2016, 193: 65-79
30 Najafinobar N, Lovric J, Majdi S, Dunevall J, Cans A S, Ewing A. Angew. Chem. Int. Ed., 2016, 55(48): 15081-15085
31 Li X, Dunevall J, Ren L, Ewing A G. Anal. Chem., 2017, 89(17): 9416-9423
32 Ren L, Pour M D, Majdi S, Li X, Malmberg P, Ewing A G. Angew. Chem. Int. Ed., 2017, 56(18): 4970-4975
33 Li X, Ren L, Dunevall J, Ye D, White H S, Edwards M A, Ewing A G. ACS Nano, 2018, 12(3): 3010-3019
34 Zhu W, Gu C, Dunevall J, Ren L, Zhou X, Ewing A G. Angew. Chem. Int. Ed., 2019, 58(13): 4238-4242
35 Lebègue E, Anderson C M, Dick J E, Webb L J, Bard A J. Langmuir, 2015, 31(42): 11734-11739
36 Cheng W, Compton R G. Angew. Chem. Int. Ed., 2014, 53(50): 13928-13930
37 Cheng W, Compton R G. ChemElectroChem, 2016, 3(12): 2017-2020
38 Cheng W, Compton R G. Angew. Chem. Int. Ed., 2016, 55(7): 2545-2549
39 Li X, Dunevall J, Ewing A G. Faraday Discuss., 2018, 210(0): 353-364
40 Lovric J, Dunevall J, Larsson A, Ren L, Andersson S, Meibom A, Malmberg P, Kurczy M E, Ewing A G. ACS Nano, 2017, 11(4): 3446-3455
41 Phan N T N, Li X, Ewing A G. Nat. Rev. Chem., 2017, 1: 0048
42 Ren L, Mellander L J, Keighron J, Cans A S, Kurczy M E, Svir I, Oleinick A, Amatore C, Ewing A G Q. Rev. Biophys., 2016, 49: e12
43 Li X, Dunevall J, Ewing A G. Angew. Chem. Int. Ed., 2016, 55: 9041-9044
44 Mohammadi A S, Li X, Ewing A G. Anal. Chem., 2018, 90(14): 8509-8516
45 Ye D, Ewing A. ChemPhysChem, 2018, 19(10): 1173-1179
46 Ye D, Gu C, Ewing A. ACS Chem. Neurosci., 2018, 9(12): 2941-2947
47 Li Y, Deng H Q, Dick J E, Bard A J. Anal. Chem., 2015, 87(21): 11013-11021
48 Chen L, He H, Jin Y. Anal. Chem., 2015, 87(1): 522-529
49 Holden D A, Watkins J J, White H S. Langmuir, 2012, 28(19): 7572-7577
50 Liu Y, Xu C, Chen X, Wang J, Yu P, Mao L. Electrochem. Commun., 2018, 89: 38-42
51 Darvish A, Goyal G, Aneja R, Sundaram R V K, Lee K, Ahn C W, Kim K B, Vlahovska P M, Kim M J. Nanoscale, 2016, 8(30): 14420-14431
Electrochemical Analysis of Single Neuronal Vesicles
QI Camaoji, SHA Zheng Yue, LI Xian Chan*
(Center for Imaging and Systems Biology, College of Life and Environmental Sciences,
Minzu University of China, Beijing 100081, China)
Abstract Brain science has attracted more and more attention in the world recently. The storage, release and their function of chemical transmitters are important in neural biology. As the main subcellular organelle for chemical transmitter storage and release, nerve vesicles have attracted much attention. Compared with common vesicle analysis techniques, electroanalytical chemistry has advantages in the analysis of single nerve vesicle due to its high time resolution and sensitivity, especially the use of micro and nano electrodes. In recent years, vesicle impact electrochemical cytometry (VIEC) and resistive pulse method have been applied rapidly in the field of single vesicles analysis. VIEC can be used to quantitate the storage of neurotransmitters in single vesicles by breaking the vesicle membrane on the electrode surface through electroporation. Resistive pulse method can be used to measure the size, surface charge, and other parameters or characteristics of vesicles by monitoring the changes of ion current caused by single vesicles passing through micro/nanopores. Focusing on the electro analysis of single nerve vesicles, this paper mainly introduces the important progress of VIEC and resistive pulse method in the field of single vesicles analysis in recent years, and has a briefly outlook of the application of these two methods in life analytical chemistry including neuro analytical chemistry and biomedicine.
Keywords Brain science; Nerve vesicles; Electroanalytical chemistry; Vesicle impact electrochemical cytometry; Resistive pulse method; Review
