脑神经化学活体原位电化学分析研究进展
2019-11-12薛亦飞肖通方蒋亚楠吴菲于萍毛兰群
薛亦飞 肖通方 蒋亚楠 吴菲 于萍 毛兰群


摘 要 脑科学已经成为多学科交叉研究的前沿领域之一, 其中脑神经化学的研究由于能够揭示脑活动和脑疾病过程中的物质基础, 在神经科学和化学等领域引起了高度关注。电化学分析方法具有高灵敏度、高时空分辨、电极/溶液界面可设计等特点, 尤其适用于在活体动物层次开展脑神经化学的分析研究。本文围绕活体原位电化学分析方法的原理和特点, 综述了近年来电化学分析方法在脑神经化学研究中的应用, 并对其未来的发展前景进行了展望。
关键词 活体电化学分析; 脑神经化学; 原位检测; 评述
1 引 言
脑科学是目前国际前沿科技的热点研究领域之一, 对脑功能的研究有助于理解人类认知、情感等复杂生理过程的本质, 以及神经系统疾病的形成和发展规律。脑神经信號的传递以及代谢过程都离不开化学物质的参与, 因此, 针对脑内神经递质、调质、能量代谢物质、自由基、离子等诸多神经化学物质开展脑神经分析化学研究, 对于探索和认识神经生理、病理的分子机制, 都具有极其重要的意义。
脑神经化学物质的分析一般分为单囊泡、单细胞、脑片和活体等不同层次。其中, 在单囊泡、单细胞及脑片层次上进行化学物质检测脱离了活体生存的真实环境, 较难保持细胞之间固有的联系和相互作用。相比较而言, 活体层次对脑化学物质进行分析, 能够更加真实、直接地反映神经系统在各种生理、病理过程中对外界刺激的响应, 因而能够为脑神经生理、病理过程物质基础的探索提供最为直接的信息。
电化学分析方法通常具有灵敏度高、选择性好、时空分辨率高等优点, 且检测电极易于微型化, 适用于活体原位分析测定。活体原位电化学分析方法可望应用于脑内不同化学物质基础水平及其在一系列生理、病理过程中浓度变化的监测。脑神经活体原位电化学分析可追溯到20世纪50年代, Clark等[1]利用玻璃封装的铂丝作为研究电极, 首次通过电化学伏安法实现了脑内氧气浓度变化的实时监测。但是, 这一研究并没有引起研究者们的广泛关注。更为人们熟知的是, 1973年Adams 等[2]首次将微型碳糊电极植入大鼠脑中进行活体电化学研究, 其电极结构如图1A所示。该研究得到了活体脑内的第一张循环伏安图(图1B),进一步验证了在脑内使用电化学方法实现生理活性物质检测的可行性, 引起了神经生理学家的高度关注, 标志着活体原位脑神经电化学分析的诞生。
近年来, 随着分析科学、化学、电子科学、神经科学等多学科的快速发展和交叉融合, 脑神经活体原位电化学分析也不断发展完善, 为相关生理、病理过程研究提供了重要的实验方法, 进一步推动了分析化学与脑神经科学的实质性交叉与融合。本文着重介绍活体原位电分析化学方法的原理、特点及其在脑神经化学研究中应用的进展, 并对其发展趋势进行展望。
2 活体原位电化学分析方法
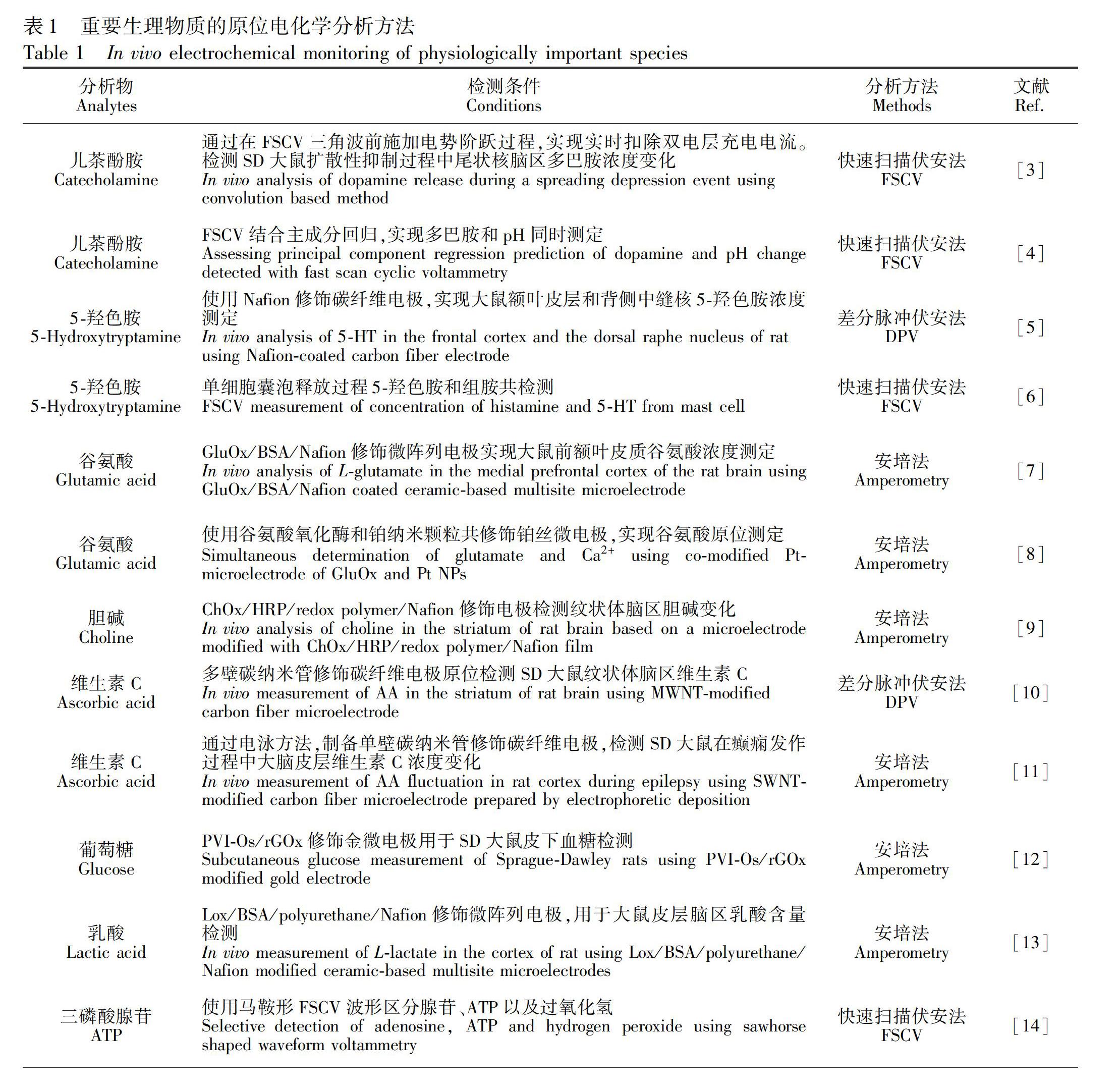
目前,在神经科学领域, 利用电化学分析方法可实现多种生理活性物质的活体原位实时分析。表1列举了一些重要的生理活性物质及其活体原位电化学分析方法。
2.1 基于伏安法的活体原位电化学分析
伏安法是一类重要的电化学测量方法, 通过向电极施加调制的电压波形, 测量电化学体系的电流响应, 从而获得电极过程的电位 电流关系。通过对伏安曲线波形和峰高等参数进行分析, 可实现对于具有不同电化学参数的电化学活性物质进行定性与定量分析。伏安法选择性高, 可实现单一或多种物质同时的选择性分析。然而, 伏安法的时间分辨率通常会受到扫描速率的限制, 同时施加的调制电压波形也会对分析体系产生一定影响。
根据伏安法检测过程中施加波形的不同又可将其分为脉冲伏安法和电势扫描伏安法。其中, 脉冲伏安法的特点是可有效抑制背景充电电流, 并降低扩散层变化的影响, 具有灵敏度高、选择性高、可同时区分多种电化学活性物质等优势, 但时间分辨率比较低, 无法记录快速变化过程。自20世纪70年代以来, 以差分脉冲伏安法(Differential pulse voltammetry, DPV)为代表, 并包括常规脉冲伏安法(Normalpulse voltammetry, NPV)、 差分常规脉冲伏安法(Differential normal pulse voltammetry, DNPV)及方波伏安法(Square wave voltammetry, SWV)等在内的脉冲伏安法逐渐被应用于脑内多种神经递质的同时检测。为了提高伏安法的时间分辨率, 实现短时间递质快速变化过程的实时分析, 以快速扫描循环伏安法(Fast scan cyclic voltammetry, FSCV)为主的电势扫描伏安法在近几十年中得到了很好的发展。FSCV方法可实现快速分析, 但背景电流大, 难以用于神经化学物质基础水平的检测和长时程记录。目前, 该方法主要应用于多巴胺刺激释放等电化学活性神经化学物质的快速变化过程研究。
2.1.1 DPV方法 DPV法是一种脉冲伏安测量技术。检测过程中, 直流电压以一定频率和幅值进行步进扫描, 并在每次步进时叠加固定幅值(10~100 mV)的方波脉冲, 记录脉冲结束前和脉冲开始前的电流差值。DPV检测过程中采用的特殊脉冲波形、采样方法以及电流差减运算配合原位电化学检测使用的微电极, 可有效排除双电层充电电流以及扩散层变化的影响, 显著提高分析方法灵敏度和选择性。对于氧化电位差大于100 mV的电活性物质, 使用DPV方法可有效排除氧化还原电流的相互干扰, 实现不同物质的区分及定量分析。
DPV方法在活体原位电化学分析领域的应用可追溯到1976年, Lane等[22]首次使用经KI溶液处理过的铂微电极作为研究电极, 通过DPV方法实现了Sprague Dawley(SD)大鼠尾状核维生素C和儿茶酚胺浓度的同时检测, 其电极结构如图2A所示。随后, Gonon等[23]使用DPV方法实现了麻醉大鼠纹状体脑区电化学活性神经化学物质的原位分析, 记录到的DPV曲线如图2B所示。通过干预实验对比, 最终将记录到的儿茶酚电流信号归属为DOPAC。此后, DPV方法逐渐被应用于电活性神经化学物质的多组分同时分析[24~26]。
DPV方法不仅可实现具有电化学活性神经化学物质的直接分析, 也可利用非电化学活性物质与电极修饰材料间的相互作用, 实现部分电化学活性较差的神经分子的间接检测。Chai等[27]使用无铜衍生的超氧化物歧化酶(E2Zn2SOD)作为生物识别元件, 利用其与Cu2+的特异性相互作用, 构筑了用于Cu2+检测的电极界面, 利用DPV法实现了活体原位Cu2+的检测, 方法灵敏、可靠。Zhao等[28]合成了一种二茂铁吡啶衍生物(N (6 aminopyridin 2 yl)ferrocene, Fc Py), 利用吡啶作为质子响应单元, 二茂铁作为电化学响应单元, 通过DPV方法实现了pH值的活体原位分析。
2.1.2 FSCV FSCV是一种具有高时间分辨率的电势扫描伏安法。以碳纤维微电极作为研究电极, 并以一定频率施加大于100 V/s 扫速的三角波进行循环伏安分析, 可达到毫秒级的时间分辨率[29]。在FSCV分析中, 随着电位扫描速度的增加, 电化学反应动力学较慢的物质将表现得更不可逆, 其氧化还原峰偏移程度大于电化学反应速度较快的电活性物质, 从而实现对不同电极过程动力学的物质进行区分。FSCV与常规扫速(1~500 mV/s)下的循环伏安法不同, 电位扫描过程中, 由于双电层充放电电流与扫速成正比, 而法拉第电流与扫速的平方根成正比。因此,高扫速下,循环伏安曲线中双电层充放电所贡献的非法拉第电流会明显增大, 并成为能记录到的总电流的主要组成部分, 影响对目标分析物氧化还原过程法拉第电流的提取。通常,FSCV的结果会以变化前某一特定周期的FSCV数据作为背景进行扣除, 以便降低背景电流的影响[30]。扣除背景后的FSCV结果可进行定性和定量分析。但是,由于背景扣除过程所扣除的一般是固定的循环伏安数据, 这将导致在长时间电化学分析中双电层结构变化所造成的背景电流漂移不断积累, 对分析结果产生较大影响。因此, 该方法持续分析时间通常约1 min, 不宜进行长时间的连续分析。此外, 背景扣除导致了FSCV法很难实现脑内神经化学物质的基础水平测定[31]。
目前, FSCV方法应用较为成熟的测定体系是对脑内儿茶酚胺类神经递质(尤其是多巴胺)快速变化过程的原位实时分析[32]。活体分析过程中, 在每个施加的三角波之间通常会将研究电极维持在负电位(如Symbolm@@
0.4 V)下, 利于儿茶酚胺类物质在电极表面的富集, 从而提高检测的灵敏度[33]。同时, 带负电的物质不会得到富集,在一定程度上也提高了FSCV对儿茶酚胺类物质检测的选择性。在高扫速下, 多巴胺等具有较快电子转移速率的电化学活性物质的氧化还原电流得到大幅提高; 另一方面也使得抗坏血酸等电子转移速度相对较慢的干扰物质在电极上表现得更不可逆, 其氧化峰正移, 进而实现对多巴胺等物质的选择性检测[34,35]。
FSCV方法虽然具有良好的选择性和灵敏度, 并能够实现高时间分辨, 但由于脑神经系统中多种电化学活性生理物质具有相近的氧化电位, 导致产生的氧化还原电流相互交叠, 不容易区分与精准定量。因此, 早期的FSCV方法主要用作神经化学过程中电化学活性物质的定性和半定量研究。Wightman 等[36]利用不同颜色代表不同电流值, 将一组FSCV数据拼合绘制成“电位 时间 电流”二维图, 即可通过二维图中不同的图案直观地看出不同时间不同电化学活性物质浓度的变化过程, 为人们研究复杂生理病理过程中物质的变化提供了可能。
采用FSCV方法进行定量分析时, 通常在目标分析物FSCV结果中选取氧化还原电流较大, 且无其它物质干扰电位下的电流值, 以此绘制出电流随时间变化的曲线, 或根据线性关系换算为浓度 时间曲线。然而, 这种方法在多种物质变化的复杂体系中存在很大的局限性。为了解决FSCV方法在复杂体系中的定量问题, Heien等[37]将主成分回归(Principal component regression, PCR)应用于多种物质变化的复杂体系下FSCV结果的定量分析。他们发现, 多巴胺的FSCV波形与不同pH值造成的FSCV波形变化有明显差异, 如图3A和3B所示。采用主成分回归方法可将FSCV波形中多巴胺的氧化还原波形和pH值造成的波形变化进行有效地区分, 并逐渐发展出多巴胺和pH值双组分同时测定的方法[4, 38]。随后, Heien等[39]利用该方法研究了可卡因对尾状核脑区多巴胺释放的调控, 以及该过程中的pH值变化(图3C)。
在FSCV分析时, 主成分回归方法虽然可用于解决多种神经化学物质的区分和定量问题, 但由于双电层变化导致的背景电流漂移却无法通过主成分回归消除。为了使主成分回归算法计算结果真实有效, FSCV方法应用于活体分析的持续时间通常短于90 s[4]。很多研究组也通过优化FSCV分析中所使用的电极和数据处理方法, 使其能够进行长时间的活体分析。如Clark等[40]将直径7 μm的碳纤维封装在直径90 μm的熔融玻璃毛细管中, 发现电极尺寸的减小可明显降低其对脑组织的损伤, 并减少免疫反应, 从而使电极具有良好的生物兼容性。利用此电极, 实现了对脑内多巴胺长达10~16 周的活体分析。Schwerdt等[41]进一步优化了长时间记录时FSCV的数据处理方法, 通过将持续记录的FSCV数据分割成多个50 s时长, 分别进行主成分回归分析, 再将分析结果拼合即可得到较长时间的检测结果, 最终实现了使用长期植入阵列电极进行非人灵长类动物脑内多巴胺变化的长时程监测。
2.2 基于安培法的活体原位电化学分析
安培法(Amperometry)是一种通过向研究电极施加恒定电位, 从而实现对电化学活性物质定量分析的电化学方法。其特点在于, 测量过程中研究电极维持恒定电位, 从而降低双电层充电电流的影响。因此, 相对于FSCV方法, 安培法可进行长时间的持续分析检测。但是, 安培法只能提供某一固定電位下的电流信息, 因此, 分析方法的选择性完全取决于电极界面的反应和设定的电位。近年来, 安培法逐渐成为活体原位电化学分析中的主要方法之一。通过合理构筑电极/溶液界面, 调控物种的电极反应动力学, 一些神经化学物质(如维生素C、O2、H2O2、NO、H2S)都可通过安培法实现活体原位分析。
2.2.1 维生素C的活体原位电化学分析 维生素C(Vitamin C or ascorbic acid, AA)是神经系统中的一种重要神经化学物质, 具有较强的还原性, 在许多生理病理过程中发挥着重要的作用。在多数碳电极表面, 维生素C的电化学过程表现为内壳层反应, 极易受到电极表面物理化学性质的影响。同时, 维生素C的电化学氧化会产生具有非电化学活性、易吸附于电极表面的水解产物, 导致电极灵敏度下降。因此, 维生素C在常规的碳纤维电极上表现出较慢的电子转移速率、高的过电位和较差的稳定性[42, 43]。Zhang 等[10, 44]首先发现在碳纳米管修饰电极上维生素C具有较低的氧化过电位, 可用于维生素C的原位检测(图4A)。他们使用多壁碳纳米管修饰碳纤维电极在维生素C溶液中进行循环伏安分析, 实验结果表明, 维生素C的氧化电流在0.0 V(相比于标准Ag/AgCl电极)就达到了稳态(图4B)。该电位下不会发生多巴胺、5 羟色胺、DOPAC等其它脑内常见神经化学物质的氧化, 说明多壁碳纳米管修饰碳纤维电极可实现维生素C的高选择性分析(图4C)。此外, 他们发现碳纳米管电极还可提高维生素C连续测定的稳定性。基于这些性能, 成功建立了鼠脑内维生素C的活体原位电化学分析新方法。
随后, Xiang等[45]制备了阵列碳纳米管包覆的碳纤维电极, 将电极植入鼠脑纹状体, 并施加+0.05 V(vs. Ag/AgCl)的极化电压, 利用安培法实现了脑内维生素C的活体原位分析。基于该方法高的时空分辨率, 通过在微电极附近灌注谷氨酸溶液, 他们在活体层次观察到了脑神经系统内抗坏血酸 谷氨酸的“异相交换”过程。
Xiao等[11,46]利用电泳的方法将单壁碳纳米管沉积于碳纤维电极的表面, 并通过高温和电化学处理, 得到了对维生素C具有高选择性和高稳定性的碳纳米管电极。该方法制备的电极具有高度的一致性, 解决了碳纳米管在碳纤维电极表面制备重现性差的问题。他们将制备的电极植入鼠脑皮层, 在+0.05 V极化电位下, 首次在活体动物层次观测到了癫痫模型和扩散性抑制过程中脑内维生素C浓度升高的现象(图5A和5B), 为进一步研究这些病理过程中的分子机制提供了直接的实验基础。
2.2.2 氧气的原位电化学检测 氧气在生命体中发挥着重要的作用。氧气供给不足会造成神经系统能量代谢困难, 增加氧化应激压力, 甚至造成细胞损伤。因此, 对脑内氧气浓度的原位检测将直接反映神经系统的活动功能。利用安培法进行氧气活体原位分析的关键问题在于, 在以金和碳等材料为基底的电极表面, 氧气电化学还原过程通常以两步两电子还原为主, 生成过氧化氢中间产物[47]。而在铂基电极材料表面, 氧气电化学还原过程以四电子还原为主, 最终生成水[48]。在活体原位分析中, 考虑到氧气两电子电化学还原过程生成的过氧化氢中间产物可能会对神经系统造成损伤[49], 所以铂基电极能够较好适用于脑内氧气的活体电化学分析[50, 51]。Xiang 等[52]使用电沉积的方法, 在垂直生长碳纳米管的碳纤维电极(图6A)上通过循环伏安法电化学沉积铂, 最终得到表面均匀覆盖铂纳米颗粒的修饰电极(图6B)。在Symbolm@@
0.5 V的电位下, 该电极对氧气检测表现出较高的灵敏度和选择性, 其它脑内常见的生理活性物质均不会对氧气检测产生干扰(图6C)。为了进一步降低电极表面蛋白污染, 提高电极对氧气检测的稳定性, 他们用Nafion膜修饰电极, 最终实现了氧气的四电子电化学还原和选择性测定, 以及大鼠海马脑区在全脑缺血 再灌注时氧气浓度变化的活体原位分析(图6D)。
2.2.3 基于离子传输的原位电化学分析 神经生理物质中的非电化学活性分子, 一般可采用生物传感器进行检测。然而酶等生物识别元件有限, 限制了该方法在活体原位电化学分析中的发展。近年来, 基于离子传输构建的电化学分析方法逐渐成为活体分析新的发展方向[53]。He等[54]首次报道了聚电解质刷修饰后玻璃微米管的整流行为。在此基础上, Zhang 等[55]通过在玻璃微米管内壁共修饰聚电解质刷以及Aptamer实现了ATP的选择性检测。 Colombo等[56, 57]通过在玻璃纳米孔中构建液 液界面, 基于离子传输原理实现了对多巴胺、乙酰胆碱、5 羟色胺的检测。由于这一电化学分析新方法的原理是对微/纳孔道内离子流进行检测, 不需要待测物在电极表面发生电化学氧化还原反应, 预期该方法在电化学惰性物质的活体电化学分析中具有很高的应用潜力。
2.3 基于电位法的活体原位电化学分析
电位法(Potentiometry)是一种在开路状态下, 直接记录研究电极相对于参比电极的电位来分析电极表面目标物浓度的分析方法。相对于伏安法和安培法, 电位法的优势在于, 测量回路中电流几乎为零, 排除了因测量而产生的电流对脑神经的影响。根据能斯特方程, 在平衡状态下, 电极开路电位(Open circuit potential, OCP)的变化是由电极溶液界面各种化学物质的活度决定的。通过设计选择性识别单元, 可显著提高开路电位对特定物质浓度变化响应的灵敏度, 并降低其它物质的干扰, 从而实现定量分析。
电位法通常用于离子等非电化学活性物质测定, 例如, 在微电极表面修饰离子选择性膜作为识别单元, 构建全固态离子选择性电极, 可实现脑內H+、K+、Ca2+等活体原位分析。Hao等[58]将质子选择性膜修饰于碳纤维电极上, 制备了对H+具有选择性好和抗污染性能强的全固态pH选择性电极, 电极灵敏度达到58.4 mV/pH, 接近Nernst方程的理论值。利用该电极, 他们原位检测了大鼠吸入CO2后恐慌过程中脑内pH值变化。
除了对离子进行检测, 近年出现了一种基于原电池原理的电位测定方法(Galvanic redox potentiometry, GRP), 利用阳极作为指示电极测定分析物电化学氧化电位, 阴极作为参比电极, 通常设计为氧还原过程。使用具有高电阻的电位计将阴极、阳极连成回路(图7A)。由于回路具有高阻抗, 因此回路中电流很小, 电极过程近似处于热力学平衡态。当阴极还原电位高于阳极氧化电位时, 整个回路中的电化学过程可自发进行, 其输出的电压值可作为定量物质浓度的指标[59], 最终实现电化学活性物质的检测分析。Wu等[60]利用漆酶修饰的碳纤维电极插入到毛细管内指示溶液中氧气还原电位, 提高了该GRP体系中作为参比的阴极氧气的还原电位。检测过程中毛细管内溶液氧气浓度保持恒定, 提高了体系的灵敏度和稳定性。蛋白吸附污染并不会影响GRP体系的灵敏度(图7B), 说明该方法具有较高的抗污染干扰能力。他们将碳纳米管修饰的碳纤维电极阳极与漆酶修饰的碳纤维电极阴极植入大鼠的大脑皮层, 实现了大鼠全脑缺血/再灌注过程中脑内抗坏血酸的活体原位测定(图7C)。
3 总结与展望
脑神经活体原位电化学分析是活体分析研究的重要手段之一, 不同电化学方法根据其特点和优势可用于不同的活体原位分析。目前, 通过选择合适的电化学方法, 设计合理的电极界面, 可实现多种神经生理物质的原位分析, 对于脑科学的研究起到了较好的推动作用。然而, 目前仍然还有很多重要神经生理物质, 尤其是非电化学活性物质, 仍然难以通过现有的电化学分析方法进行活体原位检测。而许多已有的活体原位电化学分析方法, 仍然面临着问题和挑战。例如, 利用微电极进行活体原位分析检测时, 普遍存在电极在活体环境中的稳定性和抗污染问题, 活体检测环境与体外校正环境存在差异等。对于活体原位电化学分析研究而言, 其最终目标是, 在最大程度减少对实验动物损伤影响的条件下, 精准地记录生理和病理过程中神经分子的变化。因此, 电极/脑界面的设计和调控[61,62]、电极表面抗污染[63, 64], 电极进一步微型化[65,66]、柔性化[67]、记录设备小型化、无线化[68~70]等, 都应为未来的重点研究内容。此外, 利用所发展的活体原位电化学分析方法, 实现与脑神经科学家的实质性合作, 在活体层次发现并描述脑神经生理和病理过程的分子事件, 也将是活体电化学分析领域的研究核心之一。
References
1 Clark L C, Misrahy G, Fox R P. J. Appl. Physiol., 1958, 13(1): 85-91
2 Kissinger P T, Hart J B, Adams R N. Brain Res., 1973, 55(1): 209-213
3 Johnson J A, Hobbs C N, Wightman R M. Anal. Chem., 2017, 89(11): 6166-6174
4 Keithley R B, Wightman R M. ACS Chem. Neurosci., 2011, 2(9): 514-525
5 Crespi F, Martin K, Marsden C. Neuroscience, 1988, 27(3): 885-896
6 Travis E R, Wang Y M, Michael D J, Caron M G, Wightman R M. Proc. Natl. Acad. Sci. USA, 2000, 97(1): 162-167
7 Burmeister J J, Gerhardt G A. Anal. Chem., 2001, 73(5): 1037-1042
8 ZHAO Fan, SHI Guo Yue, TIAN Yang. Chinese J. Anal. Chem., 2019, 47(3): 347-354
趙 凡, 施国跃, 田 阳. 分析化学, 2019, 47(3): 347-354
9 Garguilo M G, Michael A C. J. Am. Chem. Soc., 1993, 115(25): 12218-12219
10 Zhang M, Liu K, Xiang L, Lin Y, Su L, Mao L. Anal. Chem., 2007, 79(17): 6559-6565
11 Xiao T, Jiang Y, Ji W, Mao L. Anal. Chem., 2018, 90(7): 4840-4846
12 Csoeregi E, Quinn C P, Schmidtke D W, Lindquist S E, Pishko M V, Ye L, Katakis I, Hubbell J A, Heller A. Anal. Chem., 1994, 66(19): 3131-3138
13 Burmeister J J, Palmer M, Gerhardt G A. Biosens. Bioelectron., 2005, 20(9): 1772-1779
36 Michael D, Travis E R, Wightman R M. Anal. Chem., 1998, 70(17): 586A-592A
37 Heien M, Johnson M A, Wightman R M. Anal. Chem., 2004, 76(19): 5697-5704
38 Keithley R B, Heien M L, Wightman R M. TrAC Trends Anal. Chem., 2009, 28(9): 1127-1136
39 Heien M, Khan A S, Ariansen J L, Cheer J F, Phillips P E M, Wassum K M, Wightman R M. Proc. Natl. Acad. Sci. USA, 2005, 102(29): 10023-10028
40 Clark J J, Sandberg S G, Wanat M J, Gan J O, Horne E A, Hart A S, Akers C A, Parker J G, Willuhn I, Martinez V, Evans S B, Stella N, Phillips P E M. Nat. Methods, 2010, 7(2): 126-132
41 Schwerdt H N, Shimazu H, Amemori K I, Amemori S, Tierney P L, Gibson D J, Hong S, Yoshida T, Langer R, Cima M J, Graybiel A M. Proc. Natl. Acad. Sci. USA, 2017, 114(50): 13260-13265
42 Pisoschi A M, Pop A, Serban A I, Fafaneata C. Electrochim. Acta, 2014, 121: 443-460
43 Cheng H, Li L, Zhang M, Jiang Y, Yu P, Ma F, Mao L. TrAC Trends Anal. Chem., 2018, 109: 247-259
44 Zhang M, Liu K, Gong K, Su L, Chen Y, Mao L. Anal. Chem., 2005, 77(19): 6234-6242
45 Xiang L, Yu P, Hao J, Zhang M, Zhu L, Dai L, Mao L. Anal. Chem., 2014, 86(8): 3909-3914
46 Xiao T, Wang Y, Wei H, Yu P, Jiang Y, Mao L. Angew. Chem. Int. Edit., 2019, 58(20): 6616-6619
47 Kruusenberg I, Alexeyeva N, Tammeveski K. Carbon, 2009, 47(3): 651-658
48 Chen Z, Waje M, Li W, Yan Y. Angew. Chem. Int. Edit., 2007, 46(22): 4060-4063
49 Ledo A, Lourenco C F, Laranjinha J, Brett C M, Gerhardt G A, Barbosa R M. Anal. Chem., 2017, 89(3): 1674-1683
50 Jung S K, Gorski W, Aspinwall C A, Kauri L M, Kennedy R T. Anal. Chem., 1999, 71(17): 3642-3649
51 You T, Niwa O, Tomita M, Hirono S. Anal. Chem., 2003, 75(9): 2080-2085
52 Xiang L, Yu P, Zhang M, Hao J, Wang Y, Zhu L, Dai L, Mao L. Anal. Chem., 2014, 86(10): 5017-5023
53 JIANG Xiao Jing, LIANG Rong Ning, QIN Wei. Chinese J. Anal. Chem., 2018, 46(9): 1350-1356
姜曉晶, 梁荣宁, 秦 伟. 分析化学, 2018, 46(9): 1350-1356
54 He X, Zhang K, Li T, Jiang Y, Yu P, Mao L. J. Am. Chem. Soc., 2017, 139(4): 1396-1399
55 Zhang K, He X, Liu Y, Yu P, Fei J, Mao L. Anal. Chem., 2017, 89(12): 6794-6799
56 Colombo M L, McNeil S, Iwai N, Chang A, Shen M. J. Electrochem. Soc., 2016, 163(4): H3072-H3076
57 Colombo M L, Sweedler J V, Shen M. Anal. Chem., 2015, 87(10): 5095-5100
58 Hao J, Xiao T, Wu F, Yu P, Mao L. Anal. Chem., 2016, 88(22): 11238-11243
59 Wu F, Yu P, Mao L. Chem. Soc. Rev., 2017, 46(10): 2692-2704
60 Wu F, Cheng H, Wei H, Xiong T, Yu P, Mao L. Anal. Chem., 2018, 90(21): 13021-13029
61 CHENG Han, LAN Jia Feng, WEI Guang Han, HUANG Wei Hua, CHENG Jie Ke. Chinese J. Anal. Chem., 2013, 41(4): 540-545
程 寒, 蘭嘉峰, 韦光汉, 黄卫华, 程介克. 分析化学, 2013, 41(4): 540-545
62 HE Quan Guo, LIANG Jing, LI Guang Li, DENG Pei Hong, LIU Jun, LIU Xiao Peng. Chinese J. Anal. Chem., 2018, 46(3): 438-445
贺全国, 梁 静, 李广利, 邓培红, 刘 军, 刘晓鹏. 分析化学, 2018, 46(3): 438-445
63 Liu X, Zhang M, Xiao T, Hao J, Li R, Mao L. Anal. Chem., 2016, 88(14): 7238-7244
64 Liu X, Xiao T, Wu F, Shen M, Zhang M, Yu H, Mao L. Angew. Chem.Int. Edit., 2017, 56(39): 11802-11806
65 YANG Li Li, SONG Yi Lin, XU Sheng Wei, ZHANG Yu, XIAO Gui Hua, ZHANG Song, GAO Fei, LI Zi Yue, CAI Xin Xia. Chinese J. Anal. Chem., 2017, 45(7): 1088-1095
杨丽丽, 宋轶琳, 徐声伟, 张 禹, 肖桂花, 张 松, 高 飞, 李子岳, 蔡新霞. 分析化学, 2017, 45(7): 1088-1095
66 Kozai T D Y, Langhals N B, Patel P R, Deng X, Zhang H, Smith K L, Lahann J, Kotov N A, Kipke D R. Nat. Mater., 2012, 11(12): 1065-1073
67 Guan S, Wang J, Gu X, Zhao Y, Hou R, Fan H, Zou L, Gao L, Du M, Li C, Fang Y. Sci. Adv., 2019, 5(3): eaav2842
68 QIN Tai Chun, LI Xiao Gang, HAO Jie, YU Ping, MAO Lan Qun. Chinese J. Anal. Chem., 2015, 43(3): 457-462
秦泰春, 李晓钢, 郝 洁, 于 萍, 毛兰群. 分析化学, 2015, 43(3): 457-462
69 LI Xiao Gang, GUO Bin Qian, QIN Tai Chun, HAO Jie, YU Ping, MAO Lan Qun. Chinese J. Anal. Chem., 2016, 44(9): 1465-1470
李晓钢, 郭彬乾, 秦泰春, 郝 洁, 于 萍, 毛兰群. 分析化学, 2016, 44(9): 1465-1470
70 SUN Jian Hui, CAI Xin Xia, LIU Jun Tao, WANG Chun Xing, LI Deng Wang, CHEN Ze Yuan, CHENG Chuan Fu, WANG Jin Hui, HU Dong Mei. Chinese J. Anal. Chem., 2017, 45(4): 611-619
孫建辉, 蔡新霞, 刘军涛, 王春兴, 李登旺, 陈泽源, 程传福, 汪金辉, 胡冬梅. 分析化学, 2017, 45(4): 611-619
Progress of in Vivo Electrochemical Analysis
of Brain Neurochemistry
XUE Yi Fei1,2, XIAO Tong Fang1, JIANG Ya Nan1,2,
WU Fei1,2, YU Ping1,2, MAO Lan Qun*1,2
1(Beijing National Laboratory for Molecular Sciences, Key Laboratory of Analytical Chemistry
for Living Biosystems, Institute of Chemistry, Chinese Academy of Sciences, Beijing 100190, China)
2(University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract Brain science has become one of the most advanced interdisciplinary research topics. Analysis of brain neurochemistry has attracted great attention in both neuroscience and chemistry, because it provides a powerful tool to understand the physiological and pathological progresses of the brain at a molecular level. For neurochemical monitoring, electrochemical methods come to prominence with high selectivity, sensitivity, spatiotemporal resolution and designable electrode/solution interface to match the pursuit for in vivo analysis of brain neurochemistry. This review summarizes the development of electrochemical approaches toward brain neurochemistry research from both principal and practical perspectives. In addition, future trends of in vivo electrochemical analysis are prospected.
Keywords In vivo electrochemistry; Brain neurochemistry; In vivo measurement; Review
(Received 30 July 2019; accepted 16 August 2019)
This work was supported by the National Natural Science Foundation of China (Nos. 21790390, 21790391, 21621062, 21874139) and the National Key Research and Develop Program of China (No.2018YFE0200800).
