我国公立医院人员对干细胞临床研究知情同意的认知调查*
2019-11-01马晨光白莉华王剑萍
马晨光 雷 颖 白莉华 王剑萍 林 云 薛 迪
鉴于干细胞临床研究的风险较大,远期和近期收益的不确定性,近来我国加强了干细胞临床研究的管理[1-2]。本研究旨在分析我国公立医院干细胞临床研究相关人员对干细胞临床研究知情同意书相关内容的重要性认知,为我国规范公立医院干细胞临床研究的伦理管理提供参考信息。
1 研究内容与方法
本研究选取了社会经济发展水平分别处于高、中、低的上海市、天津市和贵州省作为调查的省级行政区域,选择此3个区域10所首批和第二批通过国家干细胞临床研究备案的公立医院进行了干细胞临床研究相关人员的问卷调查。问卷调查对象为医院科研部门主要管理者、生物样本库(包括干细胞样本库)的主要负责人、所有从事或未来可能从事干细胞临床研究的研究者和临床医师、药物临床试验机构和伦理委员会的所有委员。通过此问卷调查,以了解公立医院人员对干细胞临床研究知情同意的认知情况。
在对干细胞临床研究知情同意书内容的重要性进行评价时,本研究采用5分制,即1分为“完全不重要”,5分为“非常重要”。若对评价项目不清楚,则填写“0”,分析时作为缺失值。本研究采用SAS 9.3软件进行χ2检验、精确Fisher检验等统计分析。
2 结果
本研究发放问卷882份,共回收10所公立医院干细胞临床研究相关人员的有效问卷882份。
2.1 对干细胞临床研究知情同意内容重要性的评分
调查显示,公立医院人员对干细胞临床研究知情同意内容重要性评分总体较高(各项目的平均评分为4.02分~4.66分);尤其是对干细胞制剂的质量和干细胞临床研究过程的质量控制措施的告知重要性评分均值最高(均为4.66分),对研究存在的主要风险(如致瘤/致癌性)、可能产生的不良事件/反应的处理方法和研究风险控制措施的告知重要性评分均值次之(平均为4.60分、4.60分和4.59分),见表1。
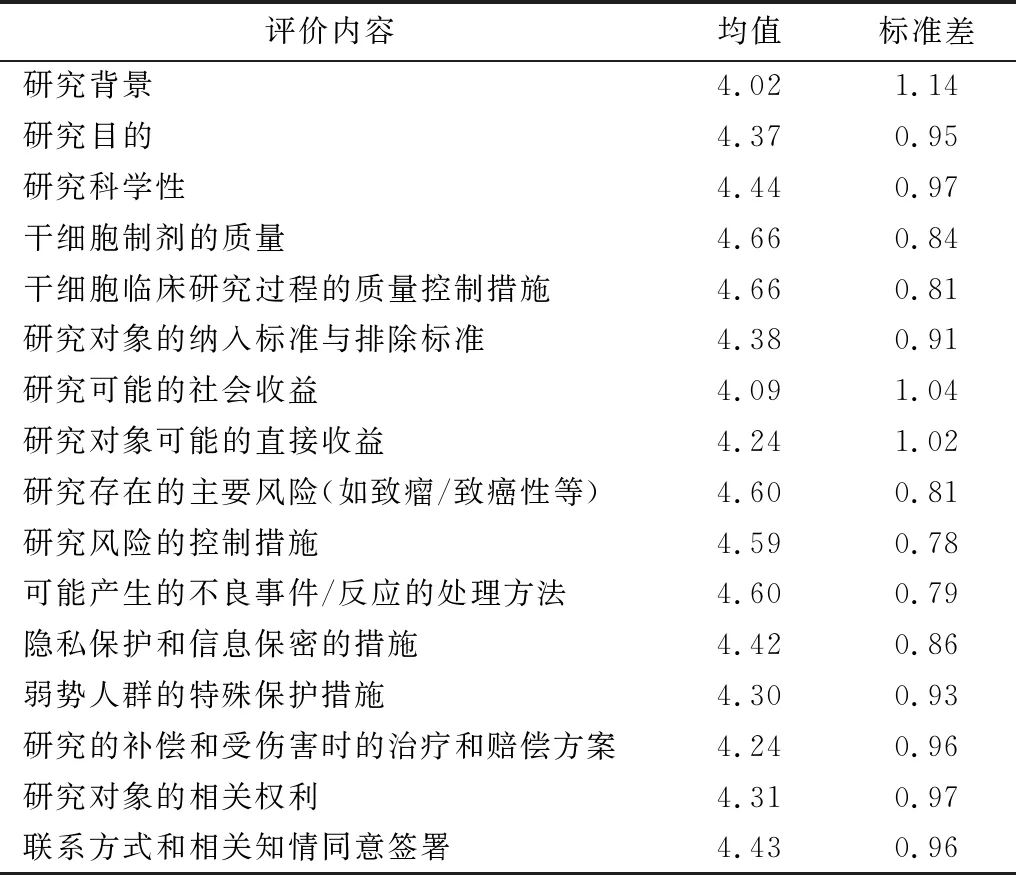
表1 对干细胞临床研究知情同意内容的重要性评分
2.2 对干细胞临床研究知情同意形式和退出方式的认知
调查显示,干细胞临床研究相关人员中,认为干细胞研究知情同意的最好形式为独立的知情同意书者占81.07%;认为干细胞及相关生物样本库的样本和信息退出方式为无条件销毁未使用和正在使用的样本及相关信息、无条件销毁未使用的样本及相关信息、仅销毁可以追踪到个人的样本及相关信息的分别占69.84%、37.84%和29.24%,见表2。
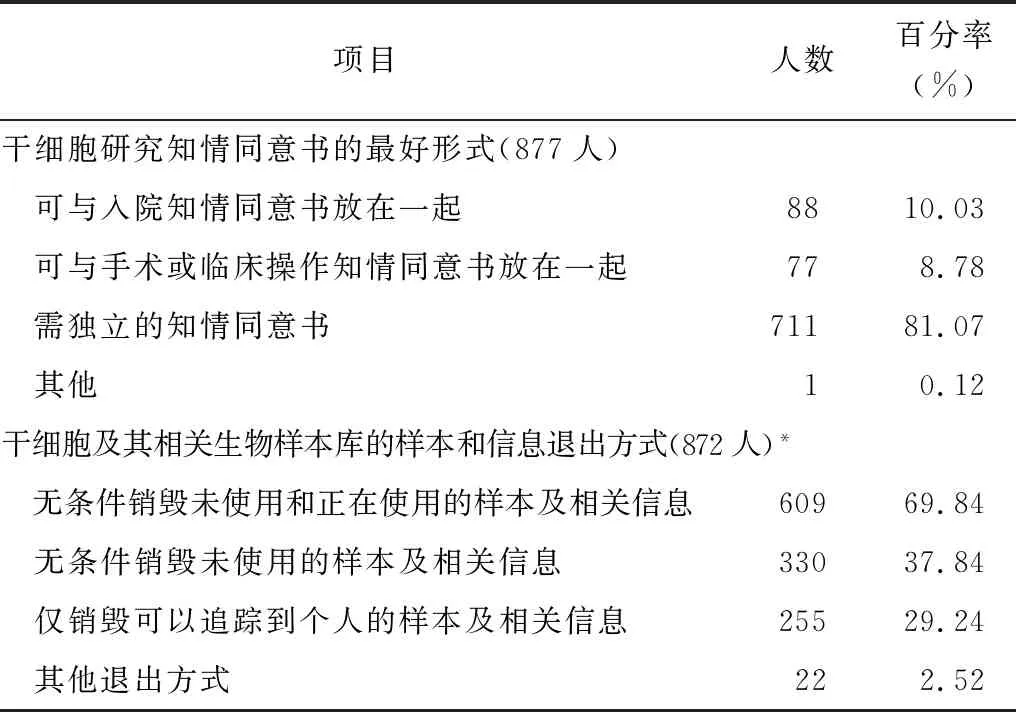
表2 对干细胞临床研究知情同意形式和退出方式的认知分析
*本项为多选
2.3 视知情同意为干细胞临床研究主要伦理问题的比例
调查显示,干细胞临床研究相关人员中,将夸大研究对象可能获得的收益、知情同意的方式和过程以及未充分告知研究对象的风险列为前三位干细胞临床研究主要伦理问题的分别占34.86%、22.15%和21.80%。此外,临床医师将夸大研究对象可能获得的收益作为前三位干细胞临床研究主要伦理问题的比例相对较高(为38.48%),见表3。
表3将干细胞临床研究知情同意列为前三位主要伦理问题的比例(多选)
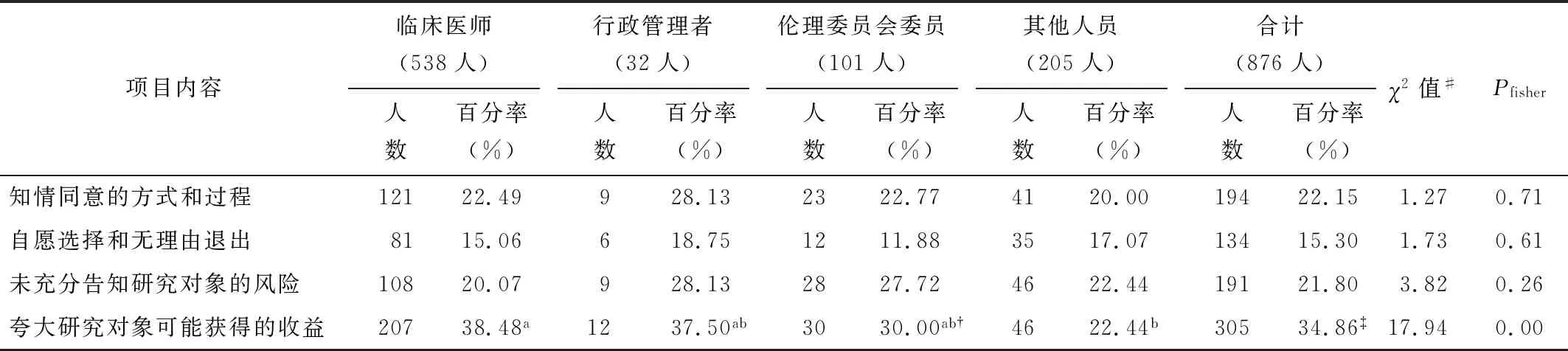
项目内容临床医师(538人)人数百分率(%)行政管理者(32人)人数百分率(%)伦理委员会委员(101人)人数百分率(%)其他人员(205人)人数百分率(%)合计(876人)人数百分率(%)χ2值#Pfisher知情同意的方式和过程12122.49928.132322.774120.0019422.151.270.71自愿选择和无理由退出8115.06618.751211.883517.0713415.301.730.61未充分告知研究对象的风险10820.07928.132827.724622.4419121.803.820.26夸大研究对象可能获得的收益20738.48a1237.50ab3030.00ab†4622.44b30534.86‡17.940.00
注:†此项总人数=100;此项总人数=875;#组间两两比较取检验水准α=0.05/4=0.0125;标有相同字母的发生率类别间差异无统计学意义
3 讨论与建议
3.1 干细胞临床研究知情同意需特别告知的内容
与其他临床研究不同,干细胞制剂质量直接与干细胞临床研究的风险密切相关,并且干细胞临床研究的质量控制和风险控制措施对降低干细胞临床研究风险意义重大[1,3-4]。本研究也发现,公立医院人员对干细胞制剂的质量、研究存在的主要风险(如致瘤/致癌性等)、研究过程质量控制、研究可能产生的不良事件/反应的处理方法和风险控制措施的告知重要性评分均较高(4.5分以上)。这提示,未来在干细胞临床研究知情同意书的审核中,需关注干细胞制剂质量、研究主要风险(如致瘤/致癌性)和研究过程的质量与风险控制措施的告知,让受试者对干细胞临床研究的安全性有更深入的了解,以使他们能在充分知情的情况下,自愿地选择。
3.2 对干细胞临床研究知情同意要求的认知存在不足
调查发现,虽然81.07%的被调查人员认为干细胞临床研究需有独立的知情同意书,但仍有少部分人员认为可与入院知情同意书或与临床手术/操作知情同意书放在一起。这提示目前我国干细胞临床研究的部分相关人员还缺乏对知情同意实施过程的正确认知,这可能会导致医务人员在获得研究对象知情同意时存在不规范的现象[5-6]。此外,近70%的被调查人员认为干细胞临床研究对象或生物样本捐献者退出时,可无条件销毁未使用和正在使用的样本及相关信息,不足40%的人认为可无条件销毁未使用的样本及相关信息或仅销毁可以追踪到个人的样本及相关信息。这提示相关医务人员对干细胞研究与生物样本捐献者知情同意退出方式认知不足。
3.3 知情同意是干细胞临床研究伦理审核的重点之一
知情同意是医学临床研究中十分重要的环节,在临床研究实践活动中,医务人员充分告知研究对象相关信息,使他们充分理解信息,并真正行使自主选择的权利,才能实现真正意义上的知情同意[7-8]。由于干细胞临床研究与应用存在较大临床隐患和特殊风险,撰写良好的知情同意书可以充分告知研究对象研究具有的主要潜在风险和预期收益,尊重和保护患者的合法权益[8-9]。本研究发现,34.86%的被调查人员将夸大研究对象可能获得的收益列为前三位干细胞临床研究的伦理问题,且临床医师此比例相对较高(38.48%)。因此,干细胞临床研究的伦理审核应更关注知情同意书内容的审核,以充分保护受试者的权益。
