技术因素对局部晚期非小细胞肺癌放疗剂量的影响*
2019-11-01李文辉夏耀雄李云芬
李文辉 王 丽 柏 晗 夏耀雄 李云芬 赵 毅
局部晚期非小细胞肺癌(local advanced non-small cell lung cancer,LA-NSCLC)放射治疗剂量一直是肿瘤放射治疗中争议最多的问题。2011年47届美国临床肿瘤学会(America Society of Cancer Organization,ASCO)年会首次报告局部晚期、不可手术切除非小细胞肺癌同期放化疗标准剂量60Gy与高剂量74Gy比较的放射治疗肿瘤学组(Radiation Therapy Oncology Group,RTOG) 0617试验结果,两组中位总生存期(median overall survival,mOS)、无疾病进展生存期(progression-free survival,PFS)和毒副反应基本无差异。2013年,49届ASCO进一步证明高剂量放疗劣效于标准剂量[1],结论是放射治疗高剂量照射“寿终正寝”。从此,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南对LA-NSCLC病人放化同期治疗的放疗标准剂量一直沿用60Gy照射[2-3]。
然而,LA-NSCLC放射治疗剂量问题并未以此告终,反而对RTOG0617试验的质量控制和结果产生了越来越多的质疑,主要集中在放射治疗技术、放射生物和临床实践三个方面,甚至重新开始更多新的个体化剂量试验,如RTOG1106/ACRIN6697等[4-6]。本文主要集中讨论放射治疗技术对照射剂量的影响。
1 LA-NSCLC放射治疗“60Gy标准剂量”的证据来源存在问题
LA-NSCLC放射治疗“60Gy标准剂量”证据主要来源于RTOG0617试验,前任ASCO主席、华盛顿肿瘤研究所Sandra Swain说:“(RTOG0617试验结果)经过10年的研究,我们最终为肺癌中的高剂量和标准剂量放疗争论画上了句号。”但是否能够“画上句号”,仍然应该从试验本身彻底分析。
1.1 “60Gy标准剂量”来源于设计合理结果可靠的RTOG0617试验
RTOG0617临床试验是对比60Gy标准剂量和74 Gy高剂量适型放射治疗同期联合化疗加或不加西妥昔单抗治疗LA-NSCLC的多中心、随机Ⅲ期临床试验[1,7]。设计入组对象是不可手术ⅢA和ⅢB非小细胞肺癌病人,1∶1∶1∶1随机分标准剂量、高剂量加或不加西妥昔单抗4组,全部病人接受每周一次的紫杉醇加卡铂同期化疗。放化疗同期2周后,予每隔3周的紫杉醇加卡铂巩固化疗2周期。行调强放射治疗(intensity-modulated radiation therapy,IMRT)或3维适型放射治疗(three-dimensional conformal radiation therapy,3DCRT)技术,以放疗计划靶区体积(planning target volume,PTV)定义照射处方剂量,2Gy/天。试验主要观察终点是总生存期(overall survival,OS)。
2013年ASCO年会报道544个合格入组病例,照射60Gy标准剂量组好于74Gy高剂量组,两组mOS分别是28.7个月和19.5个月,P=0.0007,18个月无疾病进展生存率、总生存率和局部失败率分别是36.6%比26.3%、66.6%比53.9%和25.1%比34.3%,都存在显著统计学差异。远处转移率虽无统计学意义,也是标准剂量组更低[1]。
2015年2月Bradley等[7]最终于LancetOncol杂志更详细报道了结果和分层分析与毒副反应,结论同上。肿瘤界普遍认为,这是一个设计非常认真严谨的前瞻性多中心随机Ⅲ期临床研究,循证医学一级证据,结果可靠。所以,美国NCCN指南,甚至整个放疗界(特别是欧美)将60Gy定义为标准剂量。
1.2 RTOG0617试验结果不能盲目推广为结论
然而,根据放射生物学原理,肿瘤局部控制率与照射剂量应该呈正相关,RTOG0617试验主要目的与前提设置明确,结果却恰好相反,似乎在预料之外。研究者认为可能有三个主要原因:一是较多地采用精度差的3DCRT而非IMRT技术;二是晚期病人放疗照射体积明显增大,心、肺、食管正常组织受照更多;三是高剂量组照射造成过度治疗,心、肺、食管毒副反应过大[1]。多变量比例风险模型(COX回归模型)分析,74Gy照射比60Gy照射Ⅲ级食管炎风险比是1.52(1.06~ 2.20),P=0.024,差异有统计学意义,心脏照射情况也如此。实际上,Bradley等[7]还报道,虽然RTOG0617试验高剂量组肿瘤大体靶区体积(gross target volume,GTV)与标准剂量组间美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)活动状态评分、肿瘤学本身因素、肿瘤大体靶区体积(gross target volume,GTV)、临床靶区体积(clinical target volume,CTV)、PTV、5Gy剂量照射体积(V5)等总体基线比较差异无统计学意义,但比较两组肺平均剂量(mean of lung dose,MLD)和20Gy剂量照射体积(V20)为18.9Gy比16.5Gy(P<0.000 1)和30.9%比28.7%(P=0.001 2)。高剂量组食管、心脏受照射剂量显著高于标准剂量组,提示以V5、V20和MLD三个独立影响因素评估放射治疗计划时,千万不要以为达到指南要求就行,应该追求更低的照射体积或剂量。其他研究也有质疑,如放化同期治疗中不同的化疗方案,如依托泊苷+卡铂、紫杉醇+卡铂、长春瑞滨+卡铂,选择不同方案或不同的时间密度效应会影响到治疗结果,RTOG 0617试验中的“紫杉醇+卡铂”化疗方案(2周方案同期,3周方案辅助)不能代表所有临床上使用的化疗方案[8-9]。
临床医师比较多的问题是,为什么RTOG 0617高剂量照射劣效?什么才是最佳剂量?还要不要高剂量照射……很多肿瘤本身因素和技术因素影响着OS和PFS等预后变化,即使RTOG0617试验结果可靠,结论也不一定可靠。Tucker等[10]报道,ECOG活动状态评分、GTV、MLD也都是LA-NSCLC的OS独立影响指标。RTOG0617试验得出LA-NSCLC化疗同期放射治疗“高剂量照射寿终正寝”的结论可能还需要商榷。肿瘤固有性质/微环境/不均一性等放射生物学行为、计划评价方法、分割方式、剂量效应、残留改变等一系列因素都值得深入探讨,特别不能排除放射治疗实际执行中的放射物理照射技术、条件和个体差异等关系。
2 放射物理与放疗技术影响着放射治疗中的照射剂量
现代精确放射治疗两大物理照射技术是3DCRT和IMRT,在此基础上发展形成图像引导放射治疗(image guide radiation therapy,IGRT)、四维放射治疗(4D-radiation therapy,4D-RT)和生物功能影像引导下的放射治疗(biology-image guided radiotherapy,BIGRT)等。临床实践中应用越来越普及,放射治疗进入更加精确的时代。
2.1 IGRT、4D-RT和BIGRT等放射治疗新技术可以更加精准照射肿瘤,保护重要器官
IGRT与4D-RT是在IMRT和3DCRT基础上,考虑到分次治疗间和治疗过程中的位移误差和解剖组织运动误差,如日常摆位误差、靶区形变、呼吸、胃肠蠕动、膀胱充盈等引起放疗剂量分布的变化和对治疗计划的影响,治疗前、治疗中利用影像对肿瘤及正常器官进行实时监控,照射野紧紧“追随”靶区的更加精确的放射治疗。照射包括了靶区和器官的自由运动、活动范围,即内靶区(internal target volume,ITV)情况,涉及放射治疗过程中的所有步骤:四维计算机断层摄影(4D-computed tomography,4D-CT)图像获取与治疗计划、摆位验证与修正、计划实施与修改、治疗控制与保证等各方面,将放疗过程中器官/靶区随时间运动的全部信息整合到放疗计划中,减少靶区不确定因素,提高放疗精确性。还可以用呼吸门控等外界设备控制患者呼吸或者屏气技术在某一呼吸时段照射。
而BIGRT是指在正电子发射体层摄影(position emission tomography,PET)、单光子发射体层摄影(single photon emission computed tomography,SPECT)、磁共振波谱(magnetic resonance spectrometry,MRS)等功能性影像指导下确定照射靶区,即功能和代谢的生物靶区(biological target volume,BTV),显示肿瘤的代谢、生化、生理、分子、基因型及表型特征。最广泛的是18F-脱氧葡萄糖(18F-FDG)肿瘤代谢显像和18F-FMISO(18F-Fluoromisonidazol)等硝基咪唑类肿瘤乏氧显像PET,能够确定肿瘤分期精确性和提高靶区勾画准确性,优化靶区剂量分布。ACRIN6668/RTOG0235试验研究表明,PET/CT融合检查对非小细胞肺癌临床分期与术后病理分期的符合率高,明显减小GTV并避免靶区遗漏,明显减小全肺体积受照和MLD,更好地保护周围正常肺组织[11]。Chao等[12]利用18F-FMISO乏氧显像PET/CT指导针对乏氧显像,简便、准确地反映肿瘤的乏氧状态及放疗中动态变化,确定乏氧靶区(hypoxic gross target volume,hGTV),制定调强放疗计划,乏氧肿瘤区剂量高达80Gy/35次,大体肿瘤区同时接受70Gy/35次,临床靶区剂量为60Gy,取得较为满意的临床疗效。
尽管没有严格界定各种先进技术的使用范围与适应证,普遍认为精度性方面IGRT、4D-RT和BIGRT明显优于IMRT,优于3DCRT技术。世界各国放疗机构主要根据病人和肿瘤情况、机构自身设备与技术条件等酌情使用。而“60Gy标准剂量”证据来源于3DCRT或IMRT,技术局限性突出。显然,利用IGRT、4D-RT和BIGRT等更精确技术放射治疗LA-NSCLC时,不能受到限制简单采用“60Gy标准剂量”。
2.2 靶区及危及器官勾画、质量控制与照射体积影响放疗疗效与副作用
现代精确放射治疗技术最大的好处是靶区的精细化。要求界定肿瘤病变与周围重要器官和正常组织,依据三维解剖结构、放射生物学性质等特点,勾画出照射部位和保护器官。这个过程就是所谓三维适形调强放疗靶区与危及器官的定义,是放疗科医生最主要的任务之一。放疗医师完成各个治疗靶区(GTV,CTV,PTV)和危及器官(organ at risk,OAR) 勾画,限定照射剂量及5Gy、10Gy、20Gy、40Gy的照射体积(V5、V10、V20、V40)和平均剂量耐受,交给剂量物理师应用放射物理学、放射生物学原理,利用电子计算机技术与系统,根据肿瘤组织和正常组织的照射剂量要求,设定主野、子野、照射方式等等目的函数做出放射治疗计划,与放疗医生共同评估。
但靶区的勾画与技术实施、质量控制很难明确规范和一致。2011年,美国密西根大学放射肿瘤医院孔凤鸣教授报道了一项研究,11个欧洲医生之间对非小细胞肺瘤的靶区勾画有极大不同[13],见图1;同时,美国的另外5项研究也显示医生勾画的非小细胞肺癌靶区最大与最小体积比(ratio of maximum to smallest volume)为1.35~9.34,差异显著,见表1。考虑到RTOG0617试验在美国和加拿大185个机构完成,544例合格病人入组,尽管试验标准剂量组与高剂量组PTV分别为494.8cm3和509.9cm3,95%处方剂量覆盖相似[7],靶区的勾画与技术实施、质控等却很难一致,势必影响两组之间的疗效与副作用。
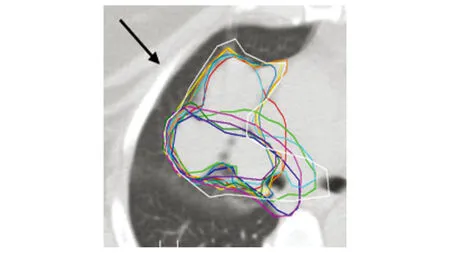
图1 欧洲不同放疗医生之间的GTV靶区定义的不同

表1 不同医生之间的GTV靶区定义差别
真实世界中的靶区勾画、放疗技术、质控等更是五花八门,因此,应该实事求是地评价RTOG0617试验结果,而不是简单使用“60Gy标准剂量”的结论。除了结合病人具体情况、分期等因素外,还要十分关注心、肺、食管等重要危及器官的最小剂量照射。
2.3 放疗技术与质量控制的经验是不容忽视的剂量决定因素
近些年,放射治疗学家更加关注心脏受照射剂量,特别是中央型肺癌,要求不断优化放疗计划,减少食管照射剂量和心脏与靶区的重叠照射部分,限制心脏受照射的低、中剂量,改善心脏放射损伤。Woodford等[14]研究表明,心脏V5和V30的改善情况与心脏与PTV重叠有显著关系,使用IMRT放疗技术对减少心受照体积和毒性优于3DCRT。PTV与心脏重叠8%时,IMRT技术对心脏V5和V30的改善较3DCRT分别提高12%和10%。
2016年美国JNatlCancerInst杂志分析了RTOG0617试验中1人~3人的低入组病人机构和4人~18人的高入组病人机构之间的OS、PFS、先进放疗技术、食管心脏剂量和严重副反应的差异。高入组病人机构均优于低入组病人机构,OS为26.2个月比19.8个月(P=0.002),PFS为11.4个月比9.7个月(P=0.04);放疗技术IMRT使用比例为54.0%比39.5%(P=0.002),食管平均照射剂量为26.1Gy比28.0Gy(P=0.03),心脏V5为38.2%比54.1%(P=0.006),V50为3.6%比 7.3%(P<0.001)[15]。说明试验中各入组中心的放疗技术、质控精细化与经验会影响到放射治疗OS、PFS等等方面的结果。
3 正确客观地理解精确放射治疗计划的评价工具
精确放射治疗计划的评价主要是通过三维模式下观察等剂量曲线对靶体积(target volume,TV)和正常组织范围的包绕情况,查看靶体积和OAR的剂量体积直方图(dose-volume histograms,DVH)。这些凭借剂量分布的手段只能根据以往对确切的肿瘤剂量以及正常组织剂量体积关系的临床经验,模糊地估计正常组织并发症概率(normal tissue complication probability,NTCP)和肿瘤控制概率(tumor control probability,TCP)。应用这些评价工具时,放射治疗医师要深入了解其原理、意义与缺陷。
DVH表示对感兴趣区域如靶区或OAR内的多少体积受到多高剂量照射,可以直接评估高剂量区与靶区的适合度。要结合计划的等剂量曲线分布综合评估,考虑并联器官或串型器官的耐受剂量特性,不能只关注靶区高剂量的适形程度,还要注意低剂量覆盖范围与OAR受照剂量及体积大小。预测正常组织并发症概率、放射损伤的Lyman-Kutchur-Burman(LKB)模型,以积分方式考察OAR群体和体积,即V5、V10、V20……Vx等有限区域的总体积,不能很好反映整体器官的照射情况,计算出来不同的Vx会得出矛盾的评价结果。如以肺V5为指标比较,放疗计划方案1优于方案2,而以肺V20为指标比较,放疗计划方案2优于方案1,放射治疗医师和物理师常常不知所措,提示目前共识的LKB模型与DVH评价工具也可能不一定能够准确预测放疗效果与OAR损伤。为此,笔者团队尝试借助DVH微分形式创建新工具基于线性-二次方程的定量模型,即Linear-Quadratic-Based Model (LQB)模型,补充LKB模型的不足。以45例放疗病人分别采用LQB模型和LKB模型设计优选90个计划(2个计划/人),两种模型优选计划的结果几乎一致(43/45=95.6%)[16-17]。DVH图V5、V10、V20、V30、V40、V50、MLD为独立评价指标优选计划,LKB模型各指标不一致时,应用LQB模型进行弥补。
所以,放射治疗医师不能简单以“指南”要求评价放疗计划优劣,认为计划照射剂量基本覆盖靶区95%或97%体积,肺V5、V10、V20、V30和MLD,心脏V30、V40和平均照射剂量等达到“指南”要求就同意计划,而不重视、不深究放射生物学损益原理,不反复取舍,精益求精。
4 结语
LA-NSCLC放化同期治疗中放疗“60Gy标准剂量”主要依据是RTOG0617前瞻、随机、多中心临床试验。该试验设计严谨科学,结果可靠,结论对LA-NSCLC放化同期剂量确定有较大指导意义,但造成74Gy高剂量照射组OS、PFS等劣效于60Gy标准剂量组结果的统计学差异受制因素太多。笔者[18]曾从放射生物学角度对LA-NSCLC的放射治疗剂量做了深入客观、辩证探讨。其他主要涉及放射治疗剂量的还有肿瘤学和放射技术两大因素,前者包括分期、体质营养状况、ECOG评分、化疗方案选择与时机[8-9,19]、表皮生长因子受体(epidermal growth factor receptor,EGFR)阳性高表达和靶向治疗[7,18-20]等都影响到OS、PFS。
放射治疗方面包括放疗技术、精细化靶区及OAR勾画、质控、评价方法、影像技术以及毒性与正常组织和全身耐受等等,都会影响到LA-NSCLC放射治疗剂量疗效和预后,应该追求越精细越好。随着IGRT、4D-RT和BIMRT逐渐普及,技术优于IMRT和3DCRT,RTOG0617试验得出的60Gy标准剂量结果就不能适用。每一个团队的设备先进性、人员素质、系统误差、摆位误差和剂量误差等等质量保证与控制水平差异很大,也将影响放疗结果。对于放射治疗毒性与耐受性、原则、公式等问题,应该更加注重原则而不是公式,V5、V10、V20、V30、MLD、MHD等要求越小越好,不能单纯追求达到“指南”规定就通过计划,在可能的情况下应该更精细。
最后提醒,放射治疗科医生不能只关注局部评价,要兼顾全身总剂量和全身耐受性问题。好的放疗科医生,一定是要追求非常精细、兼顾各个器官与要素平衡的计划。
