阳性养殖环境中鳜体内孔雀石绿及其代谢物残留消除规律
2019-10-23李丽春刘书贵尹怡郑光明马丽莎谢文平戴晓欣单奇赵城
李丽春,刘书贵,尹怡,郑光明,马丽莎,谢文平,戴晓欣,单奇,赵城
(中国水产科学研究院珠江水产研究所,农业部水产品质量安全风险评估实验室(广州),农业部休闲渔业重点实验室,广州 510380)
孔雀石绿(malachite green, MG),又名碱性绿,是一种人工合成的三苯基甲烷类工业染料,在水产养殖中常用于防治苗种、水产养殖过程、运输和销售等环节发生的水霉病、鳃霉病和小瓜虫病等[1-3]。其在生物体内可转化为隐色孔雀石绿(leucomalachite green,LMG), MG和LMG均具有高毒、高残留和“三致”(致癌、致畸和致突变)等副作用,二者在生物体内消除时间较长,会给水产品食用安全性带来严重隐患[4-6]。欧盟等国已将MG列为禁用药,原中国农业部于2002年将其列入《食品动物禁用的兽药及其它化合物清单》,禁止在水产养殖中使用MG[7-9]。但由于MG对水霉病有特效,暂无其他有效替代药,且其价格低廉,易获取,目前仍存在违规使用MG的现象[10-11]。目前,水产品中MG的残留测定方法主要有SDS增敏同步荧光测定[12]、超高效液相色谱-串联质谱法[13-15]、荧光标记磁分离免疫分析方法[16]和QuEChERS结合UPLC-MS/MS法[17-18]等。水产品中MG残留消除规律研究主要涉及的品种包括罗非鱼(Oreochromisniloticus)[19]、斑点叉尾鮰(Ietaluruspunetaus)[20]、虹鳟(Oncorhynchusmykiss)[21-22]和大菱鲆(Psettamaxima)[23]等。关于鳜(Sinipercachuatsi)中MG残留消除的研究亦有报道,如刘书贵等[24]和黄向荣等[25]研究了苗种期鳜体内MG的富集消除规律,发现MG及其代谢物LMG在鳜幼鱼体内的残留量分别于停药后37 d和55 d时低于判定值1.0 μg/kg;尹怡等[26]用1.0 mg /L MG溶液浸泡2 min后的鲮(Cirrhinusmolitorella)投喂鳜10 d,研究阳性饵料鱼投喂下鳜体内MG和LMG的残留消除规律,结果表明,养殖过程中,阳性饵料鱼体内的MG会通过食物链传递给鳜,且鳜体内LMG有检出;万译文等[27]采用5.0 mg/L MG浸泡体重为400 g左右的鳜2 h,研究鳜体内MG和LMG的组织分布和消除规律,发现养殖平均水温为25.6 ℃时,MG及其代谢物LMG在鳜各组织中消除至少需要680度日;李丽春等[28]模拟运输条件,研究了鳜体内MG和LMG残留消除规律,结果表明,在运输条件下鳜体内MG 和LMG 消解较慢,易造成鳜中MG 和LMG 超标。可见,目前鳜中MG残留消除规律的研究集中在苗种期、养殖过程和运输环节等,且大多在实验室内进行。鳜体内MG来源问题至今难以解决,养殖环境中的MG和LMG残留是否会造成鳜体内MG和LMG残留尚缺乏有效依据。针对上述问题,本研究通过模拟阳性养殖环境,开展鳜对MG和LMG富集消除规律研究,以期进一步探究阳性环境对鳜体内MG残留的影响,为鳜中MG残留全链条评估和残留关键控制节点的制定提供有效依据,同时为监管部门的管控提供技术支撑。
1 材料与方法
1.1 实验试剂
MG、LMG、氘代孔雀石绿(MG-D5)和氘代隐色孔雀石绿(LMG-D6)标准品(纯度≥98%)购于Dr. Ehrenstorfer (德国)。N-丙基乙二胺(PSA)和中性氧化铝购于CNW公司(美国)。氯化钠(分析纯)、无水硫酸镁(分析纯)以及无水乙酸铵(分析纯)购于国药集团化学试剂有限公司。
1.2 实验仪器
主要包括:Waters UPLC-Xevo TQD MS/MS(Waters公司,美国);AL204电子天平(梅特勒-托利多仪器(上海)有限公司);IKA MS3BS25漩涡振荡器(德国);KQ-250E医用超声清洗器(昆山市超声仪器有限公司);TDL-5-A离心机(上海安亭科学仪器厂);高速离心机(Sigma公司,德国);Organomation N-EVAP 112氮吹仪(美国);SIGMA 1-15小型台式高速离心机(Sigma公司,德国));0.22 μm微孔滤膜,玻璃管等。
1.3 实验方法
1.3.1 标准溶液配制
标准储备溶液:准确称取适量的MG、LMG、MG-D5和LMG-D6标准品,分别用乙腈配制成质量浓度为100 μg/mL的标准储备液。
混合标准中间溶液:分别移取上述MG和LMG标准储备液100 μL于100 mL容量瓶中,用乙腈定容至刻度,配制成质量浓度为100 ng/mL的混合标准中间溶液,于-18 ℃避光保存。
混合内标标准溶液:分别移取上述MG-D5和LMG-D6标准储备液100 μL于100 mL容量瓶中,用乙腈定容至刻度,配制成质量浓度为100 ng/mL的混合内标标准溶液,于-18 ℃避光保存。
混合标准工作溶液:根据需要,吸取一定量的混合标准中间溶液和混合内标标准溶液,用乙腈-5 mmol/L乙酸铵溶液(1∶1,V/V)稀释配制成适当浓度的混合标准工作溶液,使该混合标准工作溶液含中MG-D5和LMG-D6的质量浓度为5 ng/mL。
1.3.2 阳性养殖环境的制备
模拟MG阳性养殖环境,在面积约为1 400 m2、水深1.5 m的池塘中加入MG原药,使水体中MG质量浓度为0.2 mg/L,水体保持7 d,换水后测定其水体和沉积物中MG和LMG残留量,以此为阳性养殖环境。
1.3.3 模拟实验
于阳性养殖池塘中放入健康鳜苗(每尾体重约10~20 g,由广东省佛山市高明区鳜苗种生产农户提供)10 000尾,用阴性饵料鱼喂养,分别于放入鳜后0.1、1.0、2.0、5.0、10、15、20、30、40、50、70、90、120、150、180和210 d等时间点采样,检测鳜体内MG和LMG残留量,直至鳜体内无MG和LMG检出。每个采样点采集6个重复样品,每个样品不低于6尾,样品采集后去头、尾、内脏和骨,高速匀浆混匀后,于-20 ℃保存待测。
1.3.4 样品前处理
样品在室温下解冻后,准确称取(5.00±0.01) g于50 mL的聚丙烯离心管中,加入10 mL乙腈和100 ng/mL混合内标标准溶液50 μL,漩涡振荡2 min,加入2.0 g无水硫酸镁和1.0 g氯化钠,涡旋振荡1 min,超声波提取2 min,5 000 r/min离心5 min,将上清液全部转移至50 mL离心管,剩余残渣中加入10 mL乙腈,重复提取1次,合并上清液然后加入PSA 150 mg、中性氧化铝300 mg和无水硫酸镁300 mg,涡旋振荡30 s,5 000 r/min离心5 min,上清液转移至50 mL玻璃离心管中,40 ℃条件下氮气吹干,用 2 mL乙腈-5mmol/L乙酸铵(1∶1,V/V)复溶,过0.22 μm微孔滤膜,待UPLC-MS/MS测定。
1.3.5 色谱条件
色谱柱为Acquity UPLCBEH C18(2.1×100.0 mm i.d., 1.7 μm);流动相A为乙酸铵缓冲溶液(5 mmol/L, pH=4.5), 流动相B为乙腈,流速0.20 mL/min, 柱温35 ℃,进样量10 μL,梯度洗脱条件如表1。

表1 梯度洗脱Tab.1 Conditions of gradient elution
注:“φ”指体积分数,A为乙酸铵缓冲溶液(5 mmol/L, pH=4.5), B为乙腈。
1.3.6 质谱条件
采用电喷雾离子源正离子模式(ESI+);离子传输毛细管温度350 ℃;离子源温度150 ℃;去溶剂气流速650 L/h,锥孔流速50 L/h:扫描模式为多反应监测(MRM)。质谱参数见表2。

表2 质谱参数Tab.2 MRM parameters
注:“*”代表定量离子。
1.3.7 标准工作曲线的绘制
将1.3.1中的混合标准工作溶液在0.1~100.0 ng/mL的范围内配制成8个质量梯度浓度(0.1、1.0、2.0、5.0、10.0、20.0、50.0和100.0 ng/mL),每个浓度水平含5.0 ng/mL内标溶液,采用上述色谱和质谱条件进行测定,以目标物(MG和LMG)与内标物(MG-D5和LMG-D6)的峰面积之比为纵坐标Y,质量浓度为横坐标X绘制标准工作曲线。
1.3.8 回收率和精密度
称取5.00 g空白鳜肌肉样品,加入适量的混合标准工作溶液,使肌肉组织中MG和LMG的含量为0.3、1.5和5.0 μg/kg,按照上述前处理方法和色谱质谱条件检测,每个含量水平设置6个平行样品,测定其日内和日间回收率及相对标准偏差(RSD)。
2 结果与分析
2.1 线性范围、检出限和定量限
用空白样品提取液配制成质量浓度范围在0.1~100.0 ng/mL的基质混合标准溶液作为标准曲线(内标含量为5.0 ng/mL),按照上述色谱和质谱条件进行测定,绘制标准校准曲线并做线性回归分析。结果表明:在上述色谱质谱条件下可获得较好的基质标准溶液色谱图(图1),杂质干扰较少且信号响应较高;MG和LMG在0.1~100.0 ng/mL范围内有较好的线性关系,相关系数r大于0.999 8(图2)。
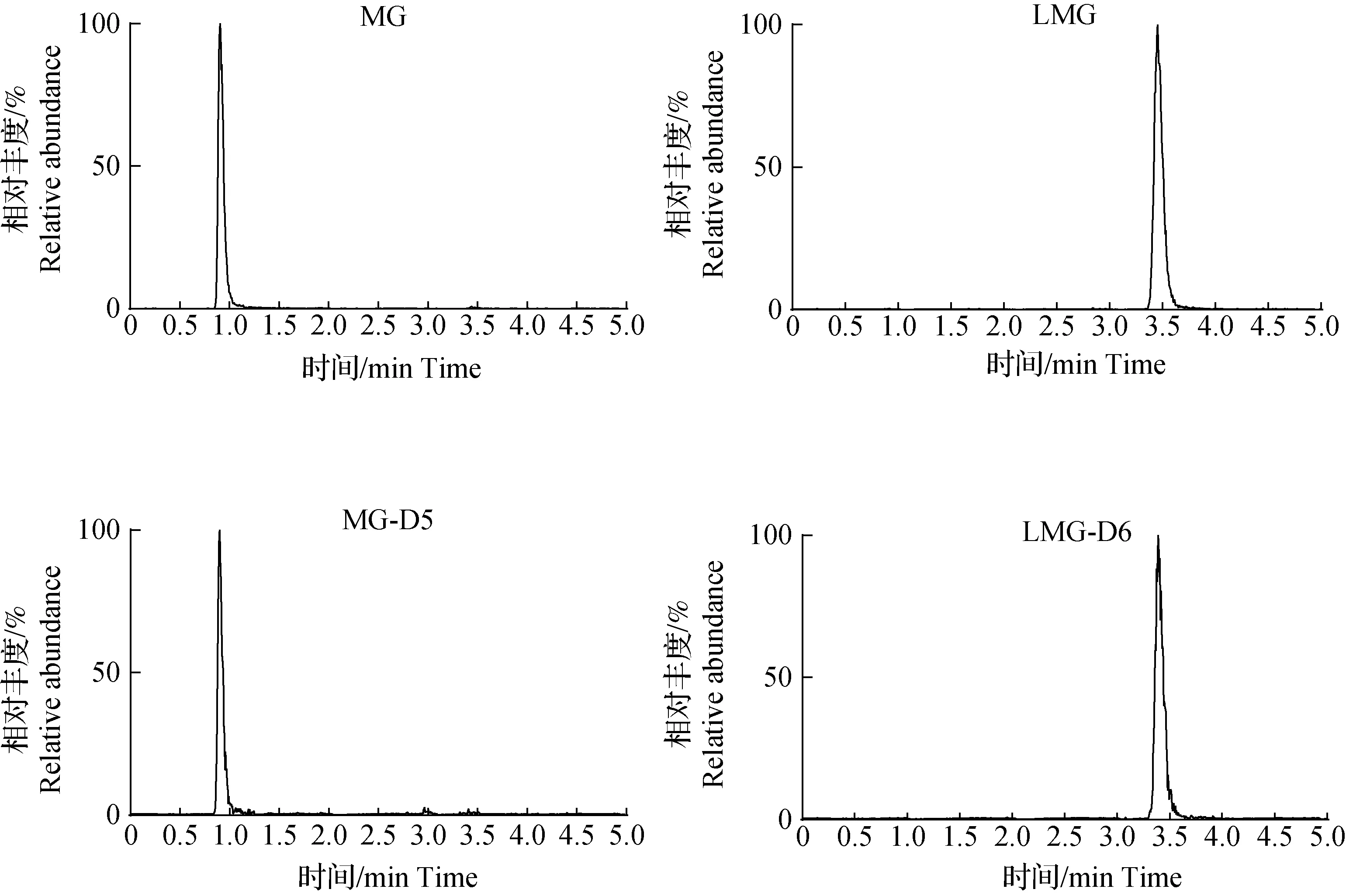
图1 MG和LMG基质标准溶液色谱图(10 ng·mL-1)Fig.1Chromatograms of MG and LMG standard solution (10 ng·mL-1)
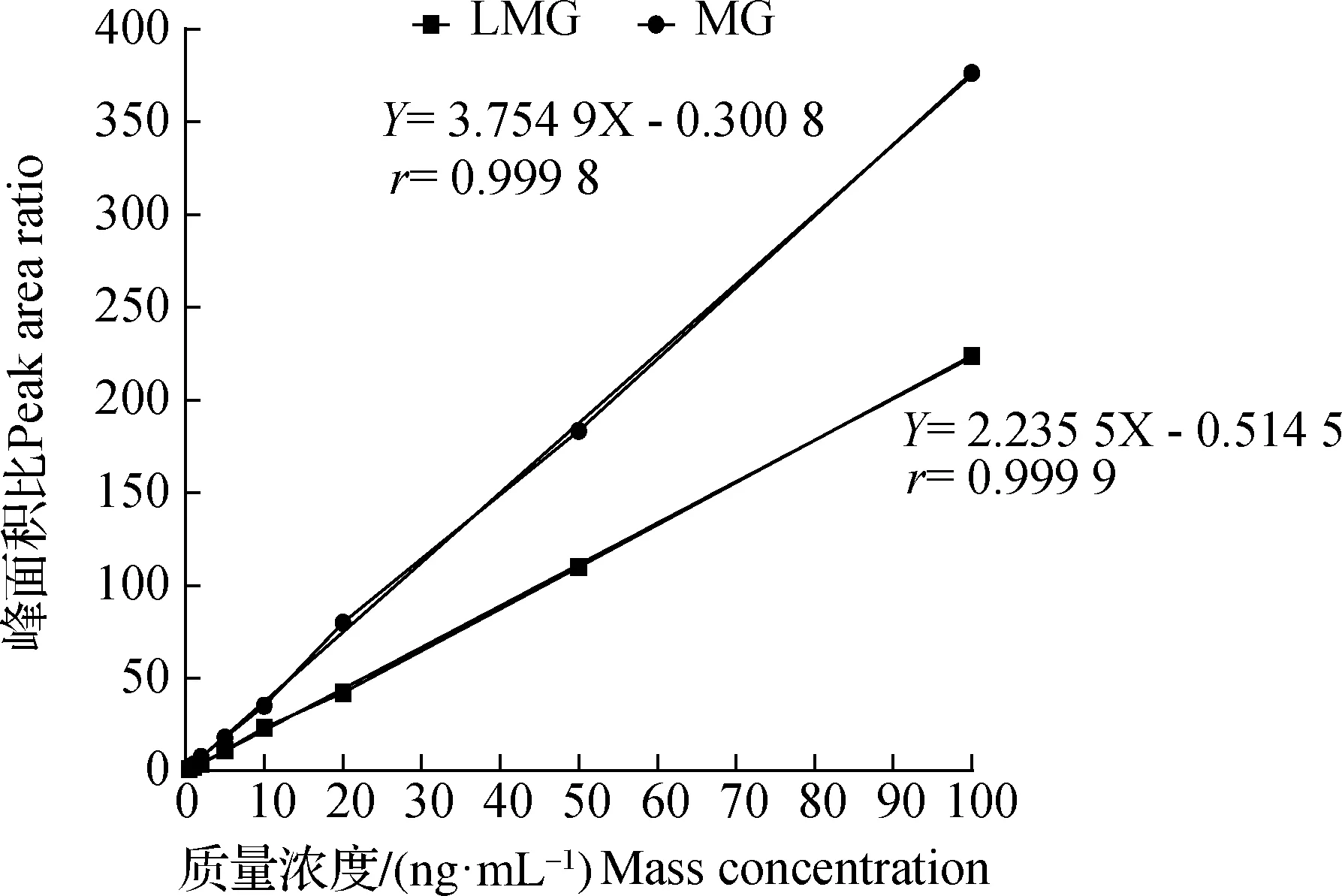
图2 MG和LMG标准曲线图Fig.2The standard curves of MG and LMG
在空白样品中添加MG和LMG,分别以信噪比(S/N)等于3和10计算检出限(LOD)和定量限(LOQ)。结果表明,MG和LMG的LOD均为0.10 μg/kg,LOQ均为0.30 μg/kg(表3)。
2.2 回收率和精密度
用不含MG和LMG的鳜为基质进行加标回收率和精密度实验,按照上述前处理和仪器条件进行测定。添加含量水平分别为0.3、1.5和5.0 μg/kg,每个添加水平进行6次重复实验,测定其回收率和精密度。结果表明,鳜肌肉中MG和LMG回收率范围为(96.40±5.34)%~(104.00±1.75)%和(92.40±2.54)%~(107.00±8.42)%,精密度范围为1.68%~5.54%和2.75%~7.87%(表4)。该方法回收率和精密度较好,适用于鳜体内MG和LMG残留量的测定。

表3 MG和LMG的校准曲线、相关系数、检出限和定量限Tab.3 The calibration curves, correlation coefficient, LOD and LOQ of MG and LMG

表4 方法回收率、日内精密度和日间精密度Tab.4 Recovery, within-day precision and inter-day precision of the method n=6
2.3 阳性环境中MG和LMG残留量
质量浓度为0.2 mg/L的MG池塘水体保持7 d后换水,采集水体和沉积物检测其MG和LMG残留量,结果见表5。结果表明,使用过0.2 mg/L MG的养殖池塘7d后换水后的水体中未检出MG和LMG,而沉积物中MG和LMG残留量分别为:(233.48±17.07)μg/kg和(73.38±5.98)μg/kg。
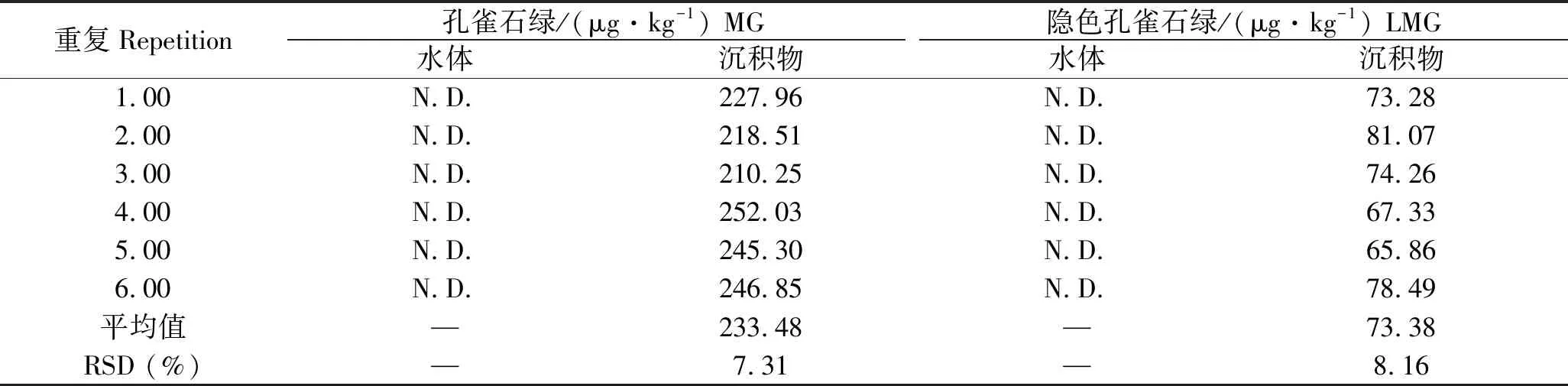
表5 阳性环境水体和沉积物中MG和LMG残留量Tab.5 The residues of MG and LMG in water and sediments
注: “N.D.”表示未检出(<0.1 μg·kg-1)。“—”表示不存在。下同。
2.4 阳性环境中鳜体内MG和LMG残留消除规律
模拟阳性养殖环境,研究鳜在阳性环境中对MG和LMG的富集消除规律。在MG阳性环境中放入鳜苗后,于不同时间点采样,测定其体内MG和LMG残留量,结果见表6和图3。
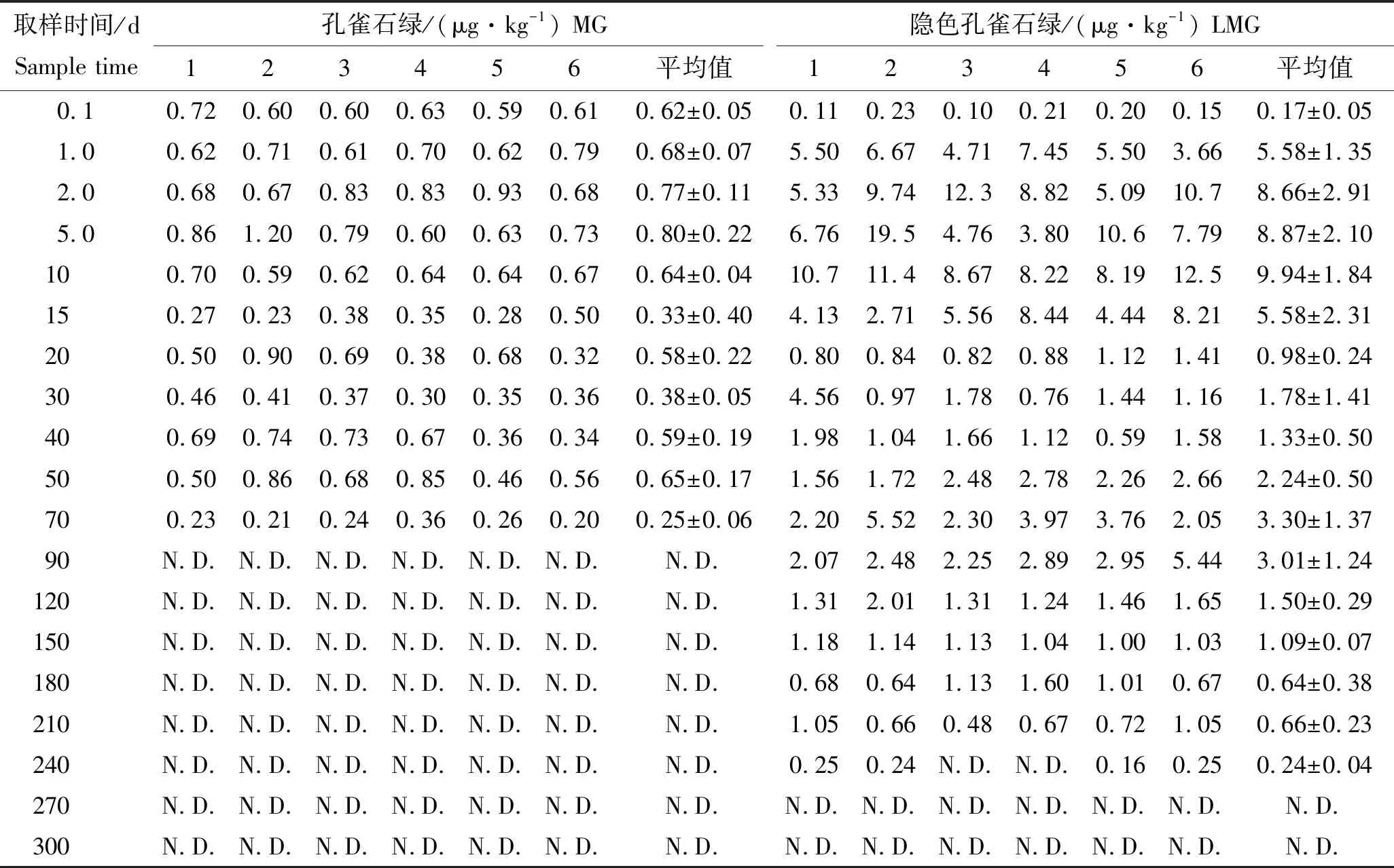
表6 鳜体内MG和LMG残留量Tab.6 The residues of MG and LMG in mandarin fish n=6
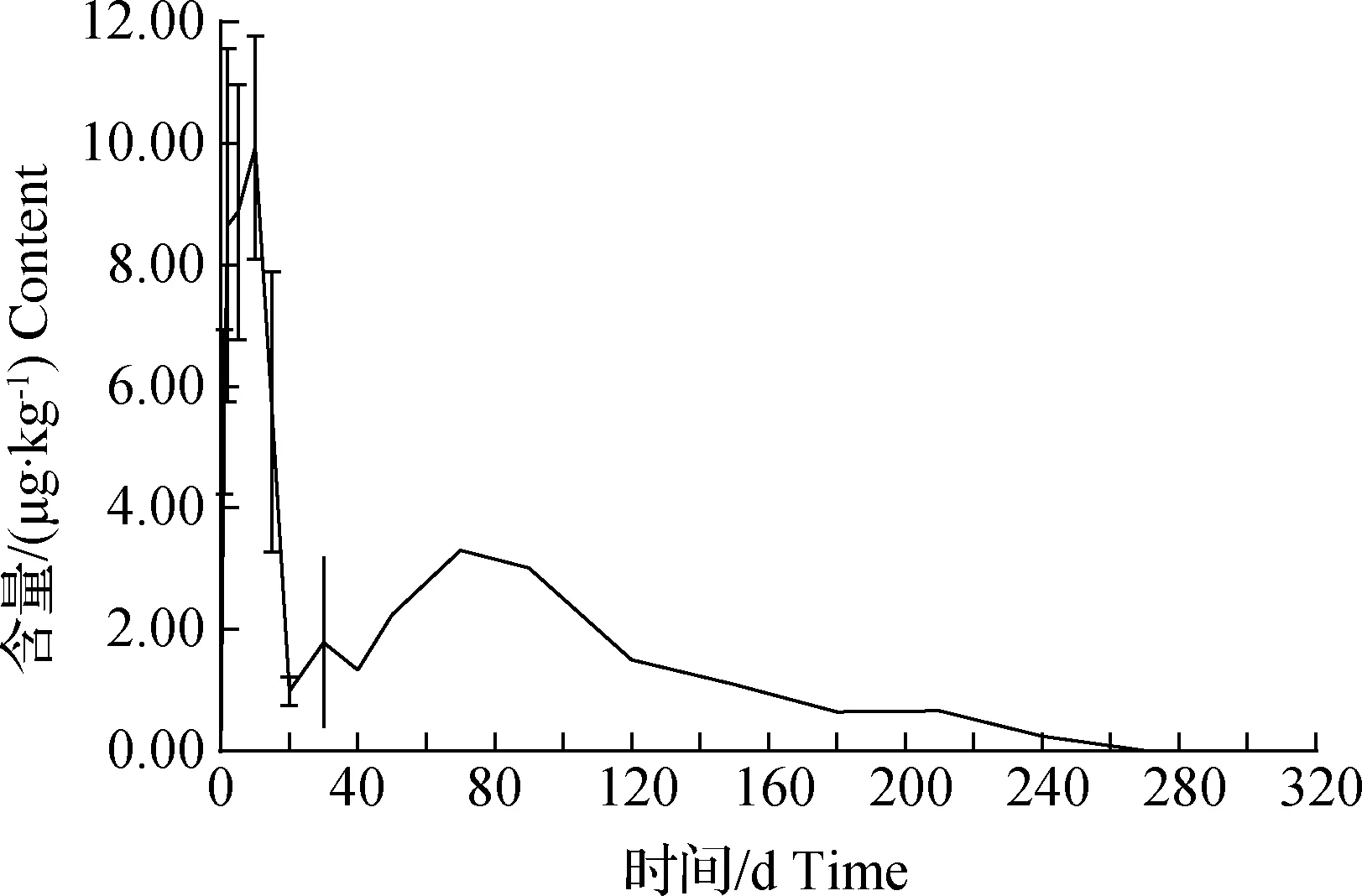
图3 鳜体内MG和LMG富集消除规律Fig.3The enrichment and elimination of MG and LMG in mandarin fish
从表6和图3可知,阳性养殖环境中,鳜体内MG残留量远远低于LMG残留量,其残留量始终保持在1.0 μg/kg以下,0~10 d鳜体内MG维持在0.62~0.80 μg/kg之间,随后呈波动式降低,70 d时达到定量限(0.30 μg/kg)以下,90 d时未检出。而LMG在鳜体内呈明显的先富集后消除的规律,LMG残留量在0.17~9.94 μg/kg之间,均在10 μg/kg以下。由上可见,阳性环境鳜体内MG残留以LMG为主。鳜养殖10 d时体内LMG达到最高水平9.94 μg/kg,随后呈波动式下降,在鳜体内消除较慢,第240天达到方法定量限以下,240 d以后未检出。鳜养殖周期一般为5~8个月,所以环境中残留的MG会造成鳜体内LMG的残留。建议鳜养殖选择没有MG和LMG残留的池塘养殖,并于养殖前对池塘底泥进行检测,确保底泥中不含有MG和LMG残留,且应适当延长鳜养殖周期,以保证鳜的食用安全性。
3 结论
本研究建立了鳜体内MG和LMG的QuEChERS结合超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法, MG和LMG在0.1~100.0 ng/mL范围内有较好的线性关系,相关系数r大于0.999 8。在空白样品中添加MG和LMG,分别以3倍和10倍信噪比(S/N)计算LOD和LOQ,得到MG和LMG在鳜肌肉中的LOD和LOQ分别为0.10 μg/kg和0.30 μg/kg。在添加水平分别为0.30、1.5和5.0 μg/kg时,鳜肌肉中MG和LMG回收率范围分别为(96.40±5.34)%~(104.00±1.75)%和(92.40±2.54)%~(107.00±8.42)%,精密度范围分别为1.68%~5.54%和2.75%~7.87%,回收率和精密度均符合残留检测要求。本方法操作简单、灵敏、快速且准确性较高,适用于水产品中MG 和LMG残留量测定。
本研究同时采用建立的残留分析方法研究了阳性养殖环境中鳜体内MG和LMG残留消除规律。结果表明,阳性养殖环境中(0.2 mg/L的MG浸泡7 d后换水),鳜体内MG残留以LMG为主,MG残留量较低且变化不明显,维持在1.0 μg/kg以下, 90 d后无检出。鳜体内的LMG残留量在10.0 μg/kg以下,呈现先增加后降低的趋势,10 d时达到最高水平9.94 μg/kg,随后呈波动式下降,至240 d未再检出,即其在鳜体内消除较慢。因此,养殖鳜时应检测养殖环境中MG和LMG的残留量,选择无残留的养殖环境(水体+底泥),并适当延长养殖周期,以确保上市鳜体内无MG和LMG残留,保障其食用安全性。
