池塘养殖模式下氟苯尼考及其代谢产物在斑点叉尾鮰体内及养殖环境中残留消除及迁移行为
2019-10-23刘崇万孟勇朱晓华李邦平夏丽萍徐志华沈美芳陈校辉边文冀
刘崇万,孟勇,朱晓华*,李邦平,夏丽萍,徐志华,沈美芳,陈校辉,边文冀
(1.江苏省淡水水产研究所/江苏省渔业产品质量安全重点实验室;2.江苏省水产质量检测中心/农业农村部渔业产品质量监督检验测试中心(南京):南京 210017)
近年来,中国水产养殖规模日益扩大,病原生物种类逐渐增多,养殖病害时常爆发,据不完全统计,中国水产养殖动物细菌性疾病占全部水生动物疾病种类的48.0%以上[1-2]。实际生产中,不科学用药或是滥用药物的现象仍时有发生,长此以往,一方面会导致细菌耐药性增强,另一方面会引起药物残留问题,影响水产品的食用安全性。研究发现,用药过程中部分抗生素会残留在水体和底泥中[3-4],残留药物可能会抑制环境中有益微生物的活性,刺激病原菌产生抗药性,进而对水生生态系统产生负面效应,且抗生素长期存在可直接影响饮用水的安全,并可能通过食物链传递最终影响人体健康[5]。
氟苯尼考(florfenicol, FF)是一种酰胺醇类抗菌药物[6],随着近年来氯霉素等抗菌药物被禁用以及病原菌对土霉素等药物的耐药性日益增强[7],FF以其广谱、高效且安全性较高的特点[8],已经被广泛应用于水产养殖业。研究发现,FF在动物体内不仅会以原形药物残留[9],而且能产生多种代谢产物[10],如氟苯尼考胺(florfenicol amine, FFA)等[6],目前,FF及FFA均已作为食品中FF的标示性残留物[11]。FF及其代谢产物对哺乳动物可能具有胚胎毒性等遗传毒性[12-14],农业部235号公告对FF的最高残留限量作出明确规定,要求在鱼的带皮肌肉中的残留限量不得超过1 000 μg/kg[15]。
目前,关于FF作用于水产品的药物残留方面的研究已有开展[16-18],但多数研究是在实验室条件下通过药浴或口灌等方式进行,与实际大池塘养殖模式存在较大差别,且关于FF在养殖环境中的残留降解规律及风险评估的研究也鲜有报道。基于此,本实验以近年来产业迅猛发展的斑点叉尾鮰(Letauruspunetaus,以下简称鮰)[16,19-20]作为研究对象,模拟实际池塘养殖模式中鱼体的生长环境、放养时间、养殖密度、饲料的投喂时间与重量及投喂方式等,研究FF及FFA在鮰体内及养殖环境中的残留分布规律,并对药物使用后在鱼体和环境中的迁移行为做初步探讨,以期为在水产养殖中科学、合理使用FF提供参考资料,同时为FF在水体环境中风险评估积累基础数据。
1 材料与方法
1.1 药品与试剂
主要包括:FF、FFA及其氘代物内标标准品(以下简称D5-CAP,纯度≥99.0%,Dr. Ehrenstorfer);FF原料药(纯度≥20.0%,浙江万方生物科技有限公司);乙酸乙酯(色谱纯,美国Tedia公司),正己烷(色谱纯,美国Tedia公司),氨水、甲醇及乙腈(色谱纯,美国Tedia公司)等;实验用水为Millipore系统纯化水。
1.2 仪器与设备
主要包括:高效液相串联质谱仪(Qtrap 4500,美国SCIEX公司);匀浆机(T18,德国IKA公司);高速冷冻离心机(AllegraTM,美国Beckman公司);浓缩工作站(Turbo Vap 瑞典Biotage公司);便携式采水器(WB-PM,北京普力特仪器有限公司);采泥器(ETC-200,金坛区白塔新宝仪器厂);冷冻干燥机(2.5L Triad 美国Labconco)。
1.3 实验设计
1.3.1 实验苗种及养殖条件
实验所用的鮰鱼苗,平均体重为(50.9± 13.4)g,由江苏省淡水水产研究所养殖基地提供。试验场所位于南通市海安华鎏水产有限公司养殖基地,选择四口标准化养殖池塘(2 300 m2/口,分别标记为S1、S2、S3及S4),放养密度按实际生产模式进行,每666.67 m2投放鱼苗1 000尾,配备专人管理及拌药。实验前鱼苗、饲料、水质及底泥经检测无FF及FFA残留,对拟拌喂的FF药品进行了纯度检测,结果符合要求。
1.3.2 给药方式
参考养殖户实际用药浓度,分别按1.25、2.50和5.00 g/kg 3个水平,称取FF药品,用适量蒸馏水配制成FF悬浊液,添加至空白饲料中,通过拌饵机搅拌均匀,每天每个试验池塘投喂FF阳性饲料4 kg,连续投喂5 d,S4作为空白对照池塘投喂未拌药饵料。从实验第6天开始,4组池塘全部投喂空白饲料。
1.3.3 样品采集
从开始投喂阳性饲料1 d后开始采集样品,采集时间点分别为1、2、3、4、5、6、7、8、11、14、30、60、90和170 d(实验期间池塘不换水),每组各取10尾健康鮰作为平行样,取肌肉,血液及肝脏组织。血液采取断尾法,移入采血管,肌肉和肝脏用匀浆机或剪刀制成均匀样品,装入样品袋,于-20 ℃贮存备检。池塘水用采水器采集,每个池塘每次在投喂点周边2 m内取2份样品,投喂后1 h采样,每个样至少500 mL。底泥采用采泥器采集,每个池塘每次取4份样品,其中在投喂点周边2 m内取2份样品,池塘周边随机取2份样品,投喂后1 h采样,每个样50 g左右。
1.4 样品前处理与检测分析
1.4.1 样品前处理方法
1)生物样品前处理方法[21]:称取适量样品(每次试验样品称样量根据药物的浓度变化进行适当调整,下同),加入50 μL D5-CAP溶液、15 mL乙酸乙酯、0.45 mL氨水以及5 g无水硫酸钠,涡旋混匀,8 000 r/min离心5 min,收集上层提取液,重复提取一次,合并提取液并混匀,在室温下用N2吹干。加入5 mL纯水,涡旋混匀,再加入5 mL正己烷,涡旋1 min,弃去上层,重复加正己烷,下清液转移至5 mL离心管,4 000 r/min离心15 min,下清液过0.2 μm滤膜,待测。
2)底泥样品前处理方法[21-22]:剔除小石块及植物残体等杂质,置于-20 ℃预冻后冻干处理,研磨,过250 μm孔径尼龙筛,置于-40 ℃存放。处理方法同生物样品。
3)池塘水样品前处理方法[21-22]:量取经0.45 μm玻璃纤维滤膜过滤的水样500 mL,加入50 μL内标溶液以及0.4 g EDTA。预先依次用6 mL甲醇、6 mL超纯水和6 mL磷酸盐缓冲液(pH=3)对HLB固相萃取柱淋洗活化。控制流速约为3~5 mL/min,将水样过HLB固相萃取柱,过柱完成后,用6 mL去离子水冲洗,抽真空5 min,最后以6 mL甲醇洗脱1次,收集洗脱液,并在室温下用N2吹干,用乙腈-0.1%甲酸(2∶8,V/V)混合液定容1 mL,涡旋振荡2~3 min,4 400 r/min离心10 min,上清液过0.22 μm滤膜,待测。
1.4.2 色谱方法
色谱柱为InfinityLab Poroshell 120 EC-C8(2.1 mm×100.0 mm,2.7 μm,美国Agilent公司);柱温30 ℃;流动相A为纯水,B为甲醇;进样量10 μL;流速0.2 mL/min;梯度洗脱程序见表1。
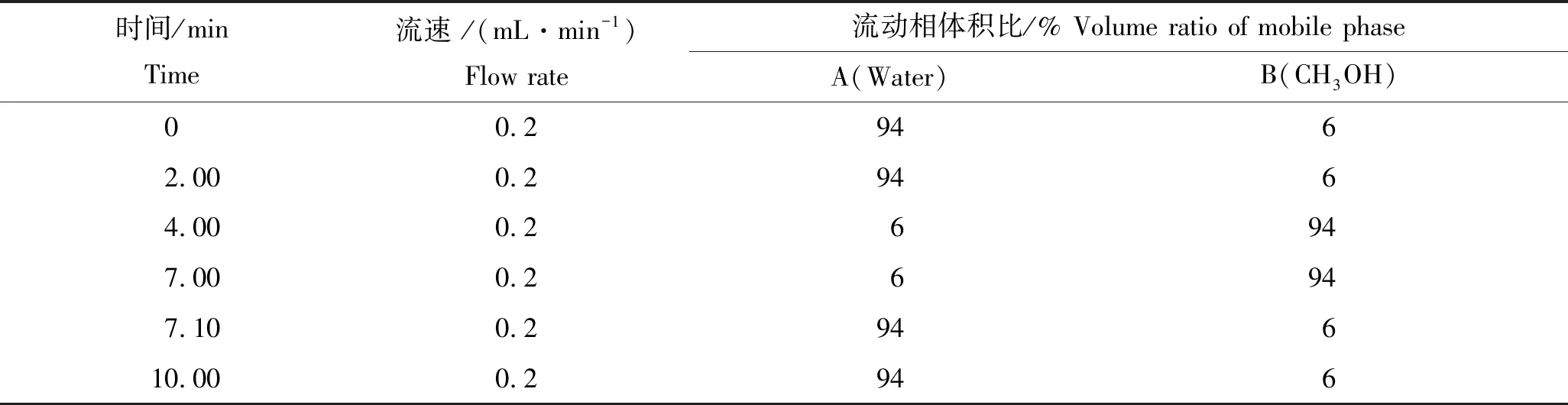
表1 梯度洗脱条件Tab.1 Conditions of gradient elution
1.4.3 质谱方法
FF及FFA检测均采用电喷雾离子源(ESI),扫描方式分别采用负离子及正离子模式;多反应监测(MRM)方式;离子化电压4 000 V;离子源温度450 ℃;气帘气25.0 psi;喷雾器45.0 psi;辅助加热器45.0 psi。多反应监测母离子、子离子、去簇电压和碰撞能量等质谱参数见表2。

表2 质谱参数Tab.2 MS parameters
注:标“*”为定量离子。
1.5 数据分析
采用Excel进行基础数据处理与分析,药-时曲线图采用SigmaPlot 11.0(Systat Software Inc.,San Jose,CA,USA)处理并绘制。
2 结果与分析
2.1 分析方法验证
由图1可见,在本实验条件下,可较好地分离FF及FFA,基线走动平稳,内源性杂质对实验测定无干扰,具有较好的特异性。FF和FFA保留时间分别为5.04 min和1.81 min,分离度良好。
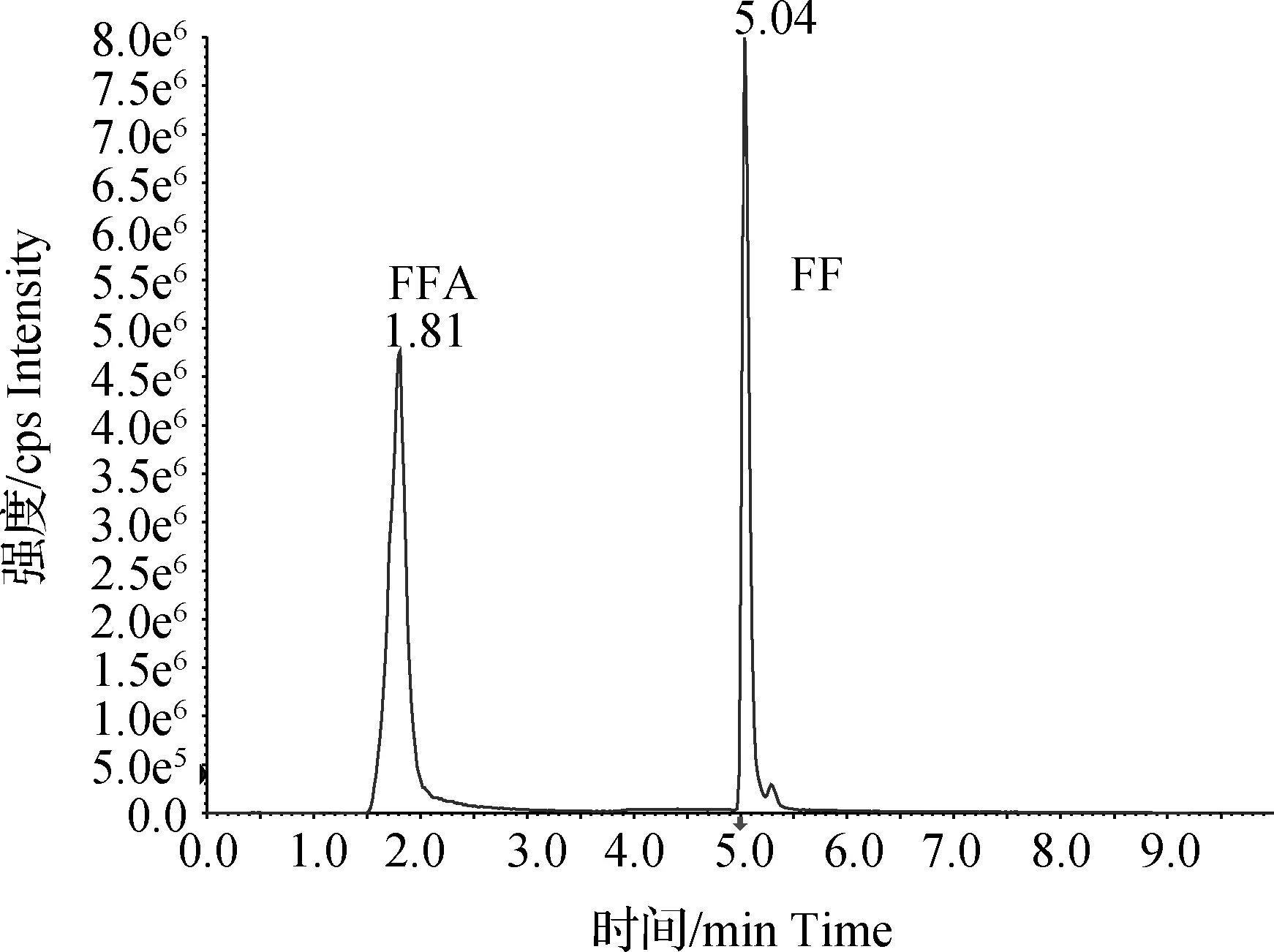
图1 氟苯尼考(FF)和氟苯尼考胺(FFA)标准色谱图Fig.1Chromatograms of FF and FFA
在质量浓度范围为1.0~500.0 ng/mL时,以各组分的内标与外标的峰面积比值为纵坐标,质量浓度为横坐标,进行线性回归分析,并随检测批次绘制标准曲线(鮰组织及底泥以提取液进行计算)。在一定加标水平下(池塘水为5.0~50.0 ng/mL,鮰组织及底泥为1.0~ 10.0 μg/kg)进行加标回收试验,每个质量浓度水平做3个平行试验,计算FF及FFA的加标回收率及相对标准偏差(RSD),以信噪比(S/N)为3时计算方法检出限(LOD)。具体结果如表3所示。
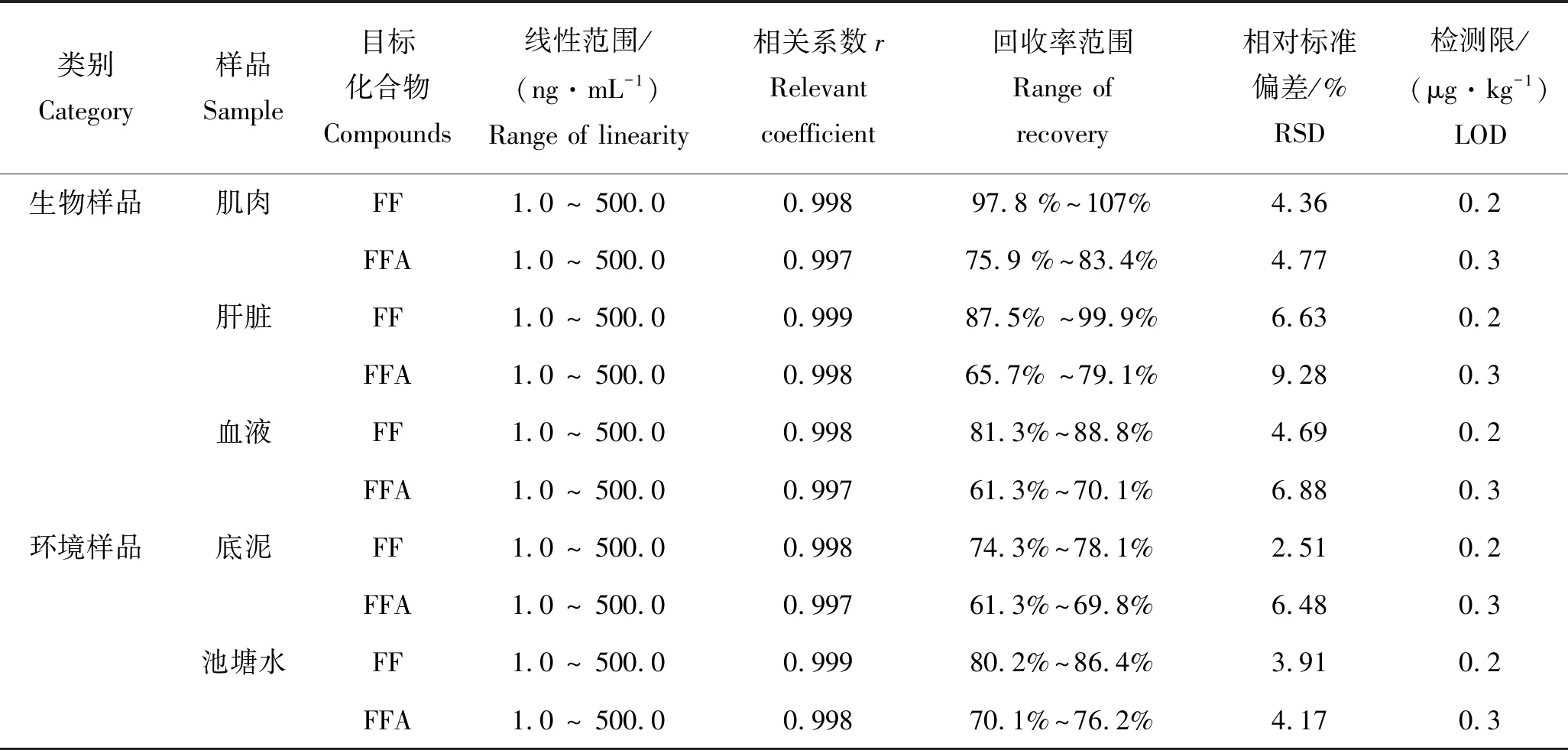
表3 氟苯尼考(FF)和氟苯尼考胺(FFA)测定的线性范围、相关系数、平均回收率、检测限Tab.3 The range of linearity, relevant coefficient, average recovery, RSD, LOD of FF and FFA n=3
结果表明,FF及FFA在1.0 ~ 500.0 ng/mL范围内线性关系良好,个别加标回收率偏低,但总体来看不同批次间回收率相对稳定,精密度均小于10%,该方法能够满足检测残留分析的要求。其中,环境样品整体回收率低于生物样品,这可能与环境介质中复杂成分引起的基质效应有关[22]。
2.2 生物样品中药物残留消除规律
2.2.1 不同剂量下FF药物残留消除规律
不同剂量条件下,肌肉、肝脏及血液中FF药物浓度变化如图2所示。
分析发现,肌肉中FF药物浓度在投喂阳性饲料第2天后开始迅速升高,而肝脏和血液中FF药物浓度在投喂当天即迅速上升,肌肉中低剂量组FF药物浓度(1.25 g/kg)在试验第6天达到峰值(7 274.14 ng/g),常规剂量组(2.50 g/kg,又称中剂量组)和高剂量组(5.00 g/kg)均在试验第5天达到峰值,分别为10 590.66 和16 495.36 ng/g;肝脏及血液中3个剂量组FF药物浓度均是在实验第4天达到峰值,低、中和高剂量组在肝脏中的峰值分别为28 955.91、25 305.42及41 667.64 ng/g,血液中分别为9 335.79、13 328.69及21 388.07 ng/g。
结果表明,肌肉、肝脏及血液中FF药物浓度在达到峰值后均呈现先急剧下降后持续下降但降速变缓的趋势。至30 d时,肝脏及血液中已检测不到残留,至60 d时肌肉中也已检测不到残留,此后持续监测到第170天,均检测不到残留。
另外,研究发现在试验第11天时,常规剂量条件下肝脏及高剂量条件下血液中FF药物浓度存在异常升高的过程,但是总体上不影响整体的规律变化,这可能是与采集的样本有关系。
2.2.2 不同剂量下FFA药物残留消除规律
不同剂量条件下,肌肉、肝脏及血液中FFA药物浓度变化如图3所示。
研究结果表明,肌肉和血液中低、中和高3个剂量组的FFA药物浓度在实验开始后持续上升,其中,肌肉中FFA药物浓度在实验第7天时达到峰值,分别为311.64、613.97及813.75 ng/g;血液中FFA药物浓度在实验第4天时达到峰值,分别为321.23、456.02及789.07 ng/g。此后,肌肉中FFA药物浓度呈现先急剧下降后持续下降但降速变缓的趋势,至170 d时,仍有少量残留;而血液中FFA药物浓度则在达到峰值后,急剧下降,在实验第6天时已检测不到,持续监测到实验170 d,均检测不到FFA残留。
分析肝脏中FFA药物浓度变化规律发现,在实验前期(1~3 d),3个组别的FFA药物浓度变化规律与肌肉和血液不一致。其中,低剂量组在前3天缓慢下降,第3~5天时快速上升达到峰值1 006.07 ng/g;常规剂量组在实验第1~2天时急剧上升,第3天时又快速下降,后至第5天时达到峰值1 869.97 ng/g;高剂量组在实验前两天先急剧下降,此后急剧上升,至实验第4天时达到峰值2 925.80 ng/g;3个剂量组至实验第60天时均已检测不到FFA残留。
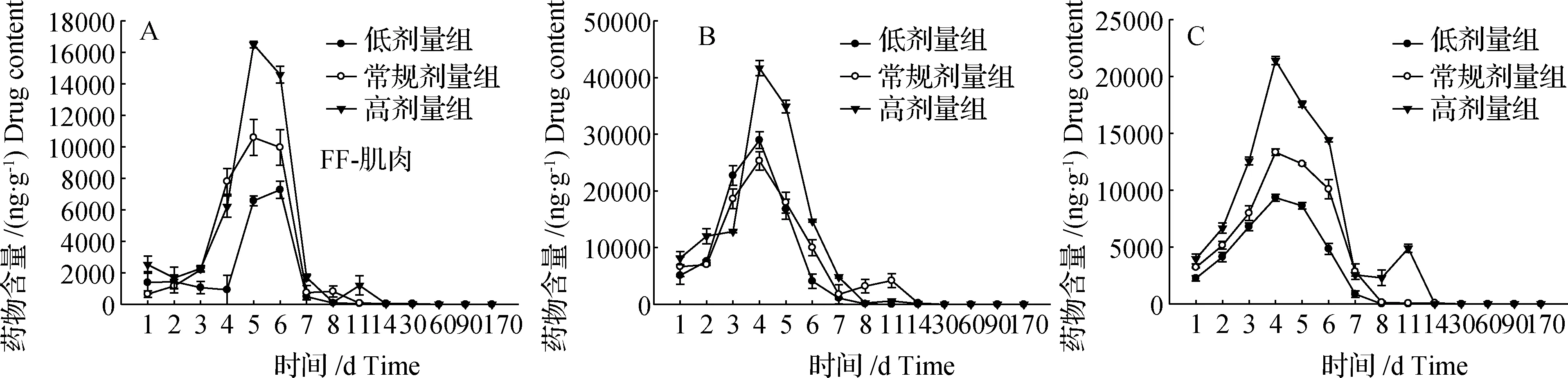
图2 不同剂量条件下鮰肌肉、肝脏及血液中氟苯尼考(FF)药时曲线(n=10)A:肌肉;B:肝脏;C:血液。Fig.2Content-time curve of FF at different doses in muscle、liver and blood(n=10)A: muscle FF; B: liver FF; C: blood FF.
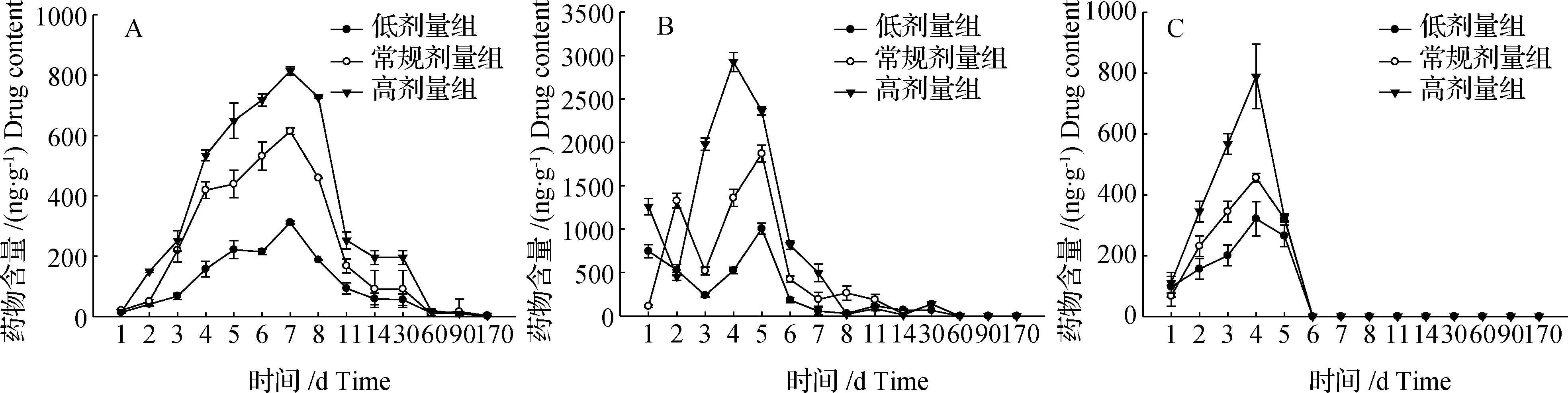
图3 不同剂量条件下鮰肌肉、肝脏及血液中氟苯尼考胺(FFA)药时曲线(n=10)A:肌肉;B:肝脏;C:血液。Fig.3Concentration-time curve of FFA at different doses in muscle、liver and blood (n=10)A: muscle FFA; B: liver FFA; C: blood FFA.
2.3 环境样品中药物残留消除规律
2.3.1 池塘水中FF及其代谢物FFA降解规律
不同剂量条件下,池塘水中FF及FFA药物浓度变化如图4所示。
图4结果表明,池塘水中FF药物含量在投喂阳性饲料第1天后开始迅速升高,低、中及高3个剂量组分别在实验第5、6和4天达到峰值,达峰浓度分别为1 661.98、3 533.47及4 138.98 ng/mL。从实验第90天至170天,共80天周期内,3个组别药物含量降到14.43、29.80及18.64 ng/mL。
与水中FF药物含量相比,整个实验过程中池塘水中FFA药物含量整体上都非常低,低、中、高3个组别药物含量同样分别在第5、6和4天达到峰值,分别仅为21.88、56.25及54.58 ng/mL,实验第90天至实验第170天,不同组别FFA药物含量均稳定在5 ng/mL以下。
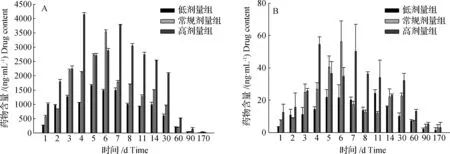
图4 不同剂量条件下池塘水中FF及FFA含量变化(n=2)A: 氟苯尼考;B: 氟苯尼考胺。Fig.4Concentration of FF and FFA at different doses in water(n=2)A: florfenicol(FF);B: florfeniocl amine(FFA).
2.3.2 底泥中FF及其代谢物FFA降解规律
不同剂量条件下,底泥中FF及FFA药物浓度变化如图5所示。
图5结果表明,低剂量组底泥中FF药物含量在整个实验周期内均维持在较低水平上,且达峰浓度明显低于常规剂量组和高剂量组。实验前4天,各组FF药物含量急剧升高,低、中、高3个剂量组均是在第5天达到峰值,分别为78.23、525.67及601.29 ng/g。此后,各组FF药物含量缓慢下降,至实验第170天时,已分别降到11.23、23.57及39.64 ng/g。
与底泥中FF药物含量相比,整个实验过程中底泥中FFA药物含量整体上都非常低,除了实验第4~6天,其他实验时间内,各组别FFA药物含量均维持在10.00 ng/g以下。3个组别药物含量均是在试验第5天达到峰值,分别仅为14.41、20.58及27.29 ng/g。
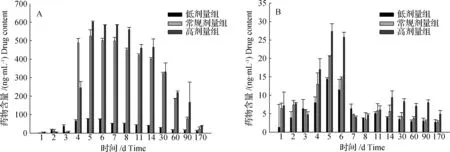
图5 不同剂量条件下底泥中FF及FFA含量变化(n=4)A: 氟苯尼考;B: 氟苯尼考胺。Fig.5 Concentration of FF and FFA at different doses in sediment(n=4)A: florfenicol(FF);B: florfeniocl amine(FFA).
2.4 FF在斑点叉尾鮰生物及环境样品中迁移行为分析
以常规剂量条件下计算肌肉、肝脏、血液、池塘水及底泥中FF药物残留量占总残留量的比值,以比较不同时间节点条件下药物残留迁移情况,具体结果如表4及图6所示。
结果表明,本实验所采集的生物样品(即肌肉、肝脏及血液)以及环境样品(池塘水及底泥)中FF药物总量在整个试验过程中呈现先急剧上升(实验第1~4天),后急剧下降(实验第4~7天),至实验第8天开始降速变缓,直至实验第170天时,仍有少量检出。
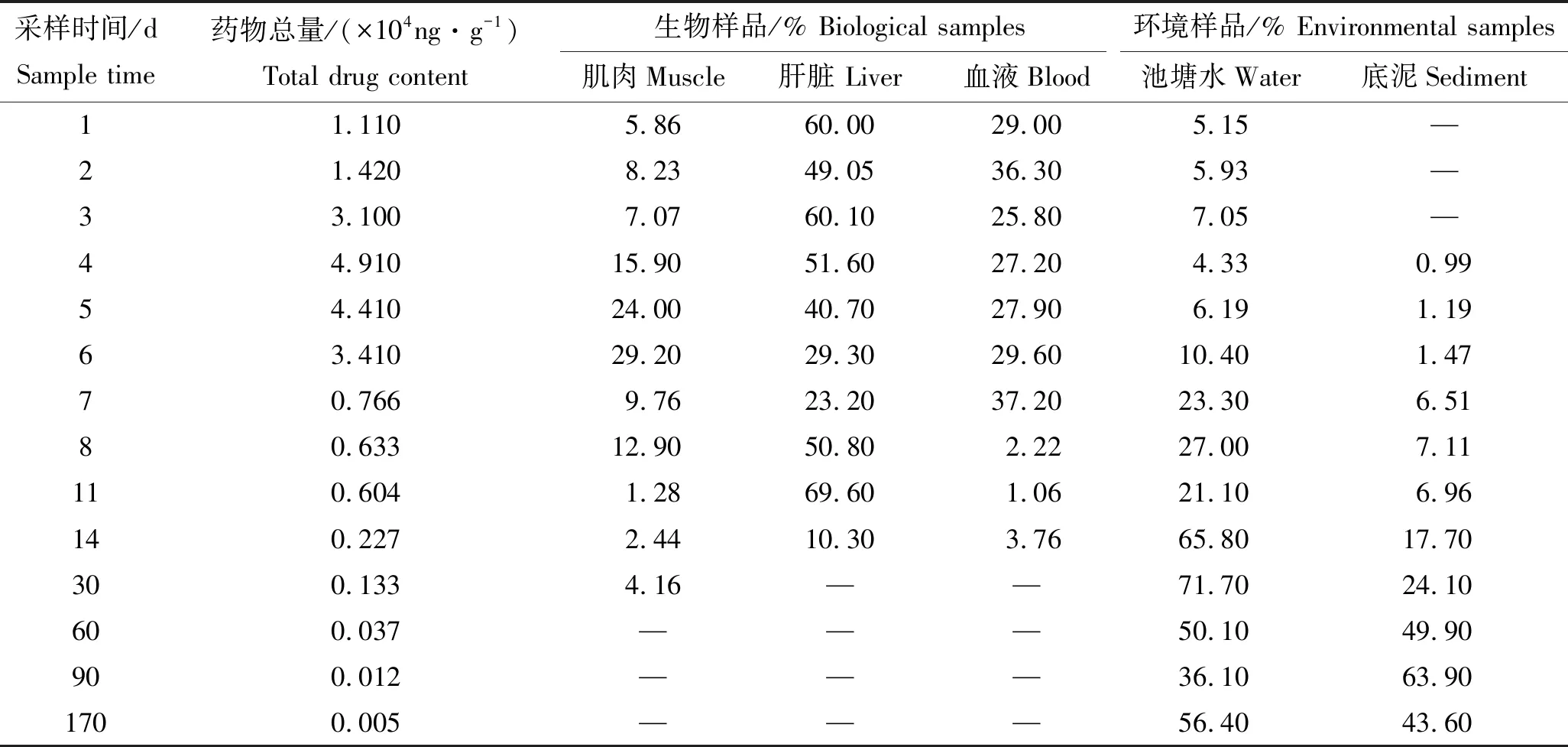
表4 常规剂量条件下FF在生物样品和环境样品中残留占比情况Tab.4 Proportion of FF at regular doses in biological samples or environmental samples
注:“—”示无相关数据。
本实验中以肌肉、肝脏和血液中的浓度之和代表被鱼类吸收的药物浓度,研究发现在实验周期内被鱼类吸收的FF药物比例范围为4.16%~94.90%,5天投喂期内,通过表4和图6可看出,肝脏中药物含量一直保持在40%以上,血液中药物含量相对稳定在30%左右,肌肉中药物含量一直比较低,实验第5天才缓慢升至24.0%。至实验第6天发现,肌肉、肝脏和血液中药物浓度趋于一致,此后,鱼体内药物含量占比逐步下降,而环境中药物含量占比逐步升高,直至实验第30天左右,生物样品中除了肌肉中仍有少量检出,而95.8%的总量检出均是集中于环境样品。此后,生物样品中药物已完全不检出,只有环境样品检出。
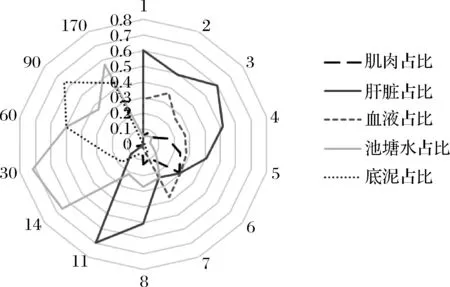
图6 常规剂量条件下药物含量占比雷达图Fig.6 Radar map of FF proportions at regular doses in different samples
3 讨论
3.1 药物在不同样品中的残留消除特征及分布规律
本研究采用的是拌喂投料的实际生产给药方式,研究发现不同剂量及组织中,FF及FFA的药物残留量与给药剂量呈正相关,FF达峰浓度显著高于FFA,说明FF在鮰体内主要是以原型的方式代谢消除。FF达峰时间为第4~6天,FFA达峰时间为第4~7天;肝脏和血液中FF在实验第30天时已检测不到残留,肌肉中FF在第60天检测不到残留,而FFA在肌肉中第170天仍有少量检出,在肝脏和血液中分别于实验的第60和6天检测不到残留;说明FF和FFA在肝脏和血液中代谢较快,在肌肉中代谢速度相对较慢,且FF在肝脏、血液和肌肉中的降解速度快于FFA。栾鹏等[23]采用15 mg/kg连续3次口灌给药方式(每次给药间隔24 h)研究FF及FFA在鲤(Cyprinus)体内的残留,发现肌肉及皮肤中FF含量均高于FFA,FF和FFA的达峰时间分别在连续给药后的2~4h和4 h,在给药后2 d左右FF及FFA药物浓度之和已降到1 mg/kg以下,而本实验中不同剂量组肌肉组织中降到这一浓度所用时间分别为7、11及14 d;秦方锦等[24]采用20 mg/kg口灌给药方式研究FF在大黄鱼(Pseudosciaenacrocea)体内的残留,发现给药后0.25 h肝脏中药物浓度即可达峰,但其后快速下降,至1 h仅残留7.3%;陈晋旭等[17]采用连续6 d药浴方式研究FF及FFA在小龙虾(Procambarusclarkii)体内的残留,FF及FFA分别在停药后2 h及4 h达到峰值,分别在14 d及7 d已检测不到残留,且FF残留量显著高于FFA。此外,杨倩等[25]研究了FF在黄颡鱼(Pelteobagrusfulvidraco)体内的残留;刘艳辉等[26]研究了15、45 mg/kg两种药物剂量对德国镜鲤(Cyprinuscarpiomirror)体内FF及FFA残留的影响,肌肉中FF分别在给药后6 h和12 h达峰,FFA均在72 h达峰,肝脏中FF分别在4 h和6 h达峰,而FFA在72 h和24 h达峰,不同组织中,FF在168h时已检测不到残留,FFA在264h基本检测不到残留。综上可见,不同给药方式下,药物的消除变化规律差异较大,主要体现在口灌给药及药浴等给药方式下,药物的达峰时间明显提前,消除速度较快,因为在这样的给药方式下,鱼体快速地吸收大量药物,而本实验采用的实际生产给药方式,由于水面面积较大,药物在投药的第一时间并不能保证被鱼体大量吸收,一部分已经散失在环境中造成达峰时间较晚。根据药物残留量及消除速率,建议以FF和FFA的浓度之和作为FF的标示残留物的指示值。
通过比较不同组织的残留情况发现,FF及FFA在鮰体内的分布是不均匀的,残留水平由高到低依次为肝脏、血液及肌肉,且在实验前期(前14天),肝脏中药物含量一直维持在较高水平上,说明FF药物首先在鱼肝脏中迅速富集,而肌肉中的药物含量一直低于同期的肝脏及血液含量水平,这可能是由于肌肉为低血流量器官,且其细胞膜通透性较差,致使药物不容易向肌肉组织转移[24]。刘永涛等[16]发现在鮰体内肝脏中药物残留量高于肌肉,郑重莺等[27]研究发现在南美白对虾(Penaeusvannamei)体内血液中药物残留量高于肌肉,而Samuelsen等[28]发现在单剂量管饲口服FF大西洋鳕(Gadusmorhua)的血浆中没有检测到FFA,分析可能是由于种属及给药方式不同所致。秦方锦等[24]研究发现给药后0.25 h肝脏中药物含量最高,说明FF首先在肝脏富集,这与本研究中结论一致,但在随后的0.25~1 h肝脏中药物浓度骤降,在2 h后,肝脏中FF又再次达峰,即肝脏中出现了药物重吸收现象,本研究中未出现这种现象,可能是由于不同动物种属、给药方式不同及取样时间密集程度差异所致。说明FF药物在不同水产物种体内分布及残留情况有所差异,受水产品种、给药方式等因素影响。
研究环境样品的药物残留情况发现,池塘水及底泥中FF检出含量均显著高于FFA,同时,池塘水中药物含量(尤其是FF)显著高于底泥中。以常规剂量为例,池塘水及底泥中FFA达峰浓度仅为FF达峰浓度的1.59%和3.92%,底泥中FF达峰浓度仅为池塘水中的14.88%,说明在环境中,FF也主要是以原型的方式降解消除,在拌药投喂的方式下,饵料中的FF首先大量散失在水体中,而大部分持续性地存在于水体中直至降解,底泥中FF检出量较少。近年来关于环境因子对FF降解影响的研究较少,户江涛等[29]研究发现温度(在10~30 ℃条件下,温度升高有利于FF在沉积物中的降解)、微生物及有机质(未处理沉积物中的降解半衰期为1.70 d,而灭菌和去除有机质后的半衰期分别为6.73,11.64 d)对FF降解影响显著;刘伟等[30]研究发现光照对于FF降解几乎没有影响;阮悦斐等[31]在对天津近郊地区淡水养殖水体的表层水和沉积物中典型抗生素的研究中指出沉积物中磺胺类抗生素检出含量显著高于水样,认为是底泥有机质对磺胺类抗生素有较强的吸附能力,造成了含量差异,且被沉积物吸附的抗生素随外部气温、水温的变化,可能会从沉积物中解析释放到水体中,造成水体中抗生素含量升高。聂湘平等[32]在珠三角淡水养殖水体底泥中检出有喹诺酮类抗生素残留,但是在对应的表层水中并未检出。综上,说明本研究中所得结果可能是和环境因子(光照、微生物及有机质等)有关,杨卫民等[33]指出环境因子不同,抗生素降解也会有所差异,因此,关于FF及其代谢物FFA在环境中迁移行为的具体机理仍然需要更详细的研究。
3.2 合理给药剂量及休药期探讨
研究发现FF及FFA的药物残留量与给药剂量呈正相关,同时给药剂量的大小对于药物的残留时间也有一定的影响。这表明,在日常养殖过程中,如不遵守用药限量规定,很可能引发药物残留问题。FF对常见病原菌的体外最低抑菌浓度MIC(μg/mL)一般为0.3~1.6[15],而抗菌药物给药剂量是否有效取决于Cmax/MIC能否达到10[34],本研究中低剂量组FF在肝脏、肌肉和血液中Cmax分别为28 955.91、7 274.14、9 335.79 ng/g,据此计算Cmax/MIC值分别在18.1~96.5、4.55~24.30、5.83~31.10范围内,说明本实验条件下低剂量1.25 g/kg难以判断是否有效,计算常规剂量组及高剂量组的Cmax/MIC均在10以上,说明本实验条件下的2.50 g/kg和5.00 g/kg两个剂量是有效的。但是需要说明的是,这是通过理论推算而得的结论,实际生产中还需根据鱼病的爆发程度,多次验证得出最低有效剂量,即药物剂量与药效学的关系还需结合实际生产进一步研究。
渔药休药期通常是根据国家规定的最大残留限量(MRL)及药物在食用组织中的消除速率来确定。农业农村部规定了鱼类带皮肌肉的残留限量为1 mg/kg,ADI为0~3 μg/(kg·d)[34],据此计算,本实验条件下,三个剂量水平下的理论休药期分别为3、6及9 d,说明了用药量的增加,休药期也要相应延长。根据刘永涛等[16]研究结论推算,并结合本实验期间平均环境温度(23 ℃),建议实际生产中,不同剂量条件下休药期分别设为161、230及345 度日。
3.3 氟苯尼考药物使用对于生态环境的影响
徐永建等[4]研究指出抗生素的大量使用容易造成沉积物中生物群落量和质的改变,抑制沉积物的降解速率。李兆新等[35]指出进入环境中的抗生素可能使养殖环境中的病菌产生耐药性,破坏水产养殖动物的微生态平衡。因此,在使用FF药物时,除了关注药物对水产品的影响及残留代谢状况,也不可忽视FF药物使用对于生态环境的潜在影响和危害。
Samueisen等[36]及陈清华[37]均指出水产养殖中使用的抗生素仅有20%~30%被鱼类吸收,其他大部分抗生素则流失在水体中,或是随悬浮物沉降汇集于底泥中。本研究发现在实验周期内被鱼类吸收的FF药物比例范围为4.16%~94.9%,且在实验前5天均维持在90.0%以上,恰好实验前5天时用阳性饲料投喂鱼苗,说明实验投喂期内投喂的饲料中的药物被鱼体大量吸收,投喂结束后,随着实验时间的延长,鱼体中药物浓度占比逐渐减小,而池塘水和底泥中的药物含量逐渐增加,可能是由于部分药物随鱼体粪便散失于环境之中以及药物降解所致。
本实验结果证实了FF药物用于鮰养殖过程中时,未被鱼体本身食用的药物会散失到环境中,尤其是池塘水中,在实验第170天时仍有少量检出。因此在实际养殖过程中:不建议渔民频繁使用药物;当年度养殖结束时,根据实际情况采取活性炭吸附[38]、彻底清塘暴晒[39]等环境净化措施;养殖池塘在需要外来水源补充时,需明确外来水源是否为药物污染源,使用过药物的池塘水也不应随意或短时间内排泄到其他池塘;渔业主管部门应定期监控养殖区域内环境中药物残留情况,以最大程度消除药物残留对环境的影响,从而避免对生态环境及人体健康形成长期潜在危害。
3.4 工作展望
本实验选择了FFA作为FF的主要代谢产物进行研究,但实际上氟苯尼考在代谢过程中是否还存在其他产物、FF在鱼体中的代谢途径及其在环境中的转化机制等问题都尚需进一步研究。拟结合高分辨液质联用仪筛查FF在鱼体代谢过程中的代谢产物种类,梳理各代谢产物是否存在相互关系及具体降解消除情况,以进一步摸清FF的代谢机制及规律,为指导科学用药提供理论支撑。
本研究初步分析了药物在环境中残留规律及在水产品与环境中迁移行为,但未涉及迁移机理的研究,比如本研究中发现底泥中药物含量明显低于水体中,究竟是因为外部环境因素如环境的温度及水温[29]、光照[40]等影响了水体与沉积物的迁移,还是因为沉积物中药物解析又释放到水体中,有待进一步深入研究FF的环境生态效应,如药物在环境中降解及吸附行为、不同参数变化对于药物迁移的影响及药物使用对微生物群落的影响等,进而了解FF药物的使用在环境中的迁移规律,探究其环境风险水平。
考虑到药物在不同水产物种间的残留规律及代谢机制可能会有所区别,且本研究中仅选择了肝脏、肌肉及血液进行组织分布研究,后期还需针对不同水产物种并纳入皮肤、肾脏等更多的组织器官进行全面深入的研究,以进一步掌握FF在不同水产品中分布及消除数据。
