血清1,3-β-D-葡聚糖、半乳甘露聚糖检测联合胸部CT检查对COPD合并侵袭性肺曲霉菌感染的诊断价值
2019-10-22徐瑞娥李凤珍邵建平潘秋玉董卫平
徐瑞娥,李凤珍,邵建平,潘秋玉,董卫平
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是老年人呼吸系统的常见病和高发病。由于患者存在慢性缺氧,且长期使用抗生素和糖皮质激素治疗,导致患者免疫力下降,很容易合并侵袭性肺曲霉菌(invasive pulmonary aspergillosis,IPA)感染[1-2]。COPD合并IPA的患者如果不及时治疗,预后极差,因此早期诊断COPD合并IPA并采取有效的抗真菌治疗具有十分重要的意义。由于IPA感染无特异性的临床表现,痰培养标本时间长且阳性率低,肺穿刺活检和纤维支气管镜肺泡灌洗等有创检查会造成一定的创伤,限制了其临床应用。真菌特异性的抗原检测目前已应用于临床,特别是血清1,3-β-D-葡聚糖(G)试验和半乳甘露聚糖(GM)试验在血液病、粒细胞缺乏、免疫抑制等患者合并IPA的诊断中起到了重要的指导作用[3]。作为一种无创诊断方法,胸部CT是检测肺部真菌感染的重要诊断方法[4]。但这3种方法对COPD合并IPA诊断的价值尚不明确,故本研究对COPD合并IPA患者同时进行G试验、GM试验和胸部CT检查,评价单独或联合这3种方法在诊断COPD合并IPA中的作用,报道如下。
1 资料与方法
1.1 临床资料 收集2017年1月—2018年12月山东省菏泽市立医院呼吸科及重症监护室诊治COPD患者95例的临床资料,其中单纯COPD患者46例作为单纯COPD组,男26例,女20例,年龄33~70(61.6±6.6)岁;体质量指数(BMI)17.1~25.3(21.1±2.1)kg/m2;COPD病程4~21(8.6±3.7)年;临床分级,Ⅱ级21例,Ⅲ级25例;合并高血压12例,糖尿病10例,冠心病8例;吸烟史30例。 COPD合并IPA患者49例作为合并IPA组,男25例,女24例,年龄36~72(62.3±5.2)岁;BMI 16.7~24.6(21.5±2.2)kg/m2;COPD病程5~19(8.1±3.5)年;临床分级,Ⅱ级19例,Ⅲ级30例;合并高血压18例,糖尿病15例,冠心病12例;吸烟史33例。2组患者性别、年龄、BMI、COPD病程、临床分级、合并基础疾病、吸烟史等比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患者及家属同意并签署知情同意书。
1.2 选择标准 (1)诊断标准: COPD的诊断参照中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的“慢性阻塞性肺疾病诊治指南”[5]。侵袭性肺曲霉病诊断参考欧洲癌症治疗组织真菌病研究组制定的诊断标准[6],同时参考中国侵袭性肺部真菌感染工作组制定的“侵袭性肺部真菌感染的诊断标准与治疗原则”,诊断涵盖确诊、临床诊断和拟诊断3个诊断层次[7-8],本研究将确诊、临床诊断和拟诊断的患者归入合并IPA组(包括确诊15例、临床诊断23例、拟诊11例)。(2)排除标准:既往有粒细胞缺乏、慢性心功能不全、器官移植、肿瘤及其他慢性基础性疾病,艾滋病、肝炎等慢性感染疾病,长期反复应用广谱抗生素及糖皮质激素患者。
1.3 试验/检查方法
1.3.1 G试验[9]: 采取患者空腹静脉血5 ml,以3 000 r/min的速度离心10 min,收集上层血清,取5 μl加入到微孔板。每孔再加入血清预处理液20 μl,37℃孵育10 min。各标准品孔中分别加入浓度为100 pg/ml、50 pg/ml、25 pg/ml、12.5 pg/ml、6.25 pg/ml和0 pg/ml 的标准品各25 μl,每孔再加入鳌试剂100 μl。利用自动定量酶标仪(Elx800,美国Biotek公司生产)(405/490 nm 波长)读数。检测值>95 pg/ml为阳性试验结果。严格按比色测定法试剂盒(丹娜公司生产)说明书操作。
1.3.2 GM试验[9]:将标准血清300 μl、阴性对照血清、患者待检血清与血清处理液100 μl振荡混匀,100℃下孵育3 min ,常温离心取上清液。将抗GM单克隆抗体50 μl加入微孔板内包被。取已制备的上清液 50 μl 于微孔板内,密封微孔板,37℃孵育90 min,利用洗液冲洗微孔板 5次 ,然后加入含四甲基联苯胺的底物 200 μl ,室温避光孵育30 min ,加入反应终止液 100 μl ,利用酶标仪读取吸光度值。血清测量<0.5为阴性;非同日连续样本(至少2次)≥0.5或单次测量值≥0.85为阳性。按ELISA试剂盒(丹娜公司生产) 说明书进行检测。
1.3.3 胸部CT检查: 患者进行胸部螺旋CT检查,1周后复查。分别由2位经验丰富的影像学医师进行读片,记录肺部病变特征及性质。以晕征、空气新月征和肺部实变区内空洞的出现作为曲霉菌肺部感染的CT检测特征性改变;同时记录肺部其他影像学改变,如楔形浸润影、小结节、低密度影和磨玻璃影等。
1.3.4 联合检测模式: 采用并联试验模式。联合试验中,G试验、GM试验和胸部CT检测中有1项结果为阳性则认定联合试验结果为阳性,3个指标同时为阴性则联合试验结果为阴性。
1.4 统计学方法 采用 SPSS 19.0软件对数据进行统计处理。计数资料以频数或率(%)表示,组间比较采用χ2检验。有关指标的诊断价值分析采用ROC曲线分析法。P<0.05为差异有统计学意义。
2 结 果
2.1 2组血清G试验、GM试验及CT检测IPA阳性率比较 合并IPA组患者血清G试验、GM试验检测阳性率分别为 26.5% 和53.1%,明显高于单纯COPD组患者的8.7%和17.4%,差异有统计学意义(P<0.05);合并IPA组患者胸部CT检查阳性率34.7%,明显高于单纯COPD组患者的10.9%,差异有统计学意义(P<0.01),见表1。
2.2 2组胸部CT检测肺部病变特征及性质比较 合并IPA组患者出现晕征、新月征和实变区的空洞等IPA特征性CT征象改变(图1)17 例(34.7%),明显高于单纯COPD组患者的5例(10.9%),差异有统计学意义(χ2=7.568,P<0.01);合并IPA组患者检出楔形浸润影、肺部小结节、低密度影、磨玻璃影等其他征象22例(44.9%), 明显高于单纯COPD组患者的11例(23.9%),差异有统计学意义(χ2=4.609,P<0.05),见表2。
2.3 G试验、GM试验、胸部CT检查及联合诊断价值比较 3种方法单独检测的敏感度均很低,特异度均较高,且AUC均在0.7以下。三者中两两比较,GM试验的敏感度较好,特异度三者相近,差异均无统计学意义(P>0.05);3种方法联合检测,较单独G试验、GM试验及CT检查的敏感度要高(χ2=23.5、5.4、16.5,P均<0.05),但特异度略低,差异均无统计学意义(P>0.05),且AUC明显提升为0.780,见表3,图2。
3 讨 论
曲霉菌为条件性致病真菌,该菌主要通过空气传播,可通过呼吸进入气道内定植,当患者的免疫功能急剧下降时,该菌可引起急性的继发性感染。侵袭性曲霉菌感染的患者一旦发病,病情发展非常迅速,预后极差。因此,该病已成为临床关注的焦点。近年来 COPD合并真菌感染,特别是曲霉菌感染的患者日渐增多。相关研究显示,由于COPD患者肺部结构受到炎性反应的长期破坏,支气管黏膜的纤毛清除异物的能力下降,从而利于曲霉菌在肺部定植[10]。并且,部分患者需要长期使用抗生素、糖皮质激素、无创或有创呼吸支持治疗,这些因素导致机体抵抗力下降时,极易诱发曲霉菌感染[11]。COPD患者合并IPA感染后临床表现的特异性相对不强,临床早期诊断存在一定困难,不能及时治疗,病死率较高。

表1 2组患者G试验、GM试验、胸部CT检测IPA阳性率比较 [例(%)]

表2 2组患者CT检测IPA肺部病变特征及性质比较 [例(%)]
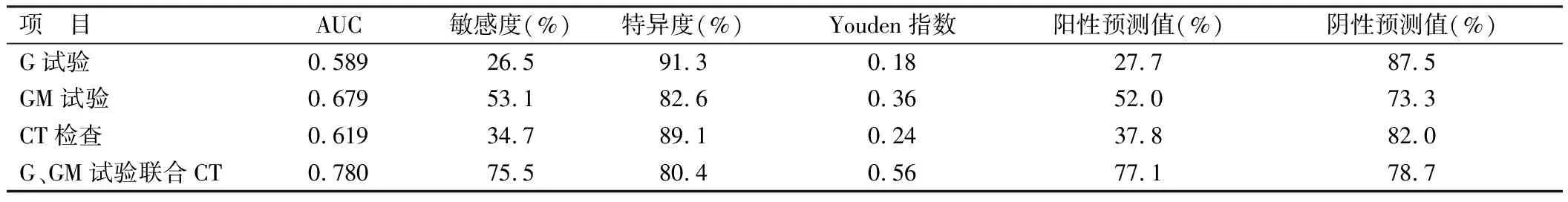
表3 不同检测方法的诊断价值比较 [例(%)]
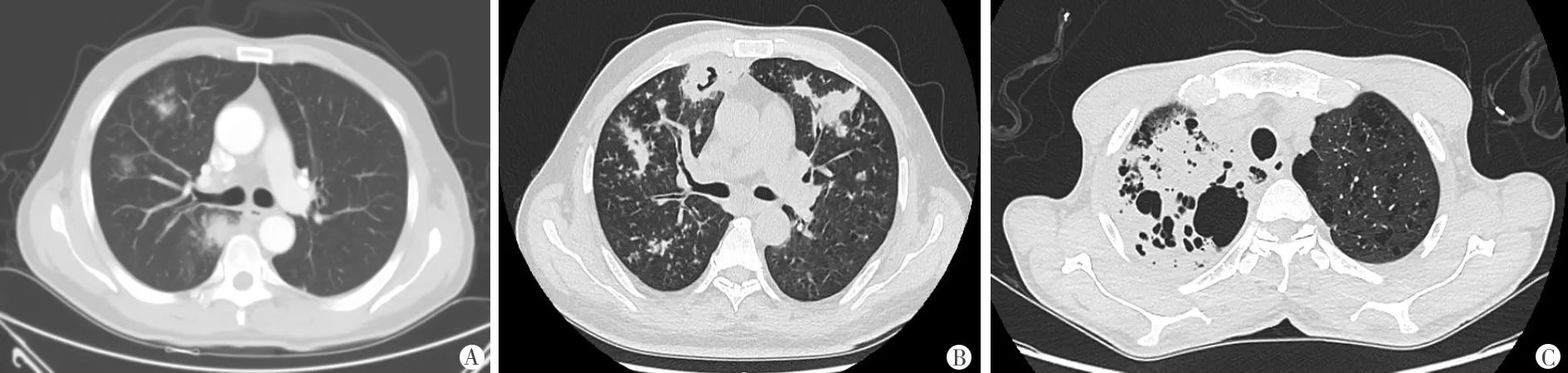
注:A.多发晕征表现;B.空洞形成并新月征表现;C.实变区内多发空洞
图1 IPA特征性CT征象改变
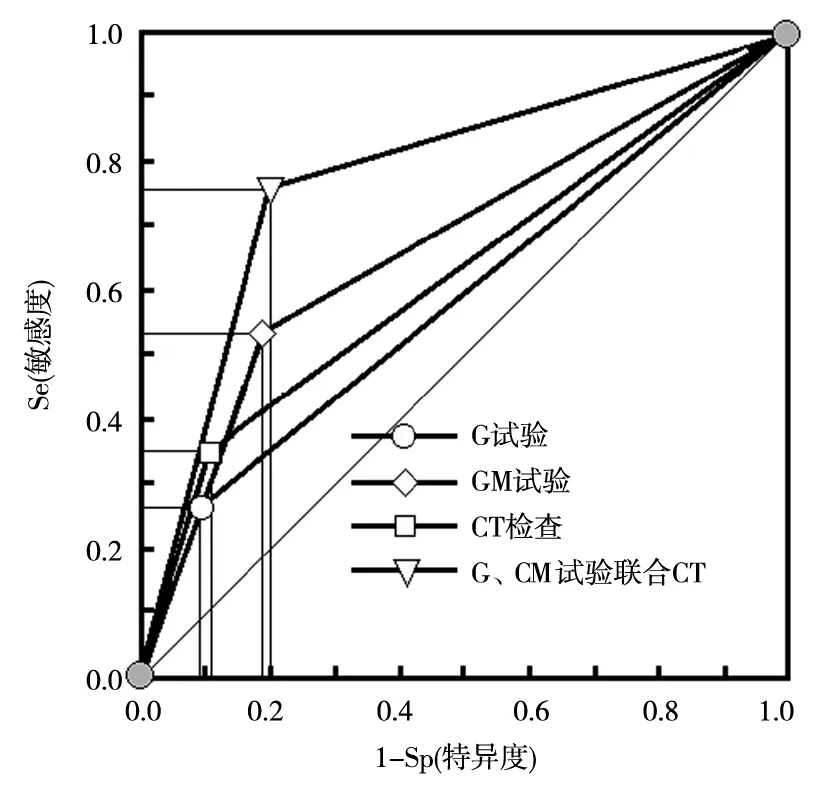
图2 不同检测方法诊断COPD合并IPA的ROC曲线
3.1 真菌的特异性抗原检测应用 近年来,通过血液检测真菌的特异性抗原已经成为诊断真菌感染的一种重要方法。1,3-β-D葡聚糖(G)分布于多种真菌的细胞壁中,为真菌特有的成分。当侵袭性真菌进入人体的血液或者深部组织后,易被机体内的吞噬细胞吞噬消化,从而使1,3-β-D葡聚糖从真菌的细胞壁中释放到患者的外周血和组织液中[12]。半乳甘露聚糖(GM)为曲霉菌细胞壁的多糖成分,在真菌侵袭组织的过程中,释放到患者体液或血液中[1-2]。在临床中,1,3-β-D葡聚糖和半乳甘露聚糖能够通过G试验或GM试验检测到。但目前的研究显示,含有不同基础疾病的患者,经曲霉菌感染后,血清G试验和GM试验检测的敏感度和特异度波动较大[2]。菌类食物、药物、血液透析等因素也会对G试验和GM试验结果造成影响,使得以上2种试验出现假阳性或假阴性的结果[1-2]。并且目前对G试验和GM试验的研究,多集中于血液系统疾病、粒细胞缺乏和在ICU治疗的重症患者[13-15]。G试验和GM试验在COPD患者合并IPA中的诊断价值研究较少。本研究结果显示,在COPD合并IPA患者中,虽然GM试验的敏感度比G试验较好,但单一的G试验或GM试验检测的阳性发现率总体并不高,这与已报道的研究相一致[16]。说明对于COPD合并IPA患者,单一的G试验或GM试验可能由于敏感度过低而导致无法有效地诊断。
3.2 胸部高分辨率CT检测的应用 胸部高分辨率CT检测可早期发现肺部真菌感染,并能够动态观察其影像学特征、数量和大小的变化,但IPA的CT表现与感染病程长短有关。并且,致病菌不同导致CT表现有别,使得CT表现缺少特异性,与大叶性肺炎、结核、肿瘤等肺部疾病难以鉴别,给诊断带来较大困难[17-18]。在欧洲癌症治疗研究组的标准中,将晕征、空气新月征、肺部实变空洞影等征象作为诊断IPA的影像学依据,并且这些影像学征象在免疫缺陷性疾病合并IPA的患者中比较典型。但是笔者发现这些典型的 CT表现在COPD合并IPA的患者中很少出现(阳性率仅为34.7%),提示单独使用CT检测也不利于COPD患者合并IPA的诊断。
3.3 联合检测的应用 G试验、GM试验和胸部CT 3种检测方法各有优缺点,而已发表的研究表明,多种检测方法的联合可能对于 IPA 的诊断意义更大,并且以往的研究一般将G试验和GM试验联合使用诊断IPA[19-20],但G试验联合GM试验与单独的GM试验比较,在敏感度、特异度和Youden指数等方面差异无统计学意义。并不比单独GM试验的诊断效果有太大的优势。
在本研究中,笔者进一步将3种检测方法联合诊断COPD合并IPA患者,敏感度为75.5%,而单独G试验、GM试验和胸部CT单独检测的敏感度分别仅为26.5%、53.1%和34.7%,三者联合检测的敏感度比3种方法中任何一种方法单独检测的敏感度都高,而特异度与单独的G试验、GM试验或CT检测比较无显著差异。三者联合检测使敏感度得到提高,可以避免COPD合并IPA患者在单一的方法检测导致疾病漏诊情况的发生。三者方法联合检测的Youden指数为0.56,单独G试验、GM试验和胸部CT检测的Youden指数为0.18、0.36和0.24。三者联合的Youden指数提高,说明联合3种方法比单一方法发现真阳性患者与假阳性患者的能力更强。以上结果表明,3种检测方法的联合优于任何一种单独的检测方法,临床诊断价值较大。
总之,对于COPD合并IPA,单独的G试验、GM试验或CT检测的敏感度较低,G试验、GM试验联合CT检测能够提高诊断的敏感度和Youden指数,对COPD合并IPA的患者有较好的诊断价值。本研究中COPD合并IPA组患者例数相对较少,还需要大样本研究加以证实3种方法的联合对 COPD合并 IPA 的诊断价值,从而为临床诊断提供有效的指导。
利益冲突:无
