不同表现的脑膜转移瘤3例报道并文献复习
2019-10-22张旭彭艳梅李嫱张静怡申文孙晨耀崔慧娟
张旭,彭艳梅,李嫱,张静怡,申文,孙晨耀,崔慧娟
1 病例报道
例1.女,69岁。2013年8月行胸部CT检查发现“右肺下叶占位”,行支气管镜检查,病理显示为“低分化腺癌”。 9月9日行“右肺下叶切除术”,术后病理示:低分化癌,结合免疫组化考虑为浸润性腺癌。病理分期:pT2aN2M0 ⅢA期。术后患者行6周期TP辅助化疗方案,定期复查,病情稳定。2018年3月22日,患者定期复查时行颅脑增强MR示:左侧额中沟、右侧大脑镰旁、左侧额上沟可见明显强化实性结节,余未见异常。结合病史,考虑肺癌脑膜转移瘤(图1)。4月16日,患者行伽马刀治疗;5月开始口服吉非替尼治疗。后定期复查,病情控制可,脑膜转移瘤较前缩小。
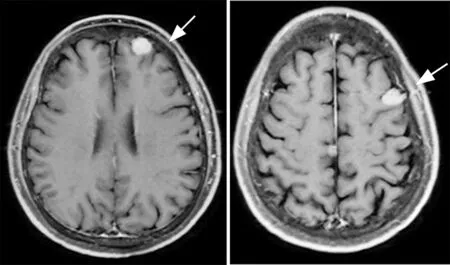
额叶强化结节 左侧额中沟强化结节
例2.女,56岁。2016年7月,患者因持续干咳行X线胸片示“肺内结节”;行右锁骨上穿刺活检,病理示“肺腺癌转移”,行分子病理示:EGFR21外显子L858R突变,ALK(-),未见ROS1融合;颅脑MR检查提示颅内多发转移瘤。患者随即开始服用埃克替尼一线治疗,无进展生存期(PFS)为6个月。12月行胸部CT检查,考虑病情进展。2017年3月行胸腔镜下胸膜穿刺活检,病理示:转移性腺癌。基因检测示T790M阴性,提示对一线埃克替尼耐药而又无法应用三代药物。2017年3月18日—10月12日行8周期二线培美曲塞化疗,复查示病灶减小。2017年10月1日开始联合吉非替尼靶向治疗。二线治疗PFS近10个月。2017年12月21日复查胸部CT提示病情进展。外周血查循环肿瘤DNA(ctDNA)示:EGFR L858R突变。 2018年7月初,查颅脑增强MR示:DWI显示左侧小脑、左侧额叶、双侧顶叶见环形异常强化,双侧基底节区、放射冠区、半卵圆中心区可见多发斑点状长T1异常信号,未见明确强化,双侧脑室周围脑白质区见斑片状略长T1长T2信号区,各脑室系统略扩张,脑沟、裂增宽,加深,中线结构居中。颅内多发异常强化,考虑转移瘤。脑积水,脑膜转移不除外。颈髓异常强化,考虑转移(图2)。2018年7月19日、7月31日脑脊液检查均未见癌细胞。患者行伊立替康+贝伐珠单抗联合吉非替尼治疗,并予以鞘内注射阿糖胞苷+甲氨喋呤治疗2周期,病情控制可,患者相关临床表现明显减轻。
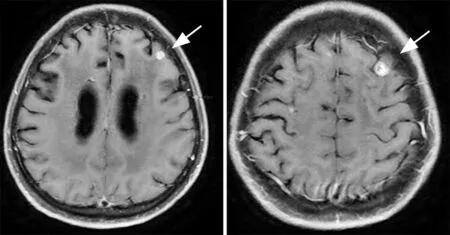
图2 肺腺癌脑膜转移MR表现
例3.女,50岁,2011年9月患者因咳嗽行胸部CT检查示“肺内占位”;行左肺下叶切除术,病理示:中分化腺癌,分期为pT1cN1M0 Ⅱb期。术后行4周期GP方案辅助化疗,定期复查,未见明显异常。2014年2月16日行PET-CT示:左肺下叶支气管残端软组织代谢高,考虑恶性,全身多发骨密度增高,考虑骨转移。行分子病理示:EGFR19外显子突变。提示可应用一代酪氨酸激酶抑制剂(TKI)类靶向药。 2016年1月25日复查PET-CT示骨转移较前增多。3月16日行循环血检测,未见EGFR及T790M突变,不适合应用三代药物。遂于2016年3月—2017年4月共行6周期二线培美曲塞+卡铂+贝伐珠单抗方案化疗。2017年5月21日行NGS检测示:T790M突变,提示适合三代TKI类药物。 11月6日复查胸部CT提示病情进展。11月16日行颅脑增强MR检查示:脑室系统扩张;脑沟、脑裂未见增宽;中线结构居中。颅脑MR增强未见明显强化(图3)。11月20日行腰椎穿刺,脑脊液检查未见明显异常。11月24日再行脑脊液检查,查见癌细胞,随即确诊为脑膜转移瘤。行多次鞘内注射阿糖胞苷后病情控制,症状明显缓解。
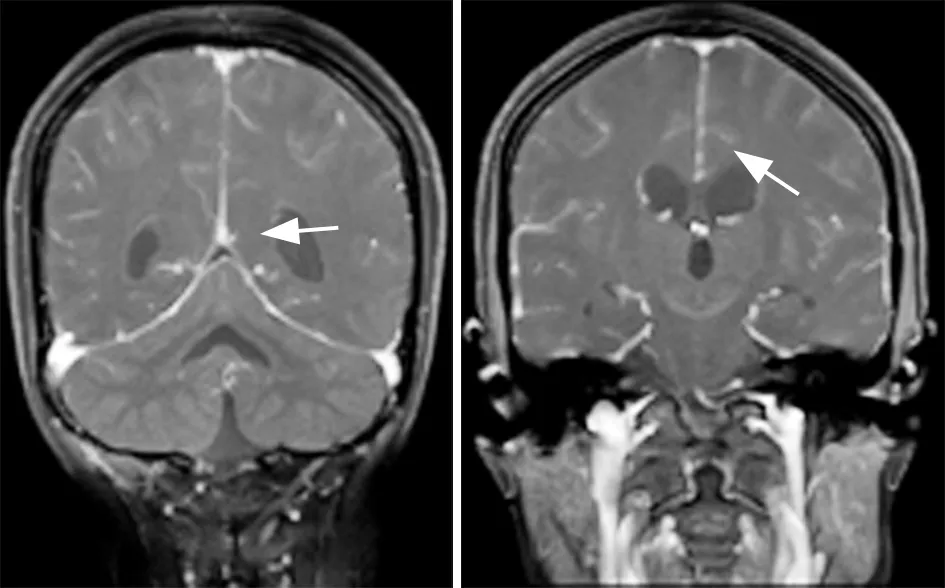
图3 中分化腺癌颅脑MR增强未见明显强化
2 讨 论
脑膜转移为恶性肿瘤晚期较严重的并发症,具有诊出率低、恶性程度高、预后差、生存期短的特点[1-2]。就诊断而言,首先要有明确的肿瘤病史,还需结合影像学、脑脊液检查、临床表现等3方面进行综合判断[3-4]。但是由于脑膜转移在各方面的表现常不具有典型特征,容易造成误诊或者漏诊。
2.1 影像学表现 颅脑增强MR为临床诊断提供了重要的参考依据,该检查特异度高达77%以上[5],是脑膜转移患者首选的检查手段[6-7]。
其典型影像学表现包括脑沟脑回的增强或消失、沿脑神经走行的短暂的线性增强、脑膜的结节、室管膜下强化、脑积水等[8],亦有表现为“尾征”者[9]。根据影像学的不同表现,脑膜转移瘤可分为2类:(1)硬脑膜—蛛网膜型,表现为颅骨内板、大脑表面的连续的弧线型强化,不延伸至脑沟回内;此型常被误诊为“脑膜瘤”。(2)软脑膜—蛛网膜型,表现为紧贴大脑表面的小结节状或细线状强化,并能深入脑沟和脑池;此型更为常见[10]。例2影像学为典型的脑膜结节表现,可明确为软脑膜型脑膜转移瘤。
然而增强MR检查的特征性表现常缺如,如例1的增强MR检查显示颅内明显的强化结节,该结节凸入脑实质内,与脑转移的表现极为相似,易被误认为是脑转移;但其强化结节周围无明显的水肿带,与脑转移“小病灶、大水肿”[11-12]等特点明显不同,且其同时存在于脑实质和蛛网膜下隙中,结节周边与脑膜相连,亦可资鉴别。
另一方面,增强MR检查的敏感度较低,仅为76%[13],假阴性率高,容易造成漏诊。例3中增强MR检查未发现异常,推测可能与病灶较小有关。但近年研究发现[14-15],T2W-FLAIR增强序列的敏感度较常规增强MR更高,若二者结合,可大大提高脑膜转移瘤的诊断准确率。
2.2 脑脊液检查 脑脊液检查主要包括脑脊液细胞学、脑脊液肿瘤标志物、循环肿瘤细胞及脑脊液常规、生化等。其中脑脊液细胞学检查特异度高[16-17],是诊断的金标准[18-19];但敏感度差,阳性率低[20-21]。单次脑脊液细胞学检查的阳性率仅为50%左右[17],本组3例第一次脑脊液检查均未查到癌细胞,即反映了此缺点。而2次或以上脑脊液细胞学检查可将阳性率提高至80%左右[20-22],上述例3即是通过2次脑脊液细胞学检查才最终确诊。不过,例2虽然也进行了2次脑脊液检查,仍为阴性结果,也反映了多次脑脊液检查仍存在假阴性的缺点[23]。
为了提高脑脊液细胞学检查的阳性率,相关专业学者进行了大量的临床和实验研究。研究发现[24],若将脑脊液细胞学检查和脑脊液免疫组化相结合,可在一定程度上提高该疾病的诊出率。而李永生等[22]则通过回顾性研究发现,将脑脊液细胞学和脑脊液肿瘤标志物检查进行结合,也可提高脑脊液检查的阳性率,弥补脑脊液细胞学检查的不足。
脑脊液循环肿瘤细胞(CTC)检查在脑膜转移瘤诊断中的价值和可靠性已被初步证实[25-26],且阳性率较脑脊液细胞学检查更高。Jiang等[27]进行了小样本的临床研究,最终发现若应用CellSearch试剂盒进行脑脊液循环肿瘤细胞检测,或可将脑脊液细胞学检查的敏感度提高至95.2%。而据Milojkovic等[28]的研究发现,如果将脑脊液循环肿瘤细胞检查和EpCAM流式细胞术进行结合,则脑脊液循环肿瘤细胞的敏感度和特异度可提高至近乎100%,但该临床研究的样本量小,仍需大规模临床研究进行验证。
2.3 相关临床表现 脑膜转移瘤患者临床表现多样但无特异性,以脑实质受累及脑膜刺激症状(如头晕、头痛等)、颅神经受累(视力或听力下降等)和脊神经根受压(四肢麻木无力等)等为主要表现。其典型症状为剧烈头痛[29]、恶心呕吐等[5];据统计[13],50%左右的患者会以此为首发表现,例2和例3即是如此;究其原因,可能与脑实质受累、颅内压增高或者脑脊液循环受阻有关[30-31]。但由于此类中枢神经系统表现缺乏特异性,在多种疾病进程中均有可能出现,故临床上难以鉴别。尤其在恶性肿瘤患者出现中枢神经系统表现时,容易首先考虑脑转移可能,造成误诊。而例1无明显的临床表现,确为少见,其发生率仅为1%[13],原因之一可能与转移瘤位置有关。
本组3例患者在影像学检查、脑脊液检查、相关临床表现方面各有不同的特点。病例1影像学检查表现明显而临床表现不明显,脑脊液检查未查到癌细胞;病例2临床表现及影像学检查均有脑膜转移的特点,但脑脊液中未找到癌细胞;病例3影像学检查虽不支持脑膜转移诊断,但临床表现明显,且脑脊液中查到癌细胞,并以此诊断。此3例各方面的不同表现既反映了脑膜转移瘤表现的复杂性,也从侧面反映出目前各项诊断方法或者技术的局限性。故在怀疑脑膜转移瘤时,既不应单纯依靠临床表现进行判断,也不应依靠单一的辅助检查作为确诊的依据,应完善其余有意义的辅助检查,综合诊断。又因其治疗效果差,生存期短,临床一旦确诊,应当进行积极的综合治疗,以期得到相对好的治疗效果。
