羽衣甘蓝小孢子胚胎细胞结构变化及其植株再生
2019-09-10姚悦梅张振超山溪肖燕朱建飞戴忠良
姚悦梅 张振超 山溪 肖燕 朱建飞 戴忠良




摘要:【目的】研究組织培养过程中羽衣甘蓝小孢子胚胎细胞结构变化及其植株再生,为小孢子培养技术在羽衣甘蓝中的应用提供理论依据。【方法】以12个羽衣甘蓝品种为材料,采用LEICA倒置荧光显微镜研究小孢子热激后的胚胎细胞结构变化、胚胎发育过程及出胚率差异,运用透射显微镜观察胚性小孢子细胞核的融合过程,并分析不同培养基(B5分化培养基和MS分化培养基)及其琼脂浓度(0.8%、1.0%和1.2%)对胚状体成苗率的影响。采用遮盖方式驯化组培苗后移栽大田,统计其成活率。【结果】在12个羽衣甘蓝品种中,除Y4花蕾的小孢子未发育成胚状体外,其他品种花蕾的小孢子均发育成不同数目的胚状体。其中,Y1和Y2平均每个花蕾的出胚数较高,分别为11.84和10.36个;Y3、Y7和Y8平均每个花蕾的出胚数较少,分别为1.55、1.45和0.94个。对于出胚数多的品种,对称分裂是其小孢子细胞分裂的主要方式,小孢子发育形成子叶形胚状体的比例也较高;而出胚数少的品种易发生小孢子不对称分裂,最终形成较多的畸形胚,子叶形胚数量较少。32.5 ℃热激1 d即可启动小孢子细胞胚胎发育进程,经原胚、球形胚、心形胚、鱼雷形胚,最终形成子叶形胚。热激处理后培养2 d小孢子进行第一次对称分裂形成两个大小、形状相似的细胞;培养5~7 d后两个细胞(胚性小孢子)逐渐靠近并融合在一起,细胞核核膜紧靠在一起,随后聚结融合,核酸物质混合,融合早期形成类似花生形的细胞核结构。含不同浓度琼脂的B5分化培养基和MS分化培养基中胚状体成苗率排序均表现为0.8%琼脂<1.0%琼脂<1.2%琼脂,且同一琼脂浓度下,B5分化培养基的胚状体成苗率均较MS分化培养基的高。组培苗驯化后移栽大田,成活率可达100%。【结论】通过小孢子培养可快速有效获得羽衣甘蓝小孢子单、双倍体再生植株。在培养过程中,胚性小孢子细胞核融合可能是导致单倍体小孢子自发加倍成为多倍体的重要方式,且含1.2%琼脂的B5分化培养基更适合用于羽衣甘蓝胚状体增殖分化成苗。
关键词: 羽衣甘蓝;小孢子培养;胚胎发育;细胞学观察;胚状体;核膜聚结
中图分类号: S635.9 文献标志码: A 文章编号:2095-1191(2019)05-0924-08
Abstract:【Objective】The aim was to study the cellular structure changes and plant regeneration during microspore culture of kale,and to lay a theoretical foundation for the application of microspore culture technology in kale. 【Method】 Twelve kale varieties were used as experimental materials to study the changes of cell structure,embryonic development and embryonic rate after microspore heat shock by LEICA inverted fluorescence microscopy. The fusion process of two nuclei by transmission electron microscopy was observed. The effects of different differentiation media(B5 and MS) and agar concentrations(0.8%, 1.0% and 1.2%) on embryoid seedling formation in culture medium were also studied. The seedlings were domesticated by covering method then transplanted into field and calculated the survival rate finally. 【Result】Among 12 kale varieties, the other varieties developed into different numbers of embryoids except genotype Y4. The average number of embryos per bud of Y1 and Y2 was higher (11.84 and 10.36) than others, but the genotypes of Y3, Y7 and Y8 developed fewer number of embryos per bud, which were 1.55, 1.45 and 0.94 respectively. For easy embryogenic genotypes, symmetrical division was the main mode of microspore division and the proportion of cotyledon embryos was higher. But for the varieties developed into fewer embryos were prone to asymmetrical division, resulting in many abnormal embryos and fewer cotyledon embryos. After heat shock for 1 d at 35 ℃,microspores initiated the first cell division,and the embryogenic microspores formed proembryos firstly,then globular embryo,heart-like embryo,torpedo embryo,and developed into cotyledonary embryos finally. After 2 d of culture, the microspores underwent the first symmetrical division to form two cells of similar size and shape. The two nuclear membranes of 5-7 d two cells(embryogenic microspores) gradually approached,followed by coalescence and fusion in culture,then nucleic acids mixed together and a peanut-like structure formed. The order of the frequency of embryo regeneration of B5 medium and MS medium with different concentrations of agar was 0.8% agar <1.0% agar <1.2% agar, and at the same concentration of agar, the frequency of embryo regeneration of B5 medium was higher than that of MS medium. After domestication, the survival rate of tissue culture seedlings could reach 100% after transplanted into field. 【Conclusion】Microspore culture can obtain doubled haploid regenerated plants of kale quickly and effectively. During microspore culture, nuclear fusion of embryogenic microspore might be an important way to cause haploid microspore to become polyploidy spontaneously. B5 differentiation medium with 1.2% agar is more suitable for embryos regenerate into seedlings of kale.
Key words: kale; microspore culture; embryonic development; cytological observation; embryoid; nuclear membrane coalescence
0 引言
【研究意义】羽衣甘蓝(Brassica oleracea L. var. acephala)叶形多姿,叶色绚丽,耐寒性较强,且营养丰富,既可用于秋冬园林景观绿化造型,又能作为营养蔬菜用于食疗保健(郭宁等,2017)。目前,国内的羽衣甘蓝商品种主要来自日本及欧美国家,种子价格昂贵,国内种质资源匮乏,常规田间育种手段费时费力且效率较低,而小孢子培养技术可快速创制新种质。通过该技术可显微观察不同类型羽衣甘蓝小孢子胚胎细胞结构变化和细胞核融合过程,但其应用受限于基因型障碍和培养基成分等(戴希刚等,2012;王玉书等,2015)。因此,改进羽衣甘蓝小孢子培养技术,提高小孢子出胚率和胚状体再生成苗率对创制其优异育种材料、缩短育种进程、提高育种效率具有重要意义。【前人研究进展】大量研究证明,羽衣甘蓝游离小孢子培养技术的应用受诸多因素影响,其中基因型发挥决定性影响(张振超等,2013;祝朋芳等,2015;韩硕等,2018)。热激诱导后,小孢子的细胞质和细胞核结构发生变化,如体积膨大、细胞核移至细胞中心及细胞质重分布等,然后进入到孢子体发育途径(Zeng et al.,2015),诱导小孢子胚胎发育主要包括A、B和C 3个途径(Hu and Kasha,1999),其中,A途径是小孢子诱导后进行不对称第一次细胞有丝分裂;B途径是小孢子诱导后进行对称第一次有丝分裂,可形成两个相似的营养核,该途径是许多物种胚胎发生和形成的关键途径(Zeng et al.,2015);C途径始于营养核和生殖核的融合及持续的有丝分裂,形成具有二倍体染色体数目的愈伤组织或胚状体(Gerszberg,2018)。这3个途径常共存于同一个培养中,且其变化频率随基因型、胁迫处理及培养条件不同而存在差异(Soriano et al.,2013;Gerszberg,2018)。Testillano等(2004)研究发现,热激诱导后培养5~7 d的玉米胚性小孢子细胞通过核融合的方式(C途径)在胚域发生染色体加倍。Zeng等(2015)研究发现,青花菜×白头甘蓝杂交种小孢子培养中,胚胎发育的主要途径为B途径,少数为C途径。【本研究切入点】目前,鲜见有关小孢子细胞胚胎实时动态变化及胚性小孢子细胞核融合形成多倍体的研究报道。【拟解决的关键问题】以12个羽衣甘蓝品种为材料,采用LEICA倒置荧光显微镜研究小孢子热激后的细胞结构变化、胚胎发育过程及出胚率差异,运用透射电镜观察两个胚性小孢子的细胞核融合过程,并分析不同培养基(B5分化培养基和MS分化培养基)及其琼脂浓度(0.8%、1.0%和1.2%)对胚状体成苗率的影响,最后采用遮盖方式驯化组培苗后移栽大田,统计其成活率,以期为羽衣甘蓝小孢子培养技术应用提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为12个不同类型的羽衣甘蓝品种,具体品种名和来源地如表1所示,分别由江苏札幌采种场、浙江虹越花卉有限公司和农友种苗(中国)有限公司提供。小孢子培养所用试剂均购自国药集团化学试剂有限公司。主要仪器设备:卢湘仪离心机(TDZ-WS,上海卢湘仪离心机仪器有限公司)、LEICA倒置荧光显微镜(LEICA,日本)、透射显微镜(JROL JEM-1200EX,日本)、成像系统(LEICA DFC 300FX,日本)等。
1. 2 小孢子分离及培养
2015年8月20日开始育苗,选取10株苗龄30~35 d的健康苗定植于江苏丘陵地区镇江农业科学研究所育种基地温室。当年11~12月和翌年3~4月,室外平均温度在12.0 ℃左右时,取合适花蕾用于游离小孢子分离及培养,具体方法参照Soriano等(2013)、张振超等(2013)的文献报道。从健壮花序上观察选取单核靠边期的花蕾,在超净工作台中用5.6%次氯酸钠溶液振荡灭菌20 min,以无菌水冲洗3~5次,将无菌花蕾置于100 mL无菌烧杯,加入10 mL NLN-13液体培养基,用无菌玻璃棒研磨匀浆,悬浮液用40 µm孔径尼龙网过滤到50 mL无菌离心管中,密封后850 r/min离心5 min,弃上清液,沉淀中加入NLN-13液体培养基40 mL,并加入1 mL活性炭,混匀后分装入直径为60 mm的培养皿中,每皿4 mL,分别用Parafilm密封后置于32.5 ℃培养箱中黑暗热激处理1~2 d,转至(25.0±1.0)℃培养箱中静置暗培养。当肉眼可见胚状体时将培养皿转移至65 r/min振荡培养箱中培养,3周后统计平均每个花蕾的出胚数。试验设5个重复,每个重复15个花蕾。最后比较分析不同品种羽衣甘蓝小孢子的出胚差异。
1. 3 小孢子胚胎发育实时动态观察
通过DAPI荧光染色法观察羽衣甘蓝不同大小花蕾中小孢子发育情况(康洁,2010;张振超等,2015)。觀察前在载玻片上滴一滴工作液,用镊子压碎花药使小孢子均匀散布在工作液中,移去残余花蕾,盖上盖玻片,在LEICA倒置荧光显微镜(40×10)下观察,并采用成像系统拍照记录,每个品种不同大小花蕾随机取10个,每个花蕾观察2个花药、10个不同视野。
小孢子培养过程中,采用LEICA倒置荧光显微镜(40×10)每3 d观察一次,每皿观察5个不同视野,统计小孢子萌发数,并对其形态拍照记录。
1. 4 胚性小孢子细胞核融合过程观察
采用洪健等(1998)的方法进行电镜切片制样及观察。小孢子悬浮液1000 r/min离心5 min,弃上清液,沉淀中加入2.5%戊二醛,将沉淀振荡悬浮。制片时,1000 r/min离心5 min小孢子悬浮液,弃上清液,沉淀用磷酸盐缓冲液清洗2次后1000 r/min离心5 min,沉淀用1%四氧化锇固定4 h,1000 r/min离心5 min后沉淀用磷酸盐缓冲液清洗2次,再用丙酮进行梯度脱水,用Epon 812树脂包埋后进行超薄切片,所制切片在透射显微镜(放大倍数为4000~7500倍)下观察,并拍照记录。
1. 5 不同培养基及其琼脂浓度对胚状体成苗率的影响
胚状体在液体培养基中培养25 d左右后分别转接至B5分化培养基[B5培养基+23%蔗糖+不同浓度(0.8%、1.0%和1.2%)琼脂,pH 6.0]和MS分化培养基[MS培养基+25%蔗糖+不同浓度(0.8%、1.0%和1.2%)琼脂,pH 6.0]上,30 d后统计胚状体成苗率,分析不同培养基及其琼脂浓度对胚状体成苗率的影响。然后将其转接至固体生根培养基(1/2 MS培养基+0.1 mg/L NAA+0.1 mg/L IAA+20%蔗糖+0.8%琼脂,pH 5.8~6.0)上,在光照培养室[光周期为14 h光照/10 h黑暗,温度(25.0±2.0)℃]中培养25~30 d。
1. 6 再生植株驯化和移栽
在固体生根培养基培养25~30 d后对组培苗进行驯化和移栽。先把组培瓶从培养室移出,松开瓶盖注入少量自来水,室温条件下炼苗4~5 d。从瓶中小心取出组培苗,洗净根部培养基,用800~1000倍百菌清浸泡基部2~3 min后栽种于72孔穴盘的瑞士品氏育苗专用基质中,白色透明塑料膜覆盖保湿7~10 d后移栽至大田,观察小孢子再生植株生长势、农艺性状等,并统计其成活率。
1. 7 统计分析
采用Excel 2007和SAS 9.4对试验数据进行统计分析。
2 结果与分析
2. 1 小孢子胚胎发生情况分析结果
不同羽衣甘蓝品种平均每个花蕾出胚数如表2所示。在12个品种中,除Y4花蕾的小孢子未发育成胚状体外,其他品种花蕾的小孢子均能发育成不同数目的胚状体。其中,Y2平均每个花蕾的出胚数最高,为11.84个;其次是Y1,为10.36个;Y3、Y7和Y8平均每个花蕾出胚数较少,分别为1.55、1.45和0.94个。
2. 2 小孢子胚胎发育过程的细胞学观察结果
由图1可知,小孢子经母细胞减数分裂后形成4个单倍体小孢子(四分体)(图1-a),随后形成明显的细胞壁,体积逐渐增大,细胞质发生液泡化(图1-b),液泡细胞核从中心位置被挤压到细胞壁一侧(图1-c),小孢子继续分离发育产生1个营养核和1个生殖核,即为双核期小孢子,其明显特征是两个细胞核间形成细胞板,两个细胞大小及形态不均等(图1-d)。这些形态特征的变化为选择适期培养的花蕾提供了较准确的依据。
32.5 ℃热激1 d即可启动小孢子细胞胚胎发育进程。一部分小孢子细胞膨大(图1-e和图1-h),呈圆球形或卵圆形(图1-g),细胞壁裂解;(25.0±1.0)℃暗培养3 d后发生多次对称分裂(图1-f)或不对称分裂(图1-g),发生对称分裂的小孢子继续培养形成原胚(图1-i);15 d后逐渐发育形成肉眼可见的球形(图1-j)、心形(图1-k)或鱼雷形胚状体(图1-l);25 d后发育形成子叶形胚(图1-m和1-o)。未感受到热激的小孢子则无法发育,如图1-e、图1-g和图1-h中箭头所示。此外,观察发现小孢子发育并非同步进行(图1-o),在同一培养皿中,部分小孢子生长发育较好,形成子叶形胚,还有部分小孢子仍处在其他不同发育时期,甚至有部分小孢子发育成畸形胚,即不对称分裂的小孢子停止发育或继续膨大至细胞壁破裂(图1-n)。
综合分析发现,对于出胚数多的品种,对称分裂是其小孢子细胞分裂的主要方式,小孢子发育形成子叶形胚状体的比列也较高;而出胚数少的品种易发生小孢子不对称分裂,最终形成较多的畸形胚,子叶形胚数量较少。
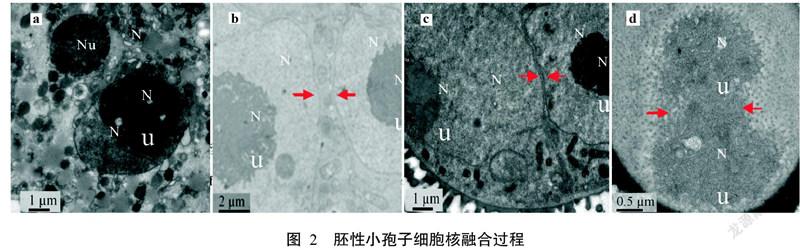
2. 3 胚性小孢子细胞核融合过程观察结果
32.5 ℃热激1 d后继续培养2 d小孢子进行第一次对称分裂形成两个大小、形状相似的细胞,两个细胞相邻,但无细胞壁包被,细胞核染色较浅,细胞器散布在细胞质中(图2-a)。培养5~7 d后两个细胞(胚性小孢子)逐渐靠近并融合在一起,染色质压缩折叠所构成的形式与大核仁基本一致(图2-b),两个细胞的细胞核在细胞质中逐渐靠近,核膜紧靠在一起,细胞的其他区域则发生融合(图2-c)。在两个细胞核膜融合处可看到核酸物质混合,两个核仁仍是独立状态,融合早期形成类似花生形的细胞核结构(图2-d)。
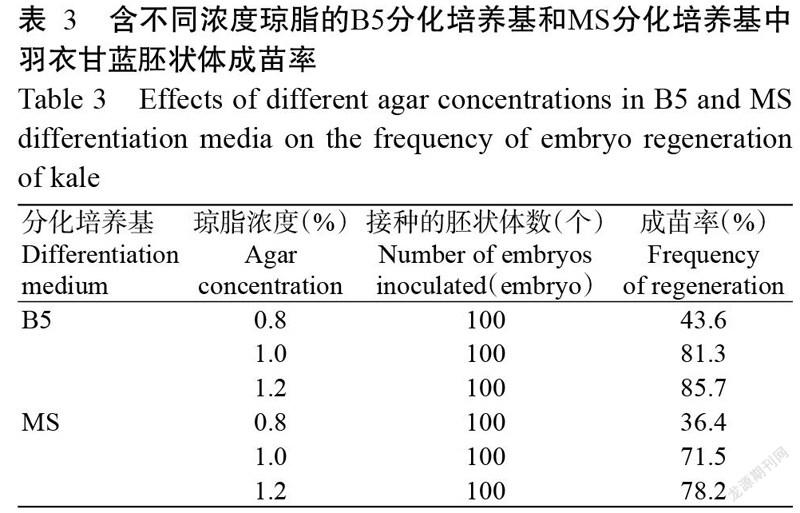
2. 4 不同培养基及其琼脂浓度对胚状体成苗率的影响
以出胚数最多的羽衣甘蓝品种Y2小孢子胚状体为试材,研究B5分化培养基和MS分化培养基及其琼脂浓度对胚状体成苗率的影响,结果如表3所示。含不同浓度琼脂的B5分化培养基和MS分化培养基中胚状体成苗率排序均表现为0.8%琼脂<1.0%琼脂<1.2%琼脂,尤其是含0.8%琼脂的B5分化培养基和MS分化培养基中胚状体成苗率均明显较低,分别为43.6%和36.4%;含1.2%琼脂的B5分化培养基和MS分化培养基中胚状体成苗率较高,分别为85.7%和78.2%。且同一琼脂浓度下,B5分化培养基的胚状体成苗率均较MS分化培养基高。可见,含1.2%琼脂的B5分化培养基更适合用于羽衣甘蓝胚状体增殖分化成苗。
通过观察发现,小孢子胚狀体水含量较高,当琼脂浓度低(0.8%)时,因培养基中水含量较高,胚状体易产生玻璃化现象而导致死亡(图3-a);当琼脂浓度高(1.0%和1.2%)时,培养基中水含量相对较低,玻璃化现象明显降低(图3-b);培养4 d后,胚状体长出根毛,子叶变绿,胚顶端抽生出小芽,20 d后长成健壮的茎(图3-c),将茎转接至固体生根培养基中继续培养,7 d后可观察到根部有白色毛状物出现,15 d后开始生根,培养30 d后发现植株生长健壮、根系旺盛(图3-d)。
2. 5 再生植株驯化移栽结果
图4展示小孢子再生植株的驯化移栽过程。组培苗在固体生根培养基培养25~30 d后,其根系旺盛,且有4~5片叶子(图4-a和图4-b),先用清水洗去组培苗根部培养基(图4-c),再用百菌清溶液浸泡可有效预防病菌对组培苗的侵害。使用瑞士品氏育苗专用基质栽培、白色塑料膜覆盖保湿等方法可有效促进组培苗更快缓苗,成活率达100%,且长势旺盛(图4-d和图4-e)。移栽大田后,小孢子再生植株的成活率为100%,且生长势、植株性状和农艺性状与种子实生苗无明显差异(图4-f)。
3 讨论
羽衣甘蓝是异花授粉植物,具有明显的杂种优势,其商品种几乎全为杂交种,因此,杂种育种成为羽衣甘蓝品种选育的主要方式(祝朋芳等,2015)。选育纯合稳定的自交系育种材料一般需要5~6代连续自交,而采用游离小孢子培养技术可在1~2年内获得大量DH单体植株,应用前景广阔(袁素霞等,2010;彭楚媛,2017)。虽然前人在羽衣甘蓝小孢子培养技术方面研究已取得一些成果,但未有突破性的进展,其应用主要受限于基因型障碍和培养基成分等(戴希刚等,2012;张振超等,2015,2018)。本研究选取12个不同类型的羽衣甘蓝品种开展游离小孢子培养研究,结果发现除Y4未获得胚状体外,其他材料均获得了不同数目的胚状体,其中Y2和Y1平均每个花蕾的出胚数较高,Y3、Y7和Y8平均每个花蕾出胚数较少。结合后期研究发现,对于出胚数多的品种,小孢子发育形成子叶形胚状体的比例较高,胚状体成苗率也较高,而出胚数少的品种易形成较多的畸形胚,胚状体成苗率较低。
配子體形成过程中,花药先后分化形成孢原组织和小孢子母细胞,经减数分裂形成四分体孢子,单核小孢子不断细胞分裂后经单核和双核阶段,最后形成三核花粉粒,不对称分裂是小孢子自然分裂形成花粉粒的主要方式(毛忠良等,2012)。而在游离小孢子培养过程中,单核晚期至双核早期的小孢子易受外界刺激,由配子体发育转变为孢子体发育,在羽衣甘蓝小孢子培养中,最常用的外界刺激为32~33.0 ℃热激处理1~2 d(冯辉等,2007;毛忠良等,2012;王玉书等,2015)。本研究发现,32.5 ℃热激处理1 d即可有效促进羽衣甘蓝小孢子胚胎发育。发育过早的单核小孢子细胞尚未成形,在培养过程中可能会由于对外部环境不适应而凋亡;发育过晚的小孢子细胞结构已经固化,其脱分化能力较差,外界热激胁迫处理不易诱发其改变发育途径而形成胚状体(冯辉等,2007;袁素霞等,2010;张振超等,2015)。研究发现,游离小孢子受高温刺激后,即发生多次不对称或对称分裂,不对称细胞分裂形成的小孢子细胞在培养过程中会凋亡或形成畸形胚(A途径),对称分裂则形成两个形态和结构相似的细胞核(B途径),均无核膜包被,而细胞器和细胞质均匀散布在细胞核周围,其原因可能是虽然小孢子热激后同一细胞内细胞核发生了对称分裂,但细胞质仍然保持原来状态,未发生分裂(Hosp et al.,2007;毛忠良等,2012;Zeng et al.,2015)。本研究发现,供试材料经热激处理后,大部分发育小孢子发生对称分裂(B途径),最终形成单倍体胚。C途径是小孢子胚胎发育过程中发生自然加倍的重要途径(Walley et al.,2012),如大麦、玉米和小麦小孢子培养时其胚性小孢子发生核融合最终形成多倍体胚(Sunderland,1974;Shim and Kasha,2003;Testillano et al.,2004)。本研究还发现,小部分胚性小孢子沿C途径发育所形成的两个细胞核融合最终形成二倍体胚。
胚状体成苗率与培养基类型和成分有关(张振超等,2015)。本研究发现,含不同琼脂浓度的B5分化培养基和MS分化培养基中胚状体成苗率排序均表现为0.8%琼脂<1.0%琼脂<1.2%琼脂,且同一琼脂浓度下,B5分化培养基的胚状体成苗率均较MS分化培养基的高,说明含1.2%琼脂的B5分化培养基更适合用于羽衣甘蓝胚状体增殖分化成苗。冯翠等(2011)也研究发现,琼脂浓度影响青花菜胚状体成苗率,可通过调节培养基中水分含量,降低胚状体玻璃化现象,促进胚状体成苗。
4 结论
通过小孢子培养可快速有效获得羽衣甘蓝小孢子单、双倍体再生植株。在培养过程中,胚性小孢子细胞核融合可能是导致单倍体小孢子自发加倍成为多倍体的重要方式,且含1.2%琼脂的B5分化培养基更适合用于羽衣甘蓝胚状体增殖分化成苗。
参考文献:
戴希刚,施雪萍,包满珠. 2012. 基因型与培养条件对羽衣甘蓝小孢子胚胎发生的影响[J]. 植物生理学报,48(11):1113-1119. [Dai X G,Shi X P,Bao M Z. 2012. Effects of genotype and culture condition on microspore embryogenesis of ornamental kale(Brassica oleracea var. acepha-la)[J]. Plant Physiology Journal,48(11):1113-1119.]
冯翠,曾爱松,严继勇,宋立晓,高兵,侯喜林. 2011. 影响青花菜游离小孢子培养的因素[J]. 南京农业大学学报,34(6):20-24. [Feng C,Zeng A S,Yan J Y,Song L X,Gao B,Hou X L. 2011. The factors affecting isolated microspore culture in Brassica oleracea L var. italica[J]. Journal of Nanjing Agricultural University,34(6):20-24.]
冯辉,姜凤英,冯建云,王超楠. 2007. 羽衣甘蓝游离小孢子培养技术研究及应用[J]. 园艺学报,34(4):1019-1022. [Feng H,Jiang F Y,Feng J Y,Wang C N. 2007. Establishment and application of the system for isolated microspore culture in kale(Brassica oleracea L. var. acephala DC.)[J]. Acta Horticulturae Sinica,34(4):1019-1022.]
郭宁,高怀杰,韩硕,宗梅,王桂香,张月云,刘凡. 2017. 观赏羽衣甘蓝SSR标记分型与亲缘关系研究[J]. 植物遗传资源学报,18(2):349-357. [Guo N,Gao H J,Han S,Zong M,Wang G X,Zhang Y Y,Liu F. 2017. Genotypic and genetic relationship analysis of ornamental kale(Brassica oleracea var. acephala) by SSR markers[J]. Journal of Plant Genetic Resources,18(2):349-357.]
韩硕,郭宁,张月云,宗梅,王桂香,刘凡. 2018. 羽衣甘蓝双单倍体育种技术研究[J]. 农业生物技术学报,26(3):521-529. [Han S,Guo N,Zhang Y Y,Zong M,Wang G X,Liu F. 2018. Researches on the double haploid breeding of ornamental kale(Brassica oleracea var. acephala)[J]. Journal of Agricultural Biotechnology,26(3):521-529.]
洪健,黎軍英,高其康,蒋德安. 1998. 钾营养影响水稻叶绿体的形态定量分析[J]. 浙江农业大学学报,24(S):1-4. [Hong J,Li J Y,Gao Q K,Jiang D A. 1998. Morphome-tric analysis of effect of K nutrition on developmental course of rice chloroplast[J]. Journal of Zhejiang Agricultural University,24(S):1-4.]
康洁. 2010. 番茄小孢子发育时期鉴定和游离方法的研究[J]. 中国农学通报,26(17):75-78. [Kang J. 2010. Research on the method for developmental stage identification and free for the microspore of tomato[J]. Chinese Agricultural Science Bulletin,26(17):75-78.]
毛忠良,张振超,姚悦梅,戴忠良,秦文斌,潘跃平. 2012. 羽衣甘蓝小孢子胚胎发生观察及再生植株倍性鉴定[J]. 西北植物学报,32(10):2016-2022. [Mao Z L,Zhang Z C,Yao Y M,Dai Z L,Qin W B,Pan Y P. 2012. In vitro microspore embyogenesis and chromosome doubling of kale[J]. Acta Botanica Boreali-Occidentalia Sinica,32(10):2016-2022.]
彭楚媛. 2017. 羽衣甘蓝游离小孢子培养与再生体系构建[D]. 沈阳:沈阳农业大学. [Peng C Y. 2017. Research on regengration and genetic transformation system of kale[D]. Shenyang:Shenyang Agricultural University.]
王玉书,王欢,范震宇,冯辉. 2015. 观赏羽衣甘蓝小孢子培养及再生植株倍性变异[J]. 核农学报,29(6):1037-1043. [Wang Y S,Wang H,Fan Z Y,Feng H. 2015. Isolated microspore culture and ploidy variation of regenerated plants in ornamental kale[J]. Journal of Nuclear Agricultural Sciences,29(6):1037-1043.]
袁素霞,刘玉梅,方智远,杨丽梅,庄木,张扬勇,孙培田. 2010. 结球甘蓝和青花菜小孢子胚植株再生[J]. 植物学报,45(2):226-232. [Yuan S X,Liu Y M,Fang Z Y,Yang L M,Zhuang M,Zhang Y Y,Sun P T. 2010. Plant regeneration from microspore-derived embryos in cabbage(Brassica oleracea var. capitata) and broccoli(Brassica oleracea var. italica)[J]. Chinese Bulletin of Botany,45(2):226-232.]
张振超,耿鑫鑫,戴忠良,潘跃平,王兵,许玲,颜志明,周伟军. 2013. 甘蓝类植物小孢子培养及植株再生研究[J]. 核农学报,27(7):929-937. [Zhang Z C,Geng X X,Dai Z L,Pan Y P,Wang B,Xu L,Yan Z M,Zhou W J. 2013. Microspore embryogenesis and plant regeneration of bra-ssica plants[J]. Journal of Nuclear Agricultural Sciences,27(7):929-937.]
张振超,潘跃平,毛忠良,颜志明,吴国平,姚悦梅,秦文斌,解振强,戴忠良. 2015. 青花菜与甘蓝型油菜小孢子共培养技术研究[J]. 核农学报,29(8):1487-1493. [Zhang Z C,Pan Y P,Mao Z L,Yan Z M,Wu G P,Yao Y M,Qin W B,Xie Z Q,Dai Z L. 2015. A preliminary research on improvement of microspore embryogenesis for recalcitrant broccoli genotypes[J]. Journal of Nuclear Agricultural Sciences,29(8):1487-1493.]
张振超,姚悦梅,毛忠良,孙国胜,秦文斌,戴忠良. 2018. 基于高通量測序的青花菜早期发育小孢子转录组分析与基因功能注释[J]. 核农学报,32(5):848-855. [Zhang Z C,Yao Y M,Mao Z L,Sun G S,Qin W B,Dai Z L. 2018. Transcriptome analysis and gene function annotation of early developmental broccoli microspores based on high-throughput sequencing technology[J]. Journal of Nuclear Agricultural Sciences,32(5):848-855.]
祝朋芳,王卫珍,李珺,刘畅,年玉欣. 2015. 羽衣甘蓝游离小孢子胚胎发生、植株再生与增殖的研究[J]. 北方园艺,(13):111-115. [Zhu P F,Wang W Z,Li J,Liu C,Nian Y X. 2015. Study on microspore embryogenesis regeneration and propagation in vitro on ornamental kale(Brassica oleracea var. acephala)[J]. Northern Horticulture,(13):111-115.]
Gerszberg A. 2018. Tissue culture and genetic transformation of cabbage(Brassica oleracea var. capitata):An overview[J]. Planta,248(5):1037-1048.
Hosp J,Maraschin S F,Touraev A,Boutilier K. 2007. Functional genomics of microspore embryogenesis[J]. Euphy-tica,158(3):275-285.
Hu T,Kasha K J .1999. A cytological study of pretreatments used to improve isolated microspore cultures of wheat (Triticum aestivum L.) cv. Chris[J]. Genome,42(3):432-441.
Shim Y S,Kasha K J. 2003. The influence of pretreatment on cell stage progression and the time of DNA synthesis in barley(Hordeum vulgare L.) uninucleate microspores[J]. Plant Cell Report,21(11):1065-1071.
Soriano M,Li H,Boutilier K. 2013. Microspore embryogenesis:Establishment of embryo identity and pattern in culture[J]. Plant Reproduction,26(3):181-196.
Sunderland N. 1974. Anther culture as a means of haploid induction[M]//Kasha K J. Haploids in Higher Plants:Advances and Potential. Guelph:University of Guelph.
Testillano P S,Georgiev S,Mogensen H L,Coronado M J,Dumas C,Risueno M C,Matthys-Rochon E. 2004. Spontaneous chromosome doubling results from nuclear fusion during in vitro maize induced microspore embryogenesis[J]. Chromosoma,112(7):342-349.
Walley P G,Carder J,Skipper E,Mathas E,Lynn J,Pink D,Buchanan-Wollaston V. 2012. A new broccoli×broccoli immortal mapping population and framework genetic map:Tools for breeders and complex trait analysis[J]. Theore-tical and Applied Genetics,124(3):467-484.
Zeng A S,Yan J Y,Song L X,Gao B,Zhang Y X,Li J Q,Liu H H,Hou X L,Li Y. 2015. Induction and development of microspore-derived embryos in broccoli 3 white-headed cabbage hybrids microspore culture[J]. Euphytica,203(2):261-272.
(责任编辑 陈 燕)
