IHHNVPCR检测方法改进及广西流行株基因型分析
2019-09-10杨慧赞童桂香郑晓聪谭红连黄国秋廖永志韦信贤胡庭俊
杨慧赞 童桂香 郑晓聪 谭红连 黄国秋 廖永志 韦信贤 胡庭俊



摘要:【目的】建立并優化传染性皮下及造血组织坏死病毒(IHHNV)检测及其基因分型的套式PCR,并确定IHHNV在广西流行的基因型,为有效防控广西对虾传染性皮下及造血组织坏死病(IHHN)提供参考依据。【方法】在以PCR检测IHHNV现有标准的基础上,于389F/R和309F/R两对引物扩增片段之外的绝对保守区域设计外引物IHHNV-WF/WR,优化退火温度和引物浓度后建立IHHNV检测及基因分型的套式PCR,并通过与一步法PCR对比以验证其优越性;采用建立的套式PCR对546株2010—2018年收集的IHHNV广西流行株进行基因型分析,确定IHHNV在广西流行的基因型。【结果】优化后的第一轮PCR反应体系20.0 µL:2×F8 FastLong PCR MasterMix 10.0 μL,上、下游引物(20 μmol/L)各0.8 μL,DNA模板2.0 μL,无核菌酶灭菌水补足至20.0 μL。扩增程序:94.0 ℃预变性3 min;94.0 ℃ 10 s,59.0 ℃ 15 s,72.0 ℃ 15 s,进行35个循环;72.0 ℃延伸5 min。套式PCR检测IHHNV的灵敏度较一步法PCR提高100倍;对100份IHHNV阳性临床样品的检测结果与一步法PCR的检测结果一致,符合率达100%。从546株IHHNV广西流行株中均能扩增获得309 bp的目的条带,全部为感染型(基因1型和基因2型)。【结论】在PCR检测IHHNV现有标准基础上建立的IHHNV检测及基因分型套式PCR,其灵敏度较一步法PCR提高100倍,尤其适用于检测IHHNV含量低的样品,可为疫病监测及进出口检疫提供更敏感的技术手段。当前广西流行的IHHNV均为感染型(基因1型和基因2型)。
关键词: 对虾;传染性皮下及造血组织坏死病毒(IHHNV);套式PCR;基因型
中图分类号: S945.46 文献标志码: A 文章编号:2095-1191(2019)05-1127-06
Abstract:【Objective】The nested PCR detection methods were developed in order to provide technical support for detection and genotypes analysis of infectious hypodermal and hematopoietic necrosis virus(IHHNV), and the genotypes of IHHNV epidemic in Guangxi were investigated to offer a reference for effective prevention and control of infectious subcutaneous and hematopoietic necrosis virus(IHHN) for prawn in Guangxi. 【Method】A pair of outer primers named IHHNV-WF/WR were designed on the conserved domain which located at both ends of primers 389F/R and 309F/R used in the present standards for PCR detection of IHHNV. Then the nested PCR detection methods were developed following optimization of annealing temperature and primers concentration. The superiority of the method was evaluated by comparing with former one-step PCR. A total of 546 IHHNV strains from Guangxi during 2010-2018 were conducted genotypes analy-sis using the nested PCR. The epidemic strains of IHHNV in Guangxi were identified. 【Result】The optimized first-round PCR amplification reactions 20.0 μL included 10.0 μL of 2×F8 FastLong PCR Master Mix, 0.8 μL of upstream and downstream primers(20 μmol/L),2.0 μL of the DNA template and sterile water to a final volume of 20.0 μL. PCR amplification was carried out as follows:3 min initial denaturation step at 94 ℃; followed by 35 cycles of 94 ℃ for 10 s, 59 ℃ for 15 s and 72 ℃ for 15 s; with a final extension step of 5 min at 72 ℃. The nested PCR methods developed were 100 times more sensitive than former one-step PCR methods. The nested PCR was used to detect 100 IHHNV-positive clinical samples, the results were consistent with former one-step PCR, coincidence rate was 100%. All 546 IHHNV epidemic strains from Guangxi could amplify 309 bp target bands, and they were infectious genotypes(genotype 1 and genotype 2). 【Conclusion】The nested PCR methods developed in this study on the current basis for detection and genotypes analysis of IHHNV are 100 times more sensitive than former one-step PCR methods, and can provide more sensitive means for detecting IHHNV in surveillance and quarantine samples which contain small amount of IHHNV. IHHNV epidemic strains in Guangxi are all infectious genotypes(genotype 1 and genotype 2) at present.
Key words: prawn; infectious hypodermal and hematopoietic necrosis virus(IHHNV); nested PCR; genotypes
0 引言
【研究意义】传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)可感染世界各地的养殖及野生对虾,感染后的危害程度因对虾种类或种群而异,感染凡纳滨对虾可引起矮小残缺综合症(Runt-deformity syndrome,RDS),患病對虾表现为生长缓慢、表皮畸形和产量下降(白丽蓉和赵志英,2012;童桂香等,2013;曾地刚等,2013)。感染IHHNV或患病后存活的对虾终生带毒,可通过垂直传播和水平传播将病毒传给下一代及其他种群,因此生产上很难根除(Motte et al.,2003;韦信贤等,2011)。鉴于传染性皮下及造血组织坏死病毒病(IHHN)对养殖对虾危害较大,已严重影响对虾养殖业的健康发展,世界动物卫生组织(OIE)将其划定为甲壳类其他重要疫病之一,我国动物疫病病种名录则将其划为二类动物疫病。因此,开展IHHNV检测方法研究及其流行株基因型分析,可为IHHN监测提供更完善的检测技术,并在生产上针对不同基因型毒株采取科学的防制措施。【前人研究进展】IHHNV是继白斑综合症病毒(White spot syndrome virus,WSSV)后又一具有普遍感染性的对虾病毒,曾在我国山东、上海、广东和广西等对虾主要养殖地区普遍流行(童桂香等,2013);虽然近几年我国IHHNV阳性率整体上呈逐年下降趋势,但除广西的阳性率较低外(梁静真等,2018),江苏、辽宁和天津等地区的阳性率仍处在较高水平(邓威等,2017;王博雅等,2017;王筱珊等,2017)。IHHNV已确定至少存在4种不同基因型(1型、2型、3A型和3B型),其中,基因1型和基因2型对对虾有感染性,而基因3A型和基因3B型无感染性(Tang et al.,2003,2006)。国家质量监督检验检疫总局于2013年更新了IHHNV检疫的进出口行业标准,规定在入境水生动物的IHHNV检疫中必须进行基因型检测,检出基因1型或基因2型IHHNV均不准入境(SN/T 1673—2013)。目前,基于PCR的多种检测方法已被用于IHHNV检测及其基因分型,其中389F/R和392F/R两对引物能检测IHHNV的4种基因型,可用于初筛;309F/R引物只能扩增IHHNV的基因1型和基因2型,宜用于感染型IHHNV检测;MG831F/R引物只能扩增IHHNV的基因3A型和基因3B型,可用于非感染型IHHNV检测(Tang et al.,2000,2007)。因此,我国IHHNV检测标准(GB/T 25878—2010和SN/T 1673—2013)推荐,使用389F/R引物进行IHHNV检测及采用309F/R或MG831F/R引物区分其感染型。【本研究切入点】在实际检疫工作中,采用389F/R和309F/R两对引物进行IHHNV检测和基因分型时不够敏感,尤其在应对IHHN常规监测及进出口检疫时,抽检样品多是采自健康无临床症状的对虾群体,其中的阳性样品因病毒含量很低而极易造成假阴性,因此急需一种更灵敏且可靠的IHHNV检测及其基因分型方法。【拟解决的关键问题】建立并优化IHHNV检测及其基因分型的套式PCR,为IHHN监测及基因分型提供更敏感、可靠的技术手段;同时确定IHHNV在广西流行的基因型,为有效防控IHHN提供参考依据。
1 材料与方法
1. 1 试验材料
546份2010—2018年收集的IHHNV阳性材料/DNA来自广西沿海对虾养殖场,由广西水产科学研究院水生动物疫病监控中心实验室鉴定并保存。海洋动物组织基因组DNA快速提取试剂盒、2×F8 FastLong PCR MasterMix和DL2000 DNA Marker购自北京艾德莱生物科技有限公司;其他试剂均为国产分析纯。
1. 2 引物设计与合成
从GenBank中下载不同地域IHHNV的序列(4种基因型),采用MegAlign中的ClustalW进行同源性比对分析,在389F/R和309F/R两对引物扩增片段之外的绝对保守区域设计外引物IHHNV-WF/WR,各引物信息见表1,均由生工生物工程(上海)股份有限公司合成。
1. 3 病毒DNA提取
仔虾和幼虾取整只虾或虾头(幼虾需去眼),成虾取鳃和肝胰腺组织。将1.0 g样品放入2 mL灭菌匀浆试管中,经匀浆器匀浆后取30 mg,以海洋动物组织基因组DNA快速提取试剂盒提取总DNA,最后加50.0 μL洗脱缓冲液EB溶解DNA,-20 ℃保存备用。
1. 4 IHHNV套式PCR建立
参考IHHNV-WF/WR引物的退火温度(54.2和54.7 ℃)在50.0~60.0 ℃范围内进行退火温度优化,筛选出最适退火温度;然后在最适退火温度下,对不同引物终浓度(0.1~1.0 μmol/L)进行PCR扩增,确定最佳引物浓度;确定IHHNV第一轮PCR的反应体系及扩增程序。以IHHNV-WF/WR为外引物进行第一轮PCR扩增;以389F/R为内引物,按照GB/T 25878—2010《对虾传染性皮下及造血组织坏死病毒(IHHNV)检测PCR法》进行IHHNV检测;同时以309F/R为内引物,按照SN/T 1673—2013《传染性皮下及造血组织坏死检疫技术规范》进行IHHNV基因分型。
1. 5 套式PCR敏感性验证
将IHHNV阳性DNA进行10倍梯度稀释(100~10-5),取2.0 μL各梯度DNA为模板进行套式PCR(IHHNV-WF/WR为外引物,389F/R和309F/R分别为内引物)和一步法PCR(389F/R引物和309F/R引物直接扩增)检测,对比二者的敏感性。
1. 6 套式PCR临床检测
采用建立的套式PCR(IHHNV-WF/WR为外引物,389F/R为内引物)和一步法PCR(389F/R为引物)同时对100份IHHNV阳性临床样品(强阳性和弱阳性)进行检测,以检验套式PCR的临床实用性。
1. 7 IHHNV广西流行株基因型分析
采用建立的套式PCR(IHHNV-WF/WR为外引物,309F/R为内引物)对546份2010—2018年收集的IHHNV阳性DNA(389F/R引物检测为阳性)进行基因分型,对309F/R引物检测为阴性的样品用MG831F/R引物进行检测,以了解IHHNV广西流行株的基因型。
2 结果与分析
2. 1 IHHNV第一輪PCR扩增反应条件
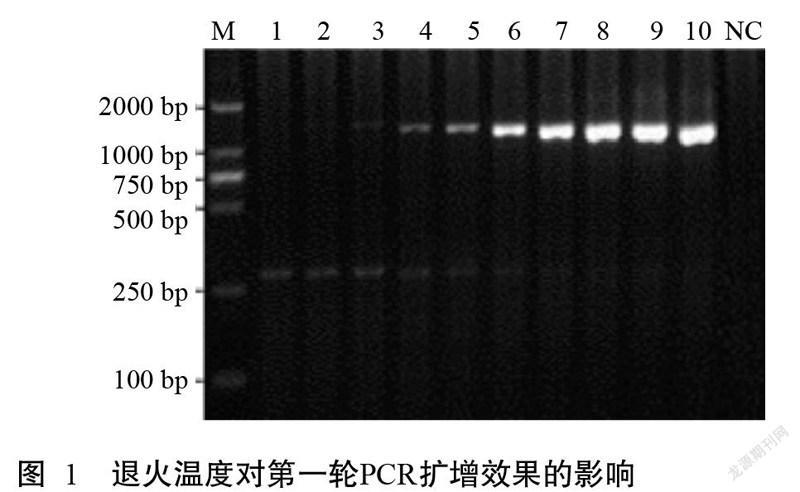
IHHNV-WF/WR引物在退火温度为50.0~60.0 ℃的PCR扩增结果见图1。随退火温度的升高,PCR扩增效率也逐渐提高,退火温度低于56.4 ℃(泳道7)时,其扩增效率较低且有非特异性条带存在;当退火温度为57.4~59.7 ℃(泳道8~10)时,目的基因的扩增效率高且不存在非特异性扩增,故选取59.0 ℃为第一轮PCR的退火温度。比较不同引物浓度的PCR扩增效果,结果(图2)发现引物终浓度低于0.7 μmol/L(泳道7)时,随引物浓度的降低其扩增效率也逐渐下降;当引物终浓度为0.8~1.0 μmol/L(泳道8~10)时,目的基因的扩增效率高且差异不明显,故选取0.8 μmol/L为最佳引物终浓度。优化后的第一轮PCR反应体系20.0 µL:2×F8 FastLong PCR MasterMix 10.0 μL,上、下游引物(20 μmol/L)各0.8 μL,DNA模板2.0 μL,无核酸酶灭菌水补足至20.0 μL。扩增程序:94.0 ℃预变性3 min;94.0 ℃ 10 s,59.0 ℃ 15 s,72.0 ℃ 15 s,进行35个循环;72.0 ℃延伸5 min,4.0 ℃保存备用。
2. 2 套式PCR与一步法PCR的敏感性比较
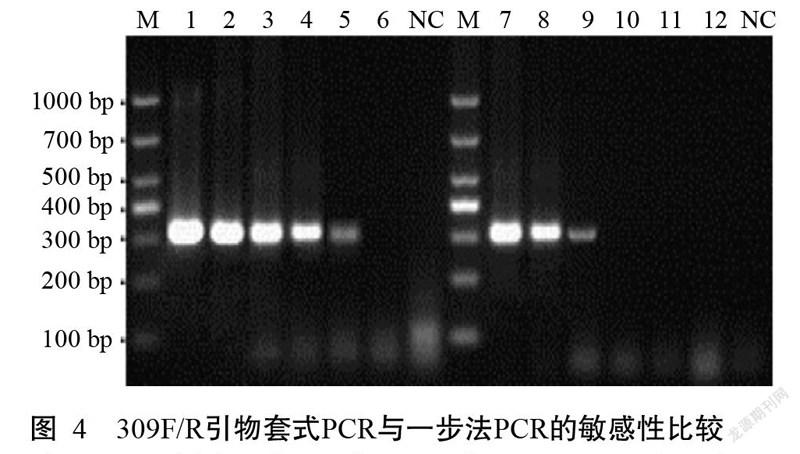
采用套式PCR和一步法PCR同时对10倍梯度稀释的IHHNV阳性DNA(100~10-5)进行检测,结果(图3和图4)显示,套式PCR可检测到10-4稀释度的阳性DNA,而一步法PCR仅检测到10-2稀释度的阳性DNA,说明套式PCR的敏感度较一步法PCR提高100倍。
2. 3 套式PCR的临床检测结果
采用套式PCR和一步法PCR对100份IHHNV阳性临床样品进行检测的结果均呈阳性,符合率达100%;且一步法PCR检测为弱阳性的样品采用套式PCR可获得明亮的电泳条带(图5),说明套式PCR较一步法PCR对目的片段的扩增更高效。
2. 4 IHHNV广西流行株基因型分析结果
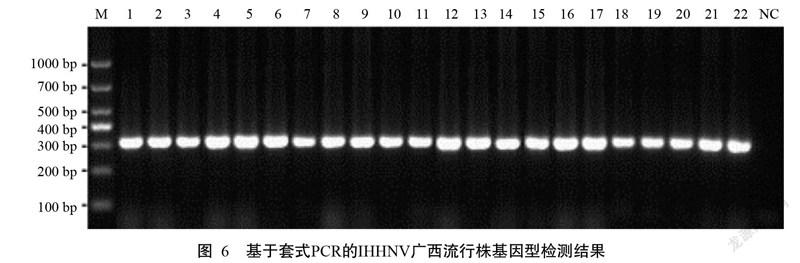
采用建立的套式PCR(IHHNV-WF/WR为外引物、309F/R为内引物)对546份2010—2018年收集的IHHNV阳性DNA进行扩增,结果显示均能扩增获得309 bp的目的条带(图6),说明546株IHHNV广西流行株全部为感染型(基因1型和基因2型)。
3 讨论
自IHHNV被发现以来,其检测方法不断发展更新,已有多种免疫学和分子生物学方法可用于实际生产或相关研究,如ELISA、斑点杂交、PCR、实时荧光定量PCR和LAMP等,这些检测方法各具优缺点。国内现行的IHHNV检测标准(GB/T 25878—2010和SN/T 1673—2013)仍推荐使用PCR,但在实际检测工作中不管是对IHHNV进行检测还是基因分型时,采用现有标准的一步法PCR均暴露出敏感性较弱的缺陷,主要体现在对IHHNV含量低的样品难以检出或条带很弱而无法定论,且易造成假阴性。因此,亟需对现行IHHNV检测标准的PCR进行改进和优化,以满足对低含量IHHNV检测的需求。套式PCR是以第一轮PCR产物为模板进行第二轮扩增,即采用两对特异性引物对目的片段进行两轮扩增,其特异性和灵敏度相对于一步法PCR均得到有效提高。此外,对虾WSSV、对虾黄头病毒(Yellow head disease,YHV)和鲤春病毒血症病毒(Spring viraemia of carp virus,SVCV)等水生动物病原的检测标准均已采用套式PCR(谢数涛等,2001;林婧楠等,2018),说明采用套式PCR检测水生动物病原具有一定优越性。
本研究在以PCR检测IHHNV现有标准的基础上,设计外引物IHHNV-WF/WR,并对第一轮PCR的退火温度和引物浓度进行优化,建立了适用于IHHNV检测(IHHNV-WF/WR为外引物,389F/R为内引物)及基因分型(IHHNV-WF/WR为外引物,309F/R为内引物)的套式PCR,其检测IHHNV的灵敏度较一步法PCR提高100倍;采用套式PCR(IHHNV-WF/WR为外引物,389F/R分别为内引物)对100份IHHNV阳性临床样品进行检测,检测结果与一步法PCR的符合率达100%,且一步法PCR检测为弱阳性的样品采用套式PCR可获得明亮的电泳条带,说明建立的套式PCR应用于IHHNV检测切实可靠,且较一步法PCR的扩增更高效,即对IHHNV含量低的样品进行检测时推荐使用套式PCR。
IHHNV的基因型可分为感染型和非感染型,其中,感染型包括基因1型和基因2型,可感染凡纳滨对虾和斑节对虾等代表性对虾;非感染型包括基因3A型和基因3B型,认为是IHHNV的部分基因片段镶嵌于斑节对虾基因中(Saksmerprome et al.,2010)。本研究采用建立的套式PCR(IHHNV-WF/WR为外引物,309F/R引物为内引物)对546份2010—2018年收集的IHHNV阳性DNA进行检测,结果显示均能扩增获得309 bp的目的条带,表明546株IHHNV广西流行株全部为感染型(基因1型和基因2型)。袁颜颜等(2015)利用4对引物(389F/R、392F/R、77012F/77353R和309F/R)对2011—2012年采自国内不同地区的对虾样品进行IHHNV检测,结果发现所有IHHNV可分为4种PCR检出类型,其中有48份样品以389F/R和309F/R引物均检出阳性(48/49),属于感染型。现有的研究资料表明,IHHNV基因1型分布于美国和东亚地区(主要是菲律宾),基因2型分布于东南亚地区,基因3A型分布于东非地区、印度和澳大利亚,基因3B型分布于印度太平洋地区包括马达加斯加、毛里求斯和坦桑尼亚(Tang et al.,2003,2006)。综合本研究结果可知,国内尚未发现IHHNV非感染型(基因3A型和基因3B型),是否与我国的对虾养殖习惯或现有检测IHHNV非感染型(基因3A型和基因3B型)的引物不理想有关,尚需进一步研究证实。
4 結论
在PCR检测IHHNV现有标准基础上建立的IHHNV检测及基因分型套式PCR,其灵敏度较一步法PCR提高100倍,尤其适用于检测IHHNV含量低的样品,可为疫病监测及进出口检疫提供更敏感的技术手段。当前广西流行的IHHNV均为感染型(基因1型和基因2型)。
参考文献:
白丽蓉,赵志英. 2012. 对虾传染性皮下与造血组织坏死病毒(IHHNV)的研究进展[J]. 中国农学通报,28(14):114-119. [Bai L R,Zhao Z Y. 2012. Research progress of infectious hypodermal and hematopoietic necrosis virus(IHHNV) in penaeid shrimp[J]. Chinese Agricultural Science Bulletin,28(14):114-119.]
邓威,许杰,刘群,韩进刚,李军,刘健,杨凯,张丽. 2017. 2015—2016年天津市对虾传染性皮下及造血组织坏死病毒感染调查[J]. 中国动物检疫,34(9):23-25. [Deng W,Xu J,Liu Q,Han J G,Li J,Liu J,Yang K,Zhang L. 2017. Investigation on Penaeus IHHNV infection in Tianjin City from 2015 to 2016[J]. China Animal Health Inspection,34(9):23-25.]
梁静真,马沙,肖双燕,韩书煜,黄艳华,黄德生,张振豪,吕忠坚,覃志彪,黄钧. 2018. 2013—2016 年广西沿海养殖凡纳滨对虾2种病毒的流行情况调查[J]. 西南农业学报,31(5):1088-1096. [Liang J Z,Ma S,Xiao S Y,Han S Y,Huang Y H,Huang D S,Zhang Z H,Lü Z J,Qin Z B,Huang J. 2018. Epidemiology of two viruses in cultural Penaeus vannamei from Guangxi coastal areas from 2013 to 2016[J]. Southwest China Journal of Agricultural Scien-ces,31(5):1088-1096.]
林婧楠,赵景壮,卢彤岩,徐黎明. 2018. 鲤春病毒血症病毒的研究进展[J]. 水产学杂志,31(5):44-49. [Lin J N,Zhao J Z,Lu T Y,Xu L M. 2018. Research progress on carp spring virernia virus[J]. Chinese Journal of Fisheries,31(5):44-49.]
童桂香,韦信贤,吴伟军,吴祥庆,黄国秋,黄玉柳,叶欣宇,黎小正. 2013. 广西凡纳滨对虾IHHNV感染情况的调查与分析[J]. 南方农业学报,44(12):2089-2093. [Tong G X,Wei X X,Wu W J,Wu X Q,Huang G Q,Huang Y L,Ye X Y,Li X Z. 2013. Investigation and analysis of infectious hypodermal and hematopoietic necrosis virus infection in Penaeus vannamei in Guangxi[J]. Journal of Southern Agriculture,44(12):2089-2093.]
王博雅,王力,刘美如,叶仕根,黎睿君,李华,李强. 2017. 凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析[J]. 大连海洋大学学报,32(2):150-154. [Wang B Y,Wang L,Liu M R,Ye S G,Li R J,Li H,Li Q. 2017. Epidemiological investigation of three major viruses and Enterocytozoon hepatopenaei(EHP) in Pacific white leg shrimp Litopenaeus vannamei in Liaoning Province[J]. Journal of Dalian Ocean University,32(2):150-154.]
王筱珊,胡智博,费荣梅. 2017. 江苏地区对虾3种病毒病的流行病学调查及5株IHHNV的编码区基因序列分析[J]. 水产学报, 41(10):1623-1630. [Wang X S,Hu Z B,Fei R M. 2017. Prevalence of three viruses in Pacific white leg shrimp in Jiangsu Province and the analysis of coding sequence of five strains of infectious hypodermal and hematopoietic necrosis virus[J]. Journal of Fisheries of China,41(10):1623-1630.]
韦信贤,童桂香,谢宗升,吴祥庆,黄国秋,黄玉柳,廖永志,黎小正. 2011. Taq Man-LNA探针荧光定量PCR快速检测对虾传染性皮下及造血组织坏死病毒[J]. 南方农业学报,42(12):1545-1549. [Wei X X,Tong G X,Xie Z S,Wu X Q,Huang G Q,Huang Y L,Liao Y Z,Li X Z. 2011. Rapid detection of infectious hypodermal and hematopoietic necrosis virus in shrimps using Taq Man-LNA probe real-time PCR[J]. Journal of Southern Agriculture,42(12):1545-1549.]
谢数涛,何建国,杨晓明,吕玲,江静波. 2001. 套式PCR检测斑节对虾白斑症病毒(WSSV)[J]. 青岛海洋大学学报,31(2):220-224. [Xie S T,He J G,Yang X M,Lü L,Jiang J B. 2001. Detection of white spot syndrome virus(WSSV) in Penaeus monodon using nested PCR[J]. Journal of Ocean University of Qingdao,31(2):220-224.]
袁颜颜,杨冰,万晓媛,刘笋,刘天齐,黄倢. 2015. 采用OIE标准检测养殖对虾中传染性皮下及造血组织坏死病毒(IHHNV)的PCR检出类型[J]. 渔业科学进展,36(1):67-73. [Yuan Y Y,Yang B,Wan X Y,Liu S,Liu T Q,Huang J. 2015. PCR detecting types by the OIE standards for infectious hypodermal and hematopoietic necrosis virus (IHHNV) in farmed shrimp[J]. Progress in Fishery Scien-ces,36(1):67-73.]
曾地刚,陈秀荔,谢达祥,赵永贞,黎铭,陈晓汉. 2013. 利用高通量测序技术分析IHHNV感染凡纳滨对虾的基因差异表达[J]. 南方农业学报,44(11):1899-1903. [Zeng D G,Chen X L,Xie D X,Zhao Y Z,Li M,Chen X H. 2013. Analysis on differential gene expression in shrimp Litopenaeus vannamei induced by IHHNV infection using high-throughput sequencing[J]. Journal of Southern Agriculture,44(11):1899-1903.]
Motte E,Yugcha E,Luzardo J,Castro F,Leclercq G,Rodriguez J,Miranda P,Borja O,Serrano J,Terreros M. 2003. Prevention of IHHNV vertical transmission in the white shrimp Litopenaeus vannamei[J]. Aquaculture,219(1-4):57-70.
Saksmerprome V,Puiprom O,Noonin C,Flegel T W. 2010. Detection of infectious hypodermal and haematopoietic necrosis virus(IHHNV) in farmed Australian Penaeus monodon by PCR analysis and DNA sequencing[J]. Aquaculture,298(3-4):190-193.
Tang K F J,Lightner D V. 2006. Infectious hypodermal and hematopoietic necrosis virus(IHHNV)-related sequences in the genome of the black tiger prawn Penaeus monodon from Africa and Australia[J]. Virus Research,118(1-2):185-191.
Tang K F J,Navarro S A,Lightner D V. 2007. PCR assay for discriminating between infectious hypodermal and hematopoietic necrosis virus(IHHNV) and virus-related sequen-ces in the genome of Penaeus monodon[J]. Diseases of Aquatic Organisms,74(2):165-170.
Tang K F J,Poulos B T,Wang J,Redman M,Shih H H,Lightner D V. 2003. Geographic variations among infectious hypodermal and hematopoietic necrosis virus(IHHNV) isolates and characteristics of their infection[J]. Di-seases of Aquatic Organisms,53(2):91-99.
Tang K F,Durand S V,White B L,Redman R M,Pantoja C R,Lightner D V. 2000. Postlarvae and juveniles of a selected line of Penaeus stylirostris are resistant to infectious hypodermal and hematopoietic necrosis virus infection[J]. Aquaculture,190(3-4):203-210.
(責任编辑 兰宗宝)
