麻鸭磷脂氢谷胱甘肽过氧化物酶高效可溶性表达及其部分酶学性质
2019-09-10王晶晶张新笑卞欢耿志明李鹏鹏王道营徐为民
王晶晶 张新笑 卞欢 耿志明 李鹏鹏 王道营 徐为民





摘要:【目的】克隆麻鸭磷脂氢谷胱甘肽过氧化物酶基因(GPx4)并在大肠杆菌中表达,分析其酶学特性,为研究GPx4功能及其在羟基脂肪酸形成过程中的调节机制打下基础。【方法】采用RT-PCR克隆麻鸭GPx4(DGPx4)的编码基因,利用定点突变的方法构建半胱氨酸突变体DGPx4表达载体pMBP-DGPx4(48Sec→Cys),并在大肠杆菌中通过添加His标签进行可溶性表达,经Ni-NTA亲和层析和离子交换层析纯化得到融合蛋白DGPx4;采用总谷胱甘肽过氧化物酶活性检测试剂盒检测DGPx4活力以研究其酶学性质。【结果】克隆获得的DGPx4基因编码序列全长516 bp,编码172个氨基酸,编码蛋白分子量约20 kD,理论等电点(pI)为8.9。构建的突变体基因原核表达载体pMBP-DGPx4(48Sec→Cys)可在大肠杆菌中成功诱导表达获得融合蛋白DGPx4,经Ni-NTA亲和层析和离子交换层析即获得高纯度的DGPx4。以烟酰胺腺嘌呤二核苷酸磷酸(NADPH)为底物时,DGPx4的最适反应温度为32 ℃,最适pH为8.0,对NaCl浓度较敏感;Cu2+和Ni2+对DGPx4活力有较高的促进作用,Mg2+和Mn2+对DGPx4活力有一定的抑制作用,Ca2+和Zn2+对DGPx4活力则無明显的促进或抑制作用。【结论】从鸭肝细胞中克隆获得的DGPx4基因序列经定点突变后可在原核细胞中高效表达,且纯化后的高纯度融合蛋白DGPx4具有GPx4活力,能在抗脂质氧化过程中发挥作用。
关键词: 麻鸭;磷脂氢谷胱甘肽过氧化物酶(GPx4);原核表达;纯化;酶学性质
中图分类号: S843.83 文献标志码: A 文章编号:2095-1191(2019)05-1120-07
Abstract:【Objective】The shelduck phospholipid hydroperoxide glutathione peroxidase gene(GPx4) was cloned and expressed in Escherichia coli, and its enzymatic properties were analyzed, which laid a foundation for preliminary study of GPx4 function and its regulation mechanism in the formation of hydroxy fatty acids. 【Method】Shelduck GPx4(DGPx4) encoded gene was cloned by RT-PCR, and site-directed mutation was used to established cysteine mutant DGPx4 expression vector pMBP-DGPx4(48Sec→Cys). His tag was added into E. coli to achieve soluble expression. Fusion protein DGPx4 was obtained by Ni-NTA affinity chromatography and ion exchange chromatography purification. DGPx4 activity and the enzymatic properties were measured by total glutathione peroxidase activity assay kit. 【Result】The results showed that the obtained DGPx4 gene coding sequence was 516 bp in length and encoded 172 amino acids. The encoded protein had a molecular weight of approximately 20 kD and a theoretical isoelectric point (pI) of 8.9. The constructed mutant gene prokaryotic expression vector pMBP-DGPx4(48Sec→Cys) was successfully induced to express the fusion protein DGPx4 in Escherichia coli, and high purity DGPx4 was obtained by Ni-NTA affinity chromatography and ion exchange chromatography. When nicotinamide adenine dinucleotide phosphate(NADPH) was used as the substrate, the optimum reaction temperature for DGPx4 was 32 ℃, and the optimum pH was 8.0, and sensitive to NaCl concentration. Cu2+ and Ni2+ could activate the activity of DGPx4, Mg2+ and Mn2+ inhibited its activity, while Ca2+ and Zn2+ had no obvious effect on DGPx4 activity. 【Conclusion】The DGPx4 gene sequence cloned from duck liver cells can be highly expressed in prokaryotic cells after site-directed mutagenesis, and the purified high-purity fusion protein DGPx4 has GPx4 activity and can play a role in anti-lipid oxidation.
Key words: shelduck; phospholipid hydroperoxide glutathione peroxidase(GPx4); prokaryotic expression; purification; enzymatic properties
0 引言
【研究意义】磷脂氢谷胱甘肽过氧化物酶(Phospholipid hydroperoxide glutathione peroxidase,PHGPx,GPx4)是一种广泛存在于细胞线粒体、微粒体、细胞质和细胞核中的含硒酶(张丹丹等,2012),能特异性还原氢过氧化的磷脂和脂肪酸等,降低脂质过氧化程度,防止细胞膜过氧化损伤,维持细胞的正常功能(施力光等,2012;冯凯等,2016;杨杰等,2017)。此外,在食品加工过程中GPx4参与食物羟基亚油酸(Hydroxyoctadecaenoicacids,HODEs)的形成,当人体过多摄入HODEs会明显提高动脉硬化、癌症等疾病的发生概率(Jira et al.,1998;Choque et al.,2014;Vangaveti et al.,2014)。因此,加強GPx4诱导表达、纯化和酶学性质研究,对揭示其调控调节机制具有重要意义。【前人研究进展】至今,有关PHGPx或GPx4的研究国内外已有较多报道(Scheerer et al.,2007;闫春燕等,2008;蔡丝丝等,2014)。赵文然等(2004)利用定点突变将人类GPx4编码基因中编码硒半胱氨酸(Sec)的密码子UGA突变为编码半胱氨酸(Cys)的UGU,并利用大肠杆菌进行诱导表达,结果成功制备出可用于鉴定GPx4的多克隆抗体。李甜等(2010)利用大肠杆菌表达系统诱导表达出萝卜PHGPx,并证实其能快速清除多种脂类过氧化物,主要通过抑制细胞膜脂质过氧化损伤而发挥作用。李洋等(2010)利用毕赤酵母细胞表达结合酸铵分级沉淀、脱盐柱脱盐、凝胶过滤等步骤纯化获得萝卜PHGPx,并证实其具有依赖于谷胱甘肽(GSH)的还原活性。刘冠兰(2010)也利用大肠杆菌表达和纯化获得含有GST融合标签的萝卜PHGPx,并通过体外试验证实萝卜PHGPx可有效降低细胞内的活性氧水平,抑制氧化胁迫下的细胞凋亡,该结论可为PHGPx基因表达分子调控研究提供一定的理论依据。Wang等(2012)从大马哈鱼的嗅觉组织中克隆获得两种GPx4亚型(GPx4a和GPx4b),并比较二者在嗅觉和肝脏组织中的调节作用。蔡丝丝等(2014)通过综述PHGPx在精子发育和成熟中的作用,认为PHGPx活性是评价精液品质的重要参数之一。刘春云等(2015)研究表明,拟穴青蟹PHGPx可能在免疫防御反应及精巢的发育和成熟等过程中发挥重要作用。冯凯等(2016)利用RACE克隆获得的山参PHGPx基因全长序列具有3个真核生物PHGPx特有的保守亚结构域,其编码蛋白为跨膜亲水性稳定蛋白质,与柑橘、蓖麻等PHGPx氨基酸序列同源性分别为76%和75%。【本研究切入点】GPx4不仅在保护细胞免受过氧化损伤中发挥重要作用,还在食物有害物质羟基脂肪酸的形成过程中起重要作用,但目前针对禽类GPx4基因表达及其酶学性质的研究尚无文献报道。【拟解决的关键问题】通过对麻鸭GPx4进行体外表达纯化,并在此基础上分析温度、pH、NaCl浓度及金属离子对麻鸭GPx4活力的影响,为进一步研究GPx4功能及其在羟基脂肪酸形成过程中的调节机制打下基础。
1 材料与方法
1. 1 试验材料
谷胱甘肽过氧化物酶检测试剂盒购自南京碧云天生物技术有限公司;酵母提取物和胰蛋白胨购自英国Oxoid公司;大肠杆菌DH5α感受态细胞购自南京擎科生物科技有限公司;pMBP表达载体由南京农业大学肉品加工与质量控制教育部重点实验室保存提供;质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;异丙基β-D-硫代半乳糖苷(IPTG)、氨苄青霉素和卡那霉素购自生工生物工程(上海)股份有限公司;Taq DNA聚合酶、pMD19-T载体、反转录试剂盒、限制性内切酶和T4 DNA连接酶购自TaKaRa公司。主要设备仪器:UV-6100型分光光度计(普析通用)、Mini-PROTEAN Tetra Cell电泳仪(BIO-RAD)、BioTek Synergy2多功能酶标仪、Tanon-1600全自动凝胶成像分析仪和AKTA蛋白纯化系统(GE Healthcare)。
1. 2 麻鸭GPx4基因(DGPx4)克隆
以去掉信号肽的DGPx4基因序列为模板,运用Primer Premier 5.0设计特异性引物[F:5'-CGCGGA TCCATGCGGAGAATGT-3'(下划线为BamHⅠ酶切位点);R:5'-AACGTCGACCAGGTAGGCGGGCA-3'(下划线为SalⅠ酶切位点)],由南京擎科生物科技有限公司合成。以麻鸭肌肉cDNA为模板进行PCR扩增,反应体系20.0 μL:cDNA模板 1.0 μL,上、下游引物各0.8 μL,2×Taq Master Mix 10.0 μL,ddH2O 7.4 μL。扩增程序:98 ℃预变性2 min;98 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s,进行35个循环;72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳进行检测,并采用试剂盒纯化回收目的条带。
1. 3 重组表达载体pMBP-DGPx4构建
参照张玉梅等(2018)的方法,在37 ℃下采用BamHⅠ和SalⅠ酶切pMBP表达载体及扩增获得的DGPx4基因2 h,将酶切产物进行切胶纯化回收后,用T4连接酶连接(4 ℃,过夜)。将重组质粒转化至DH5α感受态细胞后进行菌液PCR鉴定,筛选出阳性重组质粒并送至生工生物工程(上海)股份有限公司测序。
1. 4 半胱氨酸突变体DGPx4表达载体pMBP-DGPx4(48Sec→Cys)构建
采用QuickChange的方法将pMBP-DGPx4中第48位Sec突变为Cys。定点突变是通过设计引物,并利用PCR将模板扩增出来,然后去掉模板,即获得已突变成功的产物,经转化、筛选、测序确定。设计引物F(5'-CGTGGCGTACAAATGCGGAAAGACCGC GGT-3')和R(5'-ACCGCGGTCTTTCCGCATTTGTA CGCCACG-3'),引物由南京擎科生物科技有限公司合成,引物稀释到10 mmol/L备用。点突变反应体系50.0 μL:重组表达载体pMBP-DGPx4 1.0 μL,上、下游引物各1.5 μL,2×Phanta Max Master Mix 25.0 μL,ddH2O 21.0 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,56 ℃ 15 s,68 ℃ 4 min,进行30个循环;72 ℃延伸5 min。突变产物采用琼脂糖凝胶DNA回收试剂盒进行回收,并用Dpn I酶切去甲基化,以清除DNA模板,反应体系50.0 μL:质粒40.0 μL,Dpn I酶1.0 μL,10×Dpn I 酶缓冲液5.0 μL,ddH2O 4.0 μL。置于37 ℃水浴锅中反应3 h,将其全部转化DH5α感受态细胞后提取质粒,送至生工生物工程(上海)股份有限公司测序,测序正确的重组质粒命名为pMBP-DGPx4(48Sec→Cys),-20 ℃保存备用。
1. 5 融合蛋白原核表达及可溶性分析
参照张玉梅等(2018)的方法,将鉴定正确的重组质粒转化至大肠杆菌Transetta2感受态细胞,挑取单菌落接种至5 mL含卡那霉素的LB培养基中,37 ℃下振荡(200 r/min)培养,当菌液浓度OD600 nm为0.6~0.8时,加入IPTG至终浓度为0.25 mmol/L,22 ℃下诱导(200 r/min)过夜。离心收集沉淀,按1∶5的比例加入缓冲液(20 mmol/L磷酸盐,120 mmol/L NaCl,pH 7.6)重悬菌体,置于超声波细胞破碎仪上破碎10 min(功率80 W,φ2,超声波1 s,停3 s),取40.0 μL作为总菌,4 ℃下12000 r/min离心5 min,分别取出上清液和沉淀,加入10.0 μL SDS-PAGE上样缓冲液,用12% SDS-PAGE进行分析,设不加IPTG诱导的菌液为对照。
1. 6 融合蛋白诱导表达及纯化
参照张玉梅等(2018)的方法,将上述鉴定能可溶性表达的菌落接种于1 L含卡那霉素的LB液体培养基中进行诱导表达,4000 r/min离心20 min,收集菌体,用磷酸盐缓冲液重悬菌体,冰浴条件下超声波破碎30 min(功率180 W,超声波1 s,停3 s)后,4 ℃下12000 r/min离心20 min,收集上清液。镍柱平衡后将上清液加入镍亲和层析柱中,用不同浓度的咪唑洗脱液洗脱并收集,初步纯化蛋白,取样液加入SDS-PAGE上样缓冲液,用12% SDS-PAGE检测融合蛋白的表达情况。将较纯的样品用10 kD超滤管离心进行浓缩(4 ℃,4000 r/min),以离子交换层析进一步纯化,再采用SDS-PAGE检测纯化产物并浓缩;用BCA法测定蛋白浓度,分装后置于-80 ℃保存。
1. 7 DGPx4活力测定及酶学性质研究
DGPx4活力以总谷胱甘肽过氧化物酶活性检测试剂盒进行检测(Peng et al.,2012)。GPx可催化GSH產生氧化型GSH(GSSG),而GSH还原酶可利用烟酰胺腺嘌呤二核苷酸磷酸(NADPH)催化GSSG产生GSH,通过检测NADPH的减少量可计算出GPx的活力水平。由于NADPH在340 nm处有最大吸收,随NADPH的逐渐消耗,在340 nm 处的吸光值将逐渐降低,因此通过检测NADPH消耗量,即可检测GPx4活力。
1. 7. 1 最适温度 分别在15、20、27、32、37和47 ℃下测定DGPx4活力,设酶活力最高值为100%,计算各温度下的相对酶活力。
1. 7. 2 最适pH 分别配制0.05 mol/L的柠檬酸—柠檬酸三钠缓冲液(pH 4.5和6.0)、磷酸氢二钠—磷酸二氢钠缓冲液(pH 7.5和8.0)和甘氨酸—氢氧化钠缓冲液(pH 9.0和9.6)。设酶活力最高值为100%,测定并计算各pH下的相对酶活力。
1. 7. 3 NaCl添加量 分别配制0、1%、2%、3%、4%和5%的NaCl。设酶活力最高值为100%,测定并计算不同NaCl添加量下的相对酶活力。
1. 7. 4 金属离子 分别配制0.2 mol/L的Ca2+、Mg2+、Mn2+、Zn2+、Cu2+和Ni2+溶液,按酶活力测定方法依次加入183.0 μL检测缓冲液、2.0 μL酶液、11.0 μL GPx检测工作液,混匀后加入4.0 μL的15 mmol/L过氧化物溶液,最后加入2.0 μL不同金属离子溶液,混匀,测定340 nm处的吸光值。设不加酶液为空白对照。
2 结果与分析
2. 1 DGPx4基因全长克隆及序列分析结果
以麻鸭骨骼肌细胞cDNA为模板,PCR扩增获得DGPx4编码基因全长516 bp(图1),扩增条带大小与预期结果相符。序列分析结果表明,DGPx4基因编码172个氨基酸,编码蛋白分子量约20 kD,理论等电点(pI)为8.9。
2. 2 DGPx4基因及其突变体基因原核表达载体的构建
采用限制性内切酶BamHⅠ和SalⅠ对pMBP表达载体和扩增获得的DGPx4基因及其突变体基因进行酶切和连接,以获得重组质粒。重组质粒经菌落PCR和酶切鉴定,结果获得约500 bp的片段(图2和图3),与DGPx4基因大小相符。进一步的测序结果证实,插入位置、阅读框及重组基因序列均准确无误,表明DGPx4基因已成功克隆至pMBP表达载体中,突变重组表达质粒构建成功,命名为pMBP-DGPx4(48Sec→Cys)。由于DGPx4基因编码区内有编码Sec的密码子UGA,在原核生物中无法正常翻译该密码子,而导致蛋白翻译过程终止,因此需将该密码子突变为UGC,即将Sec突变为Cys,确保蛋白翻译过程正常进行,构建成功后测序读码框内的序列也完全正确。
2. 3 DGPx4融合蛋白诱导表达及可溶性检测结果
由图4可看出,第4泳道(未加IPTG诱导剂)重组菌在预期位置未出现明显的表达条带,第3泳道则获得高效表达的可溶性融合蛋白条带,目的条带大小约60 kD(DGPx4融合蛋白20 kD,pMBP表达载体40 kD),与预期结果一致。
2. 4 DGPx4融合蛋白的纯化
2. 4. 1 DGPx4融合蛋白的初步纯化 由于DGPx4融合蛋白N-端带有His标签,首先采用Ni-NTA进行亲和层析纯化,收集不同浓度咪唑洗脱液得到的组分,再进行SDS-PAGE检测,结果(图5)显示,20、50、100 mmol/L咪唑洗脱可去除较多杂蛋白,经250 mmol/L咪唑洗脱可得到较纯的DGPx4融合蛋白,说明Ni-NTA亲和层析能有效纯化获得DGPx4融合蛋白。收集100和250 mmol/L咪唑的洗脱液,用分子截留量为10 kD的超滤离心管进行浓缩,为下一步离子层析做准备。
2. 4. 2 DGPx4融合蛋白的离子交换层析 Ni-NTA亲和层析样品经离子交换层析柱纯化后得到1个洗脱峰(图6),收集后采用12% SDS-PAGE进行检测,结果显示在60 kD附近出现1条目的条带(图7),与预期结果一致。将收集的洗脱峰浓缩后用BCA法测定蛋白浓度,分装后-80 ℃保存备用。
2. 5 DGPx4的酶学性质
2. 5. 1 温度对DGPx4活力的影响 由图8可看出,随反应温度的升高,DGPx4活力呈先上升后下降的变化趋势,最适反应温度为32 ℃;当温度上升至37 ℃时,DGPx4活力下降至最适温度下酶活力的50%以下;而温度达47 ℃时酶活力基本为0,表明DGPx4对热较敏感。
2. 5. 2 pH对DGPx4活力的影响 由图9可看出,在pH 4.5~8.0间DGPx4的活力逐渐增加,在pH 8.0下酶活力达最大值,之后随pH的升高而降低,当pH达9.6时,DGPx4活力已不足30%。可见,环境过酸或过碱均不利于DGPx4催化反应的进行。
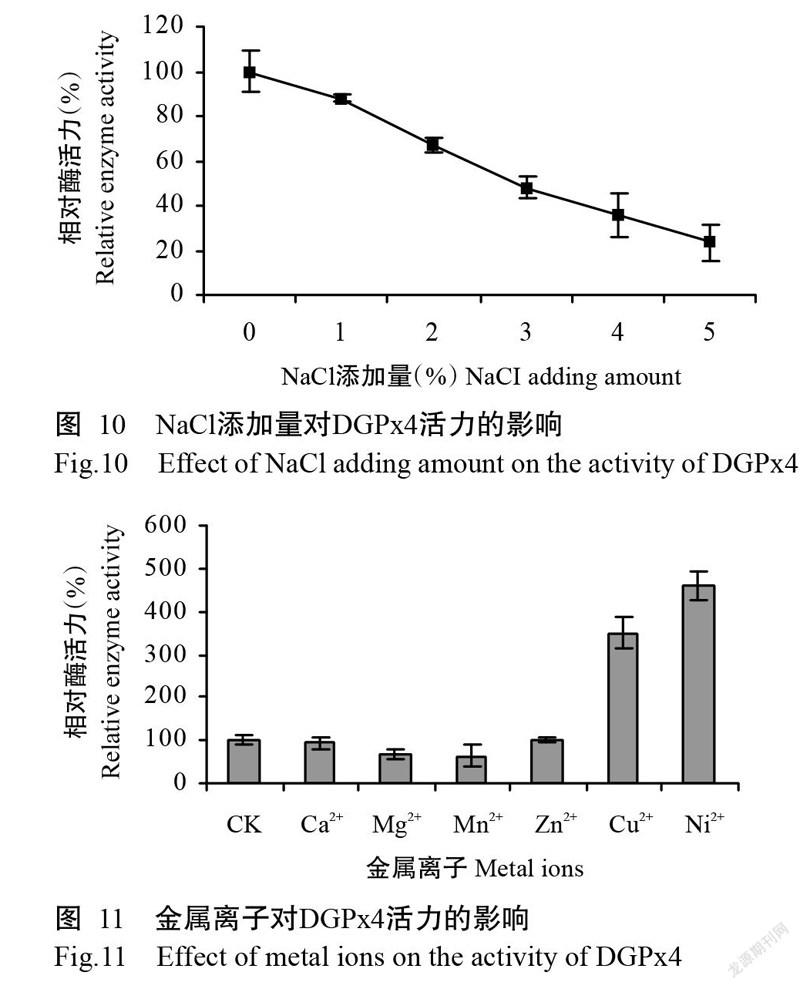
2. 5. 3 NaCl添加量对DGPx4活力的影响 由图10可看出,NaCl添加量为3%时的相对酶活力约50%,当NaCl添加量达5%时相对酶活力下降至20%左右,说明DGPx4对NaCl浓度较敏感。
2. 5. 4 金属离子对DGPx4活力的影响 由图11可看出,Cu2+和Ni2+对DGPx4活力有较高的促进作用,Mg2+和Mn2+对DGPx4活力有一定的抑制作用,Ca2+和Zn2+对DGPx4活力则无明显的促进或抑制作用。
3 讨论
麻鸭是我国鸭子的祖先之一,属于野生鸭子种类,其肌肉中蛋白含量16%~25%,脂肪含量适中,约7.5%,且脂肪酸中含有不饱和脂肪酸和短链饱和脂肪酸,富含烟酸,对心肌梗死等心脏疾病患者具有保护作用。麻鸭在加工储藏过程中极易发生脂质氧化,适度氧化对麻鸭风味及品质产生良性影响,但过度氧化会影响食品的风味及营养价值,而GPx4在抗脂质氧化过程中发挥重要作用(Jostarndt et al.,2002;张超等,2017)。GPx4是目前已知唯一能直接作用于脂质氢过氧化物的含硒谷胱甘肽过氧化物酶,其单体结构有助于其与细胞膜上的氢氧化物结合并进行反应,从而保护细胞膜免受过氧化损伤(Imai and Nakagawa,2003;Yant et al.,2003)。近年来的研究表明,在人类精子发育的最后阶段GPx4將转化为精子后端的结构蛋白,在精子成熟过程中发挥重要作用;且GPx4在线粒体凋亡途径中可减少线粒体产生的过氧化氢物质,在细胞凋亡过程中起决定性作用(闫春燕等,2008)。此外,氢过氧化脂质在食品加工过程中随产品加工周期的延长而不断上升(Song et al.,2016),且氢过氧化脂质的摄入会增加人体动脉硬化等疾病的发生风险(Jira et al.,1998;Choque et al.,2014;Vangaveti et al.,2014),而GPx4在脂质氢过氧化物的产生中扮演着重要角色。
尽管目前已认识到GPx4在肉品加工中的潜在应用价值,但从鸭肉中直接获得纯GPx4成本高且后期纯化难。为了更好地研究鸭肉加工和贮藏过程中风味物质的产生机理和途径,既保留风味物质又能保持鸭肉加工过程中的品质和营养价值,本研究以鸭肉为原料,采用RT-PCR克隆GPx4的编码基因,经原核诱导表达和提取纯化后对其酶学性质进行研究,以期为鸭肉制品的加工和贮藏提供技术支持。GPx4活性中心是由氨基酸残基Gln、Trp联合Sec组成的三联体催化结构,其中,Sec是由终止密码子UGA编码,但在大肠杆菌中无法进行蛋白表达,因此本研究通过定点突变的方法将Sec突变为Cys,然后在大肠杆菌中诱导表达。在进行GPx4原核表达时,本课题组发现DGPx4在大肠杆菌中主要以包涵体形式存在,其氨基酸无法形成正确的空间结构,而影响蛋白活性及后续研究与应用。经多次试验发现,以麦芽糖结合蛋白(Maltose binding protein,MBP)作为分子伴侣蛋白与DGPx4融合表达,可有效解决蛋白以包涵体形式在大肠杆菌中表达的问题,因此,本研究将MBP编码基因malE通过基因重组技术导入普通表达载体中,结果成功构建了能大量表达可溶性目的蛋白的载体pMBP-DGPx4(48Sec→Cys)。
4 结论
从鸭肝细胞中克隆获得的DGPx4基因序列经定点突变后可在原核细胞中高效表达,且纯化后的高纯度融合蛋白DGPx4具有GPx4活力,能在抗脂质氧化过程中发挥作用。
参考文献:
蔡丝丝,刘金,王林川,陈芳艳. 2014. 磷脂氢谷胱甘肽过氧化物酶在精子发育中的作用研究进展[J]. 广东农业科学,41(16):116-119. [Cai S S,Liu J,Wang L C,Chen F Y. 2014. Review on the function of phospholipid hydropero-xide glutathione peroxidase in sperm development[J]. Guangdong Agricultural Sciences,41(16):116-119.]
馮凯,李胜,麻锐,姜锐,孙立伟,陈伟. 2016. 山参磷脂氢谷胱甘肽过氧化物酶cDNA克隆及序列分析[J]. 食品工业科技,37(11):152-155. [Feng K,Li S,Ma R,Jiang R,Sun L W,Chen W. 2016. Cloning and sequence analysis of wild ginseng phospholipid hydroperoxide glutathione peroxidase cDNA[J]. Science and Techonology of Food Industry,37(11):152-155.]
李甜,刘冠兰,段明星,余世实,刘进元,严泽民,徐之伟. 2010. 原核表达的萝卜PHGPx对黑色素瘤B16细胞紫外辐射损伤的恢复作用[J]. 中国生物工程杂志,30(2):66-70. [Li T,Liu G L,Duan M X,Yu S S,Liu J Y,Yan Z M,Xu Z W. 2010. Effects of prokaryotic expressed ra-dish phospholipid hydroperoxide glutathione peroxidase on restoration of B16 melanoma cells irradiated with ultro-violet[J]. China Biotechnology,30(2):66-70.]
李洋,李晖,祝建波,刘进元. 2010. 重组萝卜磷脂氢谷胱甘肽过氧化物酶在毕赤酵母优化表达初步纯化与鉴定[J]. 中国生物工程杂志,30(4):54-59. [Li Y,Li H,Zhu J B,Liu J Y. 2010. Optimized expression and identification of the radish phospholipid hydrogen glutathione peroxidase in pichia pastoris[J]. China Biotechnology,30(4):54-59.]
刘春云,傅明骏,张子平,邹志华,贾锡伟,王艺磊. 2015. 拟穴青蟹PHGPx基因的克隆及其表达分析[J]. 水产学报,39(2):161-173. [Liu C Y,Fu M J,Zhang Z P,Zou Z H,Jia X W,Wang Y L. 2015. Molecular cloning and expre-ssion analysis of Sp-PHGPx in Scylla paramamosain[J]. Journal of Fisheries of China,39(2):161-173.]
刘冠兰. 2010. 萝卜磷脂氢谷胱甘肽过氧化物酶的抗氧化功能研究[D]. 北京:清华大学. [Liu G L. 2010. Study about the antioxidant function of radish phospholipid hydropero-xide glutathione peroxidase[D]. Beijing:Tsinghua University.]
施力光,荀文娟,周汉林,侯冠彧,岳文斌,张春香,杨茹洁. 2012. 山羊磷脂氢谷胱甘肽过氧化物酶生物信息学分析[J]. 生物技术通报,(12):106-113. [Shi L G,Xun W J, Zhou H L,Hou G X,Yue W B,Zhang C X,Yang R J. 2012. Bioinformatis analysis of PHGPx gene in goat[J]. Biotechnology Bulletin,(12):106-113.]
闫春燕,徐承水,张士璀. 2008. 动物磷脂氢谷胱甘肽过氧化物酶研究进展[J]. 科技信息(科学教研),(22):366. [Yan C Y,Xu C S,Zhang S C. 2008. Research progress on animal phospholipid hydrogen glutathione peroxidase[J]. Science and Technology Information(Science Tea-ching and Research),(22):366.]
杨杰,潘孝青,赵艳红,宋丹丹,秦枫,邵乐,李健,张霞,张琳琳,王菁,潘翠玲. 2017. 硒对新西兰兔皮肤抗氧化性及GPx4、EGFR蛋白表达的影响[J]. 江苏农业学报,33(1):133-140. [Yang J,Pan X Q,Zhao Y H,Song D D,Qin F,Shao L,Li J,Zhang X,Zhang L L,Wang J,Pan C L. 2017. Effects of selenium on skin antioxidant and expre-ssion of GPx4 and EGFR proteins in New Zealand rabbit[J]. Jiangsu Journal of Agricultural Sciences,33(1):133-140.]
张超,白璐,阳刚,宋旭,殷中琼,邹元峰,魏琴,杜永华. 2017. 柠檬酵素对麻鸭免疫器官指数和抗氧化功能的影响[J]. 河南农业大学学报,51(5):667-671. [Zhang C,Bai L,Yang G,Song X,Yin Z Q,Zou Y F,Wei Q,Du Y H. 2017. Effects of lemon enzyme on immune organ index and antioxidant capacity of hemp ducks[J]. Journal of Henan Agricultural University,51(5):667-671.]
张丹丹,娄鹏博,李振. 2012. GPxs家族的研究进展[J]. 农业技术与装备,(15):66-67. [Zhang D D,Lou P B,Li Z. 2012. The progress of GPxs[J]. Agricultural Technology and Equi-pment,(15):66-67.]
张玉梅,李鹏鹏,张牧焓,王晶晶,王道营,徐为民. 2018. 麻鸭HSP90α基因的原核表达、纯化及磷脂结合活性的鉴定[J]. 食品科学,39(2):99-104. [Zhang Y M,Li P P,Zhang M H,Wang J J,Wang D Y,Xu W M. 2018. Prokaryotic expression,purification and identification of phospholipid binding activity of Anas platyrhynchas HSP90α[J]. Food Science,39(2):99-104.]
赵文然,周令望,刘艺,钟学宽. 2004. 磷脂氢谷胱甘肽过氧化物酶的克隆及在大肠埃希菌中的表达[J]. 中华地方病学杂志,23(2):119-120. [Zhao W R,Zhou L W,Liu Y,Zhong X K. 2004. Cloning and expression of human phospholipid hydroperoxide glutathione peroxidase in Escherichia coli[J]. Chinese Jouranl of Endemiology,23(2):119-120.]
Choque B,Catheline D,Rioux V,Legrand P. 2014. Linoleic acid:Between doubts and certainties[J]. Biochimie,96:14-21.
Imai H,Nakagawa Y. 2003. Biological significance of phospholipid hydroperoxide glutathione peroxidase(PHGPx,GPx4) in mammalian cells[J]. Free Radical Biology & Medicine,34(2):145-169.
Jira W,Spiteller G,Carson W,Schramm A. 1998. Strong increase in hydroxy fatty acids derived from linoleic acid in human low density lipoproteins of atherosclerotic patients[J]. Chemistry and Physics of Lipids,91(1):1-11.
Jostarndt K,Gellert N,Rubic T,Weber C,Kühn H,Johansen B,Hrboticky N,Neuzil J. 2002. Dissociation of apoptosis induction and CD36 upregulation by enzymatically modified low-density lipoprotein in monocytic cells[J]. Biochemical and Biophysical Research Communications,290(3):988-993.
Peng D,Belkhiri A,Hu T,Chaturvedi R,Asim M,Wilson K T,Zaika A,El-Rifai W. 2012. Glutathione peroxidase 7 protects against oxidative DNA damage in oesophageal cells[J]. Gut,61(9):1250-1260.
Scheerer P,Borchert A,Krauss N,Wessner H,Gerth C,Höhne W,Kuhn H. 2007. Structural basis for catalytic activity and enzyme polymerization of phospholipid hydropero-xide glutathione peroxidase-4(GPx4)[J]. Biochemistry,46(31):9041-9049.
Song H,Wu H H,Geng Z M,Sun C,Ren S,Wang D Y,Zhang M H,Liu F,Xu W M. 2016. Simultaneous determination of 13-HODE,9,10-DHODE,and 9,10,13-THODE in cured meat products by LC-MS/MS[J]. Food Science,9(10):2832-2841.
Vangaveti V N,Shashidhar V M,Rush C,Malabu U H,Rasa-lam R R,Collier F,Baune B T,Kennedy R L. 2014. Hydroxyoctadecadienoic acids regulate apoptosis in human THP-1 cells in a PPARγ-dependent manner[J]. Lipids,49(12):1181-1192.
Wang L,Harris S M,Espinoza H M,Mcclain V,Gallagher E P. 2012. Characterization of phospholipid hydroperoxide glutathione metabolizing peroxidase(GPx4) isoforms in Coho salmon olfactory and liver tissues and their modulation by cadmium[J]. Aquatic Toxicology,114-115:134-141. doi: 10.1016/j.aquatox.2012.02.025.
Yant L J,Ran Q,Rao L,van Remmen H,Shibatani T,Belter J G,Motta L,Richardson A,Prolla T A. 2003. The selenoprotein GPx4 is essential for mouse development and protects from radiation and oxidative damage insults[J]. Free Radical Biology & Medicine,34(4):496-502.
(責任编辑 兰宗宝)
