菜心小孢子培养体系的优化
2020-08-09赵艳艳牛刘静原玉香魏小春杨双娟王志勇张晓伟张衍荣
赵艳艳 牛刘静 原玉香 魏小春 杨双娟 王志勇 张晓伟 张衍荣


摘 要:为了优化菜心小孢子培养体系,以10个菜心品种为试材进行小孢子培养,研究基因型、不同培养基配方和植物生长调节剂对小孢子胚诱导率的影响。结果表明,基因型是决定菜心品种能否出胚的一个重要因素,且不同基因型试材间小孢子胚诱导率具有明显差异,其中‘Cx1‘Cx6‘Cx8经过小孢子培养后较易获得胚状体,而其他材料则没有获得胚状体,基因型的不同导致胚状体诱导率在0~2.10胚·蕾-1之间;同一基因型,在不同培养基成分诱导条件下,添加活性炭对小孢子胚状体诱导率的影响较大,胚诱导率在0.03~2.10胚·蕾-1之间;培养基中蔗糖质量浓度为130 g·L-1时,‘Cx1的胚诱导率最高;此外,在培养基中添加0.05 mg·L-1 6-BA和0.5 mg·L-1 NAA可以显著提高菜心‘Cx1胚状体诱导率。
关键词:菜心;小孢子培养;胚状体
中图分类号:S634.5 文献标志码:A 文章编号:1673-2871(2020)07-034-05
Abstract:In order to optimize microspore culture system of flowering Chinese cabbage, 10 cultivars of Brassica campestris L. ssp. chinensis L. var. utilis Tsen et Lee were used for microspore culture. The effects of genotypes, different culture medium and plant growth regulator on microspore embryogenesis were studied. The results showed that genotype were one of the greatest effects on embryos induction rate, the induction frequencies of embryo were extremely different in the same culture condition, ‘Cx1,‘Cx6,‘Cx8was easier to obtain embryos, but the other materials did not obtain embryos. The induction rate of embryos was between 0-2.10 embryoid each bud due to the difference of genotypes. Same genotype under the condition of different medium components, especially the addition of activated carbon had the greatest effect on the induction rate of embryos, between 0.03-2.10 embryoid each bud. When sucrose concentration was 130 g·L-1 in the culture medium, the embryo induction rate of microspore culture was the highest. Furthermore, the rate of embryos induction of ‘Cx1was significantly increased by adding 0.05 mg·L-1 6-BA and 0.5 mg·L-1 NAA to the medium.
Key words: Flowering Chinese cabbage; Microspore culture; Embryoid
菜心(Brassica campestris L. ssp. chinensis L. var. utilis Tsen et Lee)又称菜薹,在广东省分布广、栽培面积大、复种指数也比较高,近几年在河南、宁夏、广西、福建、海南等地也有大面积的种植。菜心是河南省供港蔬菜基地出口的重要蔬菜种类之一,在西华、安阳、荥阳、许昌等地都有大规模种植,带动了周边农民增收致富[1]。但是菜心种质资源匮乏,适宜多地种植的优良菜心品种不多,因此选育优质、抗病、抗逆、整齐度高的菜心杂种一代新品种(组合)具有重大的生产推广价值和庞大的消费市场。
目前生产应用上主要以系统选育育成的常规品种为主[2-3],而现代生物育种技术——小孢子培养技术目前已经在十字花科芸薹属多种蔬菜作物上有了应用[4-8],并且利用所获得的小孢子再生植株(DH系)快速高效地培育出了多个新品种[9-11]。在菜心利用小孢子培养技术研究上,朱允华等[12]和曾小玲等[13]发表了一些有关报道,但由于菜心出胚困难及出胚少的缘故,试验获得的正常胚状体和再生植株数量有限,远远不能满足菜心育种工作中所需要的纯系植株。因此,在此基础上完善菜心游离小孢子培养体系,培育菜心不同類型的优良DH系对接下来进一步选育优质高产、整齐一致的菜心新品种或新种类至关重要,不仅是解决菜心自交退化的关键,与此同时也可解决雄性不育系选育工作中遇到的一些困难。故在前人大量的研究报道和育种成果基础上,笔者以收集的10种不同基因型菜心种质资源为试材,从基因型、蔗糖、活性炭和植物生长调节剂等4方面来探讨,以期优化菜心小孢子培养体系,创制出多样性的菜心DH系,选出育种可利用的优异DH系,配制杂交组合,应用到菜心杂种优势育种实践中。
1 材料和方法
1.1 材料
供试验使用的10份材料编号为‘Cx1‘Cx2‘Cx3‘Cx4‘Cx5‘Cx6‘Cx7‘Cx8‘Cx9‘Cx10,由河南省农业科学院园艺研究所叶类蔬菜研究室、广州金穗种业有限公司提供。2019年8月上中旬播种于河南现代农业研究开发基地,2019年10月初植株开花后取材进行小孢子培养,该试验在河南省农科院园艺研究所完成。
1.2 方法
1.2.1 游离小孢子培养方法 选取无病虫害、无裂蕾的花序,根据试验需求选取适量的材料放置试验袋中,喷水后放至4 ℃冰箱里低温预处理24 h,当花蕾长度在2.1~2.5 mm之间时,进行小孢子培养。提取小孢子应选取花蕾的标准为:剥开花蕾后花瓣应位于花药1/2~2/3的位置处。将挑选好的花蕾用75%的酒精和1%的次氯酸钠溶液分别消毒30 s和15 min,最后用經过高压灭菌的超纯水清洗3遍,每次5 min。
Keller液体培养基作为洗液。第一步:将消过毒的花蕾夹到研磨管底部,加入2~3 mL冲洗液,研磨使花蕾中的小孢子分离出来;第二步:将研磨好的溶液倒入过滤网漏斗中过滤,确保将研磨的滤液完全滴入有刻度的离心管中,加入冲洗液定容至10 mL,盖上离心管盖并且用封口膜封紧管口防止溶液溢出,离心机中800 r·min-1离心3 min,倒出上层清液,只留下底部小孢子悬浮液;第三步:分别加入培养液至8 mL、6 mL并重复上述步骤。将以上步骤获得的小孢子溶液加入NLN培养液至一定的刻度并搅拌均匀,分别加入2 mL到已加入适量培养液的培养皿中;使用封口膜将培养皿封严封紧不留空隙,培养皿放置在32~33 ℃的光照培养箱中处理24 h后,25 ℃暗培养条件下进行培养。在培养期间定期观察培养皿中小孢子生长情况,至20 d左右统计并记录出胚数目。
1.2.2 配制培养基 Keller液体培养基作为洗液。采用PhytotechbNLN培养基加入琼脂,蔗糖和蒸馏水。用蒸馏水定容至所需体积,使用pH酸度计来调节冲洗液和NLN培养基的pH值均为5.8。冲洗液需要使用高压锅进行灭菌(121 ℃,20 min),NLN培养液则需要使用过滤器经过0.22 ?m的微孔滤膜过滤灭菌至无菌大三角瓶中,且以每瓶25~30 mL的体积分装NLN培养液(过程严格要求无菌环境,以免受污染)。根据试验设计添加不同浓度的生长调节剂、蔗糖、活性炭等,配制6种不同的培养基,分别编号为N0、N1、N2、N3、N4、N5。
N0:NLN+12%蔗糖+0.5 g·L-1活性炭;N1:NLN+10%蔗糖;N2:NLN+13%蔗糖;N3:NLN+15%蔗糖;N4:NLN+13%蔗糖+0.5 g·L-1活性炭;N5:NLN+13%蔗糖+0.5 g·L-1活性炭+0.05 mg·L-1 6-BA+0.5 mg·L-1 NAA。
1.2.3 影响菜心小孢子出胚率相关因素的试验设计 主要有以下几项。
(1)菜心不同基因型小孢子出胚情况比较分析:将试材在N0培养基进行小孢子培养,每个试材取30个花蕾,分别培养12皿,待20 d后观察各个基因型胚状体诱导情况,分析它们之间出胚率差异。
(2)蔗糖质量浓度对菜心小孢子胚发生能力的影响:选取符合试验的基因型材料‘Cx1,对其进行3组处理,第1组用N1培养液处理,其中蔗糖质量浓度为100 g·L-1,第2组用N2培养液处理,其中蔗糖质量浓度为130 g·L-1,第3组用N3培养液处理,其中蔗糖质量浓度为150 g·L-1,每组处理12皿,记录与分析三者之间的出胚数目和差异。
(3)活性炭对菜心小孢子胚发生能力的影响:选取基因型材料‘Cx1进行试验,一组用N4培养基,另一组用不添加活性炭的N2培养基,每组处理培养12皿,在相同的操作步骤及生长坏境等条件下进行无菌培养,统计出胚情况。
(4)培养基中添加植物生长调节剂对菜心小孢子胚发生能力的影响:对同一菜心材料‘Cx1分别用添加和不添加植物生长调节剂培养基培养,将其进行2组不同处理,一组用添加0.05 mg·L-1 6-BA和0.5 mg·L-1 NAA的N5培养基,另一组用N4培养基,期间随时观察各个培养皿的胚状体形成情况,统计出胚数据。
1.3 数据分析
采用SPSS 16.0软件处理数据,单因素随机区组试验,Duncans新复极差测验进行差异显著性分析。
2 结果与分析
2.1 不同基因型与出胚率的的关系
选取10种不同基因型的菜心品种,用N0培养基培养,出胚情况如表1。
由表1可以看出,试验对比的 10种不同基因型菜心的小孢子在相同的培养基、操作步骤及生长坏境等条件下进行无菌培养,其中‘Cx1‘Cx6‘Cx8材料获得了胚状体,而‘Cx2‘Cx3‘Cx4‘Cx5‘Cx7‘Cx9‘Cx10材料则没有得到胚状体,其中基因型‘Cx1获得的胚状体数目最多,出胚率为2.10胚·蕾-1,出胚最少的基因型‘Cx6的出胚率仅为0.10胚·蕾-1,两者相差20倍。因此可以看出,不同基因型的材料之间小孢子胚状体出胚率差异较大,而且基因型与小孢子胚诱导发生能力有着紧密联系。
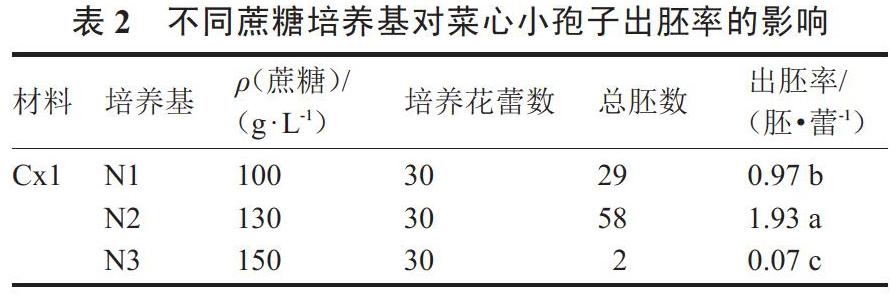
2.2 蔗糖对菜心小孢子胚发生能力的影响
由表2可以看出,N2培养基中蔗糖质量浓度(130 g·L-1)较高于N1培养基中的蔗糖质量浓度(100 g·L-1),其出胚率1.93胚·蕾-1也高于N1培养基中的出胚率0.97胚·蕾-1,且前者是后者的1.99倍。当培养基中蔗糖质量浓度增加至150 g·L-1时,‘Cx1的小孢子出胚率显著降低,仅为0.07胚·蕾-1,与出胚率最高的相差26倍多。由上可得,对于同一基因型材料进行小孢子培养时,添加适宜的蔗糖质量浓度可显著提高胚状体诱导率,而当添加浓度过高时,其胚胎发生能力则大大降低,胚状体诱导率呈明显下降趋势。说明蔗糖质量浓度的高低在一定程度上会严重影响菜心游离小孢子培养的胚状体诱导率。
2.3 活性碳对菜心小孢子胚发生能力的影响
由表3可以看出,活性炭对‘Cx1菜心小孢子的出胚率有一定的影响,以下小孢子材料操作培养条件相同的情况下,培养基中加入活性炭的小孢子出胚率较高,培养基中不加活性炭的小孢子出胚率则较低。‘Cx1添加活性炭之后的出胚率为2.10 胚·蕾-1,而不加炭的出胚率仅为0.20 胚·蕾-1,两者之间的出胚率相差近10倍。试验结果说明,对于同一基因型进行小孢子培养,在培养基中添加少量的活性炭有助于提高小孢子出胚率,因此对于其他不易出胚的基因型材料在小孢子培养过程中可添加适量活性炭来促进诱导胚胎发生能力。
2.4 植物生长调节剂对菜心小孢子胚发生能力的影响
将基因型材料‘Cx1分别用添加(N5)和不添加(N4)植物生长调节剂培养基培养,由表4可以看出,其他操作条件均相同的情况下使用同一基因型材料,在培养基中添加0.05 mg·L-1 6-BA和0.5 mg·L-1 NAA之后‘Cx1的出胚率为 2.13胚·蕾-1,而不添加植物生长调节剂时其出胚率为0.27 胚·蕾-1,两者出胚率相差6.89倍。可知,在‘Cx1菜心小孢子培养过程中添加6-BA和NAA激素组合可以显著提高小孢子出胚率,从而使获得子叶型胚状体的概率变大。
3 讨论与结论
基因型是制约小孢子发育的重要因素,同样对不同基因型菜心小孢子培养的胚胎发生能力也有明显影响。本试验中不同基因型材料之间小孢子胚胎发生率不尽相同,在10份试材中仅有3份成功获得了胚状体,且各个基因型之间出胚率差异较大,其余7份材料经多次试验培养后也未能获得正常的胚芽,这一试验结果在红菜薹[14-15]、大白菜[16]和花椰菜[17]等多个芸薹属蔬菜作物小孢子培养中均有类似报道。有学者利用菜心和芥蓝种间杂交提高后代亲和性,可扩大基因型范围,提高一些难成胚基因型的出胚能力[18],而这一方法陈文辉等[19]在甘蓝上已经获得了成功。此外,利用快速加代技术可不受基因型的限制直接获得纯系[20],在实际试验工作中,可将其与小孢子培养技术结合使用,来减少和克服因基因型差异而导致的小孢子培养试验中不出胚或出胚少的问题。
在小孢子培养过程中,培养基中的蔗糖是保证小孢子正常发育的主要能量来源,还可调节渗透压,为小孢子胚胎发育营造有利的生长环境,在多种芸薹属蔬菜作物小孢子培养中已多有研究和讨论[21-23]。Zhang wei等[21]报道在13%和16%的蔗糖质量浓度下进行小孢子培养均可获得羽衣甘蓝小孢子胚状体。曾小玲等[13]试验得出,在菜心小孢子培养第1天时先使用170 g·L-1高质量浓度的蔗糖培养之后再转化成130 g·L-1的蔗糖质量浓度进行培养,可使其胚诱导频率显著提高,尤其对难出胚的基因型材料而言。在本试验中设计了100 g·L-1、130 g·L-1和150 g·L-1的蔗糖质量浓度梯度进行比较试验,结果得出材料‘Cx1在130 g·L-1浓度下进行小孢子培养时,获得胚状体诱导率最高,达1.93胚·蕾-1,而蔗糖质量浓度过低或过高时,小孢子生长发育成为胚状体的效率都有所下降,尤其蔗糖质量浓度过高时,其胚胎发生率呈明显下降趋势。
活性炭在小孢子培養中的重要作用早已被证实[24-25],但并非对所有基因型材料都有促进作用。国外学者[26]研究了活性炭对多种不同基因型甘蓝类蔬菜作物小孢子培养的影响,得出在培养基中添加1%的活性炭可显著提高甘蓝类蔬菜小孢子胚胎发生率,这与本试验的研究结果一致。而刘雪平等[27]研究结果表明,在培养基中添加一定浓度的活性炭对甘蓝型油菜小孢子胚状体形成并无明显促进作用。
植物生长调节剂的添加对于小孢子生长发育、细胞分裂与生长途径具有重要作用。NLN培养基中添加一定量的6-BA和NAA可以使胚状体诱导率显著提高,这在红菜薹[14]、白菜[22]、芜菁[28]和小菘菜[29]等多种芸薹属蔬菜作物中均有相关报道,但2种激素的适宜使用浓度和配比在不同芸薹属蔬菜或相同作物不同基因型材料中有明显差异。施柳等[30]试验得出,添加0.3 mg·L-1 6-BA可使大白菜小孢子出胚率显著提高,而赵大芹等[31]研究表明,在黔白大白菜杂交种小孢子培养过程中使用0.05 mg·L-1 6-BA和0.10 mg·L-1 NAA浓度组合时,其胚胎发生率和成熟胚的比例最高。于文佳等[29]也认为,在小菘菜小孢子培养中添加0.05 mg·L-1 6-BA和0.20 mg·L-1 NAA所获得的出胚率要明显高于不添加激素的对照。基于前人的试验探究结果,笔者在菜心小孢子培养基中添加0.05 mg·L-1 6-BA和0.5 mg·L-1NAA可以显著提高‘Cx1的出胚率,此试验结果与曾小玲等[13]的研究结论相似。
除常见的6-BA、NAA和KT等植物生长调节剂在小孢子培养中应用较多且应用效果显著外,国内外多数学者也逐渐把在其他作物上有助于提高胚胎发生能力和促进细胞分裂生长的添加剂或激素应用到了蔬菜作物小孢子培养试验上,并且在一些试材上已经获得了成功。黄天虹等[32]在不结球白菜小孢子培养中发现,添加一定浓度的头孢噻胯可提高部分基因型材料的出胚率;Gao等[33]研究发现,在NLN-13培养基中添加0.000 1%的非离子型表面活性剂可使紫菜薹小孢子胚胎发生率和植株再生率显著提高,且获得双单倍体植株达60%以上。前人的大量报道和本研究的试验结果可为菜心和其他作物进行小孢子培养试验提供有力的参考依据和思路。
参考文献
[1] 王志勇.河南省蔬菜产业发展现状及对策[J].现代农业科技,2012,40(1):345-346.
[2] 张衍荣.菜心育种现状与展望[J].广东农业科学.1997,24(3):15-16.
[3] 李光光,张华,黄红弟,等.广东省菜薹(菜心)育种研究进展[J].中国蔬菜,2011(20):9-14.
[4] 王超楠,闻凤英,刘晓晖,等.球茎甘蓝小孢子培养中影响胚诱导的几个因素[J].中国蔬菜,2010(10):35-39.
[5] 乔丽桃.芜菁游离小孢子培养及其胚胎发生的研究[D].乌鲁木齐:新疆农业大学,2014.
[6] 轩正英,徐书法,冯辉.大白菜游离小孢子培养成胚影响因素的研究[J].辽宁农业科学,2005(2):18-19.
[7] 秦艳梅,王明霞,江海坤,等.安徽乌菜游离小孢子培养及植株再生体系建立[J].长江蔬菜,2017,(6):29-31.
[8] 张振超,耿鑫鑫,戴忠良,等.甘蓝类植物小孢子培养及植株再生研究[J].核农学报.2013,27(7):929-937.
[9] 耿建峰,原玉香,张晓伟,等.利用游离小孢子培养技术育成抗热大白菜新品种‘豫园50[J].园艺学报,2002,29(1):89-97.
[10] 宋立晓,曾爱松,高兵,等.青花菜新品种苏青3号的选育[J].江苏农业科学,2014,42(12):216-218.
[11] 曾爱松,高兵,宋立晓,等.秋季专用牛心甘蓝新品种锦秋55的选育[J].江苏农业科学,2015,43(11):230-231.
[12] 朱允华,刘明月,吴朝林.影响菜心游离小孢子培养的因素[J].长江蔬菜,2003(9):46-47.
[13] 曾小玲,方淑桂,朱朝辉,等.不同基因型菜心游离小孢子培养和植株再生[J].热带作物学报,2014,35(12):2397-2402.
[14] 吴艺飞,丁茁荑,肖杰,等.红菜薹小孢子培养技术研究进展[J]. 长江蔬菜,2013,(24):5-8.
[15] 肖辉,徐跃进,李正丽.红菜薹游离小孢子培养的影响因素研究[J].安徽农业科学,2008,36(17):7240-7241.
[16] TAKAHASHI Y,YOKOI S,TAKAHATA Y.Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies of Brassica rapa L.[J].Plant Biotechnology Reports,2012,6(4):297-304.
[17] 赵前程,吉立柱,蔡荣旗,等.花椰菜游离小孢子培养及植株再生研究[J].华北农学报,2007,22(6):65-68.
[18] 魏云晓,李菲,张淑江,等.菜薹(菜心)—芥蓝杂交亲和性分析及后代性状表现[J].中国蔬菜,2017(11):21-27.
[19] 陈文辉,方淑桂,曾小玲,等.甘蓝和青花菜杂种小孢子培养[J]. 热带亚热带植物学报,2006,14(4):321-326.
[20] 孔曜.菜心快速加代技术研究及加代后代DNA位点纯合率鉴定[D].广州:广州大学,2017.
[21] ZHANG W,FU Q,DAI X,et.al.The culture of isolated microspores of ornamental kale (Brassica oleracea var. acephala) and the importance of genotype to embryo regeneration [J]. Scientia Horticulturae,2008,117(1):69-72.
[22] 唐兵,陶蓮,卢松,等.白菜游离小孢子培养高频胚诱导技术体系优化[J].热带作物学报,2017,38(10):1913-1920.
[23] 张晓芬,王晓武,张延国,等.花椰菜游离小孢子培养再生植株研究[J].中国蔬菜,2005(1):l6-l7.
[24] 饶勇,徐涵,毛堂芬,等.单倍体育种技术在油菜育种材料创新上的应用研究Ⅰ.甘蓝型油菜游离小孢子胚状体的诱导发生[J].种子,2003(1):66-67.
[25] 曹鸣庆,李岩,蒋涛,等.大白菜和小白菜游离小孢子培养试验简报[J].华北农学报,1992,7(2):119-120.
[26] JO?O CARLOS DA SILVA DIAS.Effect of activated charcoal on Brassica oleracea microspore culture embryogenesis[J].Euphytica,1999,108(1):65-69.
[27] 刘雪平,刘志文,涂金星,等.甘蓝型油菜小孢子培养技术的几项改进[J].遗传,2003,25(4):433-436.
[28] 轩正英,马国财.新疆芜菁小孢子培养成胚影响因素研究[J].湖北农业科学,2017,56(13):2540-2542.
[29] 于文佳,侯喜林,赵晓嫚,等.小菘菜游离小孢子培养和植株再生[J].南京农业大学学报,2013,36(2):7-12.
[30] 施柳,王雅琼,李云龙,等.不同基因型大白菜小孢子胚状体诱导及植株再生[J].北方园艺.2014,38(6):101-104.
[31] 赵大芹,陶莲,张朝君,等.培养基成分对黔白大白菜杂交种小孢子胚诱导的影响[J].贵州农业科学,2007,35(6):24-25.
[32] 黄天虹,张娅,梁超凡,等.不结球白菜游离小孢子培养及植株再生研究[J].核农学报,2019,33(2):240-247.
[33] GAO Y M,JIA J X, CONG J L,et.al.Non-ionic surfactants improved microspore embryogenesis and plant regeneration of recalcitrant purple flowering stalk (Brassica campestris ssp. chinensis var. purpurea Bailey)[J].In Vitro Cellular & Developmental Biology - Plant,2020,56(2):207-214.
