楤木胚状体的诱导及再生体系的建立
2018-05-10孔凡芹李树忠黄玮婷方中明
孔凡芹, 李树忠, 黄玮婷, 方中明,2
(1.武汉生物工程学院应用生物技术研究中心,湖北武汉 430415; 2.华中农业大学生命科学技术学院,湖北武汉 430070)
楤木(Araliachinensis)别名乌龙头,为五加科楤木属的多年生落叶灌木或小乔木,是山林地区所产的药、菜两用的名贵野菜[1],被誉为“山野菜之王”。楤木的鲜嫩芽富含人体所需的多种氨基酸和大量的矿质元素[2]。楤木的干燥根皮、茎皮及叶均可入药,长期食用可调节神经,强身健体,延年益寿[3]。
近年来,由于野生资源的过度开采,造成楤木供不应求的局面。楤木的繁殖方法分为种子繁殖和营养繁殖。由于其种子细小难收集,深度休眠,需要对其进行4~5个月的层积处理,给种子繁殖带来了极大的不便[4]。营养繁殖包括根、茎繁殖等,但由于楤木茎中心髓组织较大,茎插不容易生根[5],因此根段繁殖是其主要繁殖方式,但繁殖系数低,且不利于野生资源的保护[4]。
采用组织培养进行快速繁殖是加快楤木繁殖速度的有效途径,且能保持其优良性状。近20年来,楤木属植物在组织培养方面取得较大进展,已建立了辽东楤木(A.elata,又名龙牙楤木)成熟的快繁体系[6],基本建立了长白楤木(A.continentalis)[7]、云南楤木(A.thomsnii)[8]、食用土当归(A.cordata)[9]等种的快繁体系,辽东楤木等甚至已经通过体细胞胚的培养制作出了能够自然发芽的人工种子[10]。目前有关楤木组织培养的研究结果较少。
再生植株的形成共有2条途径。通过丛生芽途径繁殖的苗木相对较弱小,成苗需要专门壮苗生根,耗时长,扩繁慢。而通过体细胞胚增殖分化途径,得到的胚状体不但能实现快速大量增殖,而且分化的小苗健壮完整。目前楤木属植物普遍存在的主要问题是体细胞胚定向分化成苗的控制因素尚不清楚,成苗率低,玻璃化较严重,结果存在偶然性[11-12],因此,研究楤木体细胞胚定向分化成苗尤为重要。
本试验建立了楤木愈伤诱导、诱导愈伤分化胚状体、胚状体分化成苗、幼苗生根壮苗整个快繁体系,着重研究了植物激素对楤木愈伤分化成胚状体的影响和胚状体分化成苗的影响,以期为建立和完善楤木高效的快繁体系提供参考。
1 材料与方法
1.1 试验材料
试验材料为甘肃省陇南市宕昌县山区野生楤木嫩茎。
1.2 试验方法
1.2.1 愈伤的诱导 剪取楤木带叶的嫩茎为外植体,用无菌水洗净,先用70%乙醇浸泡30 s,无菌水冲洗1次,再用 0.1% 氯化汞消毒10 min,无菌水冲洗5次。然后将带叶的嫩茎切成0.5 cm的茎段,接种于愈伤诱导培养基表面。愈伤诱导的培养基为MS+琼脂7 g/L+蔗糖30 g/L,在此基础上,单独添加激素6-BA或2,4-D,浓度梯度为0、0.5、1.0、1.5、2.0 mg/L,探究不同激素对愈伤诱导的影响。培养条件为光照强度2 000 lx,光照时间12 h/d,培养温度(25±1)℃。培养1周后,开始观察和统计每种处理愈伤组织的褐化程度、生长量和愈伤诱导率,筛选楤木愈伤诱导的最佳培养基。愈伤诱导率=愈伤数/外植体个数×100%。
1.2.2 胚状体的诱导和增殖 选取诱导培养基中健康的愈伤组织为材料,接种于胚状体诱导培养基中。胚状体诱导培养基为MS+琼脂7 g/L+蔗糖30 g/L+活性炭2 g/L+NAA 0.4 mg/L,在此基础上,单独添加激素ZT或2,4-D或 6-BA,浓度梯度为0、0.5、1、1.5、2 mg/L,探究不同激素对胚状体诱导的影响。胚状体诱导45 d后,转入胚状体增殖培养基(同胚状体诱导培养基)增殖,探究不同激素对胚状体增殖的影响,增殖周期为45 d。在胚状体诱导和增殖培养后,分别观察和统计胚状体诱导和增殖情况,筛选出楤木胚状体诱导和增殖的最佳培养基。胚状体增殖倍数=增殖出的胚状体数/接种的胚状体数。
1.2.3 胚状体分化成苗 选取子叶期的胚状体作为接种材料,接种于分化培养基中。分化培养基为MS+IAA 0.05 mg/L+琼脂7 g/L+蔗糖30 g/L+活性炭2 g/L,在此基础上,单独添加激素ZT或6-BA,浓度梯度分别为0、0.2、0.5、1、1.5、2 mg/L;或单独添加KT,浓度梯度为0、1、2、3、4、5 mg/L,探究不同激素对胚状体分化的影响。60 d后统计胚状体分化的情况。分化率=分化出的苗数/接种的胚状体数。
1.2.4 幼苗的壮苗和生根 选取刚分化出真叶的幼芽为接种材料,接入壮苗和生根培养基中。壮苗和生根培养基为1/2MS+琼脂7 g/L+蔗糖30 g/L+活性炭2 g/L,在此基础上,单独添加激素IAA、NAA或IBA,浓度梯度为0、0.02、0.05、0.1、0.4、1 mg/L,探究不同激素对幼苗壮苗和生根的影响。30 d 后统计生根数、根长、根生长状况,筛选出壮苗和生根的最佳培养基。生根率=生根外植体数/接种的外植体数×100%。
1.2.5 数据统计与分析 试验每个处理接种30瓶,重复3次。数据采用SPSS软件进行变量分析(ANOVA),以Duncan’s在0.05水平上进行显著性差异分析。
2 结果与分析
2.1 不同激素对愈伤诱导的影响
从表1可以看出,不同浓度的2,4-D处理楤木嫩茎,均能诱导出愈伤,其生长量随2,4-D浓度增加先增加后降低。当2,4-D浓度为1.5 mg/L时,愈伤组织诱导和生长最快,且愈伤只有轻微褐化现象,为楤木嫩茎诱导愈伤的最佳浓度。不同浓度6-BA处理均出现愈伤严重褐化的现象,且愈伤诱导率非常低。当6-BA浓度为1 mg/L或1.5 mg/L时,愈伤诱导率仅为13.89%。因此适合楤木外植体脱分化并诱导出愈伤的培养基是MS+2,4-D 1.5 mg/L(图1-A)。

表1不同激素对楤木愈伤诱导的影响
注:褐化程度:“*”表示褐化轻微,“**”表示褐化较为严重,“***”表示褐化严重,影响进一步分化。生长量中,“*”表示略有生长,“**”表示每块接种材料增殖1 cm3以下,“***”表示每块接种材料增殖1 cm3以上。

2.2 不同激素对胚状体诱导和增殖的影响
将愈伤接入胚状体分化培养基中,30 d后,愈伤出现明显的绿色胚点。45 d后,绿色胚点增多,并出现突起的淡绿色芽尖。从表2可以看出,不同浓度ZT处理得到的胚性愈伤很少,基本没有胚点分化。ZT浓度为0.5 mg/L时愈伤生长最为健康,其他浓度的ZT处理诱导出的愈伤有少量水渍化现象。不同浓度2,4-D处理得到的胚性愈伤很少,很少有绿色胚点或嫩黄色胚点,仅在1 mg/L时胚状体分化效果较好,愈伤能够分化出2~3个绿色胚点,且无水渍化无褐化现象。6-BA浓度为0.5 mg/L或1 mg/L时对愈伤诱导出胚状体的效果较好,愈伤有较多的绿色胚点,且有鱼雷期胚状体,生长良好。6-BA浓度大于1 mg/L后,对胚状体的诱导效果较差,愈伤有轻微褐化现象,分化出的少量芽体还被愈伤紧密包裹。因此,楤木胚状体诱导以0.5 mg/L或1 mg/L 6-BA配合0.4 mg/L NAA的效果最好。
选取诱导出的胚状体为接种材料,对胚状体增殖情况开展研究(表2)。不同浓度ZT处理下的胚状体玻璃化现象严重,分化的胚状体多畸形。不同浓度2,4-D处理的胚状体增殖倍数低,有玻璃化和退化成愈伤的现象。2,4-D浓度为1 mg/L时胚状体增殖倍数显著高于其他浓度处理,低浓度(0.5 mg/L)容易引起胚状体玻璃化,而高浓度(1.5、2 mg/L)容易引起胚状体再变成愈伤。6-BA处理的胚状体增殖较快,以0.5 mg/L的6-BA增殖倍数最大,为11.337倍,与其他各组处理存在显著差异。在6-BA浓度大于 0.5 mg/L 后,增殖倍数随着浓度增加而逐渐降低,6-BA浓度达到 2 mg/L 时,增殖系数急剧减少,胚状体质量大幅度降低。通过胚状体的诱导和增殖的整体效果可知,0.5 mg/L 6-BA配合0.4 mg/L NAA对楤木胚状体诱导和增殖的效果最好(图1-B、图1-C)。
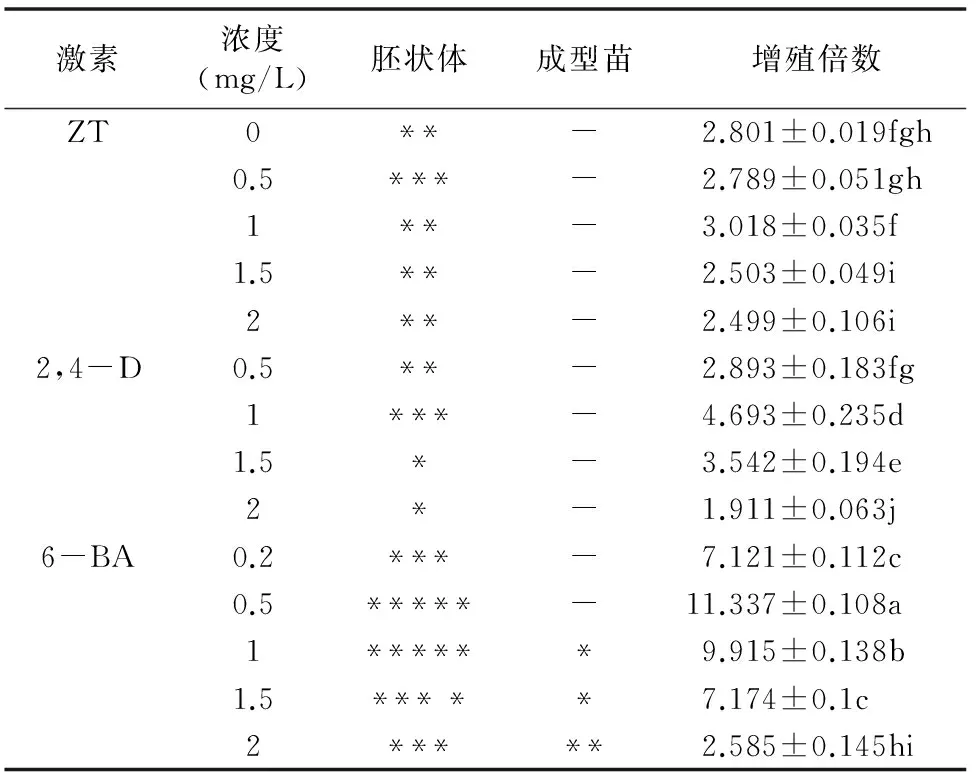
表2不同激素对楤木胚状体诱导和增殖的影响
注:“胚状体”列中,“*”表示优良胚状体占有总生物量的比例为20%以下,“**”表示20%~30%,“***”表示>30%~40%,“****”表示>40%~50%,“*****”表示50%以上。成型苗指分化出2张以上真叶的完整苗,“-”表示基本没有,“*”表示每瓶3株以下,“**”表示每瓶3~5株。
2.3 不同激素对胚状体分化成幼苗的影响
选取质量较好的胚状体为接种材料,探究不同激素对胚状体分化成幼苗的影响。从表3可以看出,不同浓度6-BA处理中,以0.5 mg/L或1 mg/L浓度时胚状体分化成苗率相对较高,苗长和根长生长状况也较好。当6-BA浓度达到 1.5 mg/L 以上时,诱导的苗株严重畸形、玻璃化。不同浓度ZT处理中,诱导苗分化的分化率均比相同浓度的6-BA处理明显提高,且植株长势健壮,根系发达。ZT 1 mg/L或 1.5 mg/L 浓度处理,苗较为健壮;而ZT 0.5 mg/L处理时分化率最高,达4.069,与其他各组处理存在显著差异。当ZT浓度达到2 mg/L时,苗株的生长状况较差,且分化率下降至1.625。KT诱导胚状体分化试验表明,分化率较低,接入的材料容易死亡,已分化的幼苗生长状态较差,幼苗纤细矮小,叶淡黄色。综合分析表明,可选用0.5 mg/L ZT+0.05 mg/L IAA作为胚状体分化成幼苗的培养基,通过壮苗可得到大量健壮的苗株(图1-D)。

表3不同激素对楤木胚状体分化的影响
2.4 不同激素对幼苗壮苗和生根的影响
将有3张以上真叶且生长状态一致的幼苗,接入不同生根培养基,观察和统计不同激素对幼苗壮苗和生根的影响(表4)。结果表明,0.1 mg/L NAA处理生根率最高,达到98.6%,与其余各组生根率存在显著差异。当激素浓度达到1 mg/L时,IAA、NAA、IBA 3种激素处理均出现幼苗大量枯死的现象,说明高浓度的生长素不适合幼苗生长及生根。以上结果表明,楤木壮苗和生根诱导的最佳培养基是1/2MS+0.1 mg/L NAA(图1-E)。
3 讨论
本试验前期在诱导楤木外植体愈伤过程中发现,嫩茎和幼叶诱导愈伤的速度存在较大差异,嫩茎诱导出愈伤的速度快,且愈伤组织质地疏松,颜色偏白色;而幼叶诱导愈伤速度慢,但是愈伤组织质地致密,颜色偏向淡黄色,故本研究选用嫩茎作为外植体材料进一步扩大试验。这与李正楠等发现龙芽楤木同一植株的不同部位做外植体诱导愈伤的难易程度和愈伤的胚性化难易存在很大的差异[13-14]。本试验在胚状体诱导与增殖过程中发现,当培养基中不加入激素时胚状体难以分化,且分化出的少量胚状体生长畸形严重,说明外源激素是胚状体分化的必要因素,这与王仲慧等的外源激素对半夏胚状体诱导的结果[15]相似。6-BA、ZT、 2,4-D对胚状体诱导效果差异较大,6-BA诱导随着继代次数的增加,只要激素浓度缓慢减少,胚状体诱导数量越来越多。2,4-D继代诱导过程中,第二次继代产生大量胚状体在继续培养 15 d 左右后胚状体全部枯萎。闵子扬等发现胚状体诱导出后,转接诱导时间对胚状体继续发育影响极大[16]。达克东等认为胚状体对外源激素反应灵敏,只有外源激素与内源激素达到某种平衡时才能诱导胚状体继续发育[17-18]。由此可知,胚状体在继代培养过程中不断在体内积累了可观的激素,多次继代需要不断降低诱导激素的浓度。
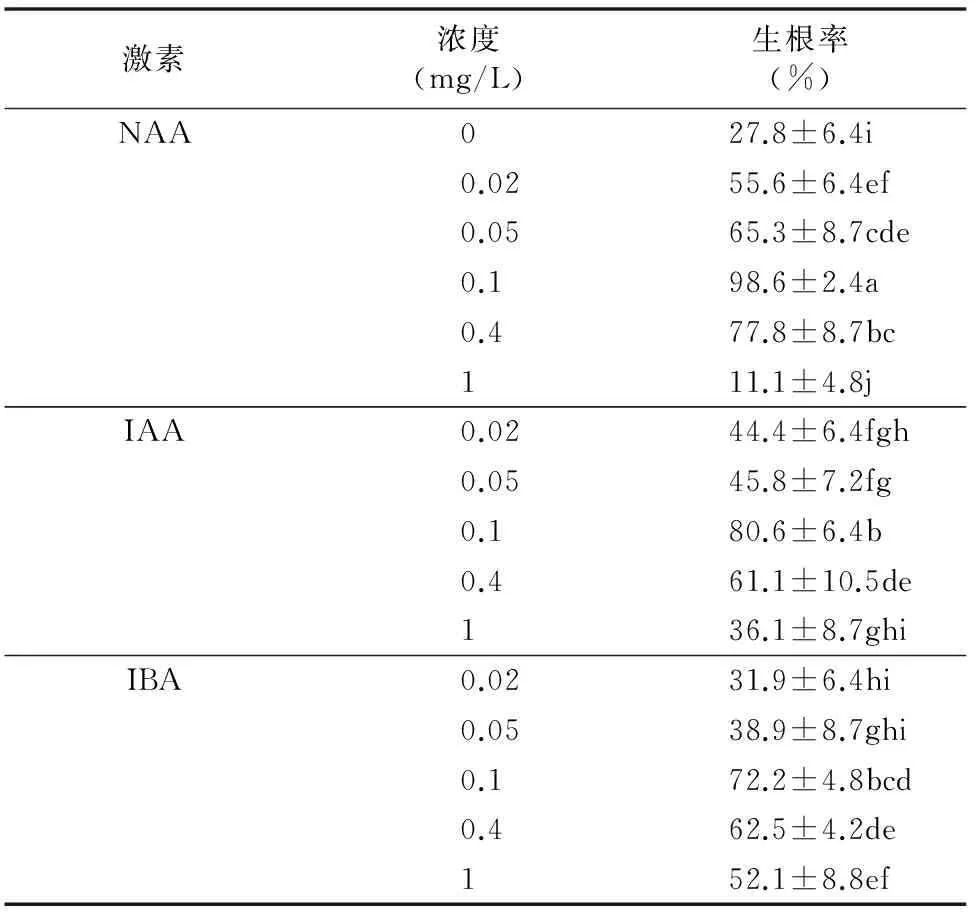
表4不同激素对楤木生根的影响
近年来,体细胞胚的发生机制的研究已经比较深入,大部分研究者认为胚状体是由一个细胞分裂的, 因为植物细胞的全能性证明它们有单细胞繁殖的强大潜力,认为体细胞胚发生过程是由一个圆形细胞经过激素刺激后胚性化[10],胚性细胞在愈伤内或表面分裂成顶细胞和基细胞,后发育成为胚状体。在本试验2,4-D楤木诱导胚状体的第一次继代和第三次继代中,出现了愈伤组织表面出现绿色斑点,后聚集突起成为鱼雷期或子叶期胚状体的现象,与单细胞发育成胚状体的描述差异较大,更与多个细胞聚集生成胚状体的描述相似[19],所以笔者认为胚状体诱导中以单细胞起源为主,并与多细胞集合体共存,具体情况因为诱导激素的种类和浓度不同而存在着差异。
本试验发现,楤木胚状体由增殖培养基转接到幼苗分化培养基上培养时,未分化出2张以上真叶的胚状体接入后极易玻璃化或者死亡,而分化出真叶后分离接入或者将几个鱼雷期[20]胚状体与其相连的愈伤组织一同接入苗分化培养基之后则能极大提高成活率和分化率。吕晋惠等认为,胚状体的分化是因为胚状体内源激素与外源激素达到某种平衡之后才会发生,据此而论,胚状体分化出真叶后拥有较强的产生激素的能力,所以能够完成进一步的分化[18]。胚状体聚集之后提高分化率可能是因为相互连接的胚状体能够共同完成激素的互通调节,优先完成一个或几个胚状体的分化,而后反过来支持其他胚状体分化,提高分化率。
本研究结果表明,楤木愈伤诱导的最佳培养基为MS+1.5 mg/L 2,4-D,诱导率达100%;楤木胚状体诱导和增殖的最佳培养基为MS+0.5 mg/L 6-BA+0.4 mg/L NAA,胚状体分化率达50%以上,增殖倍数达11.337倍;胚状体分化成苗的最佳培养基为MS+0.5 mg/L ZT+0.05 mg/L IAA,分化率达4.069;壮苗生根的最佳培养基为1/2MS+0.1 mg/L NAA,生根率达98.6%。
参考文献:
[1]陈 鑫,赵树理,赵 芳,等. 定西市野生楤木人工栽培研究[J]. 甘肃科技,2014,30(24):153-154.
[2]郑玲玲,裴凌鹏. 楤木属植物研究进展[J]. 中国民族医药杂志,2010,16(6):57-59.
[3]洪晓萍. 楤木播种育苗及培育技术[J]. 甘肃林业,2011(4):37-38.
[4]齐明明,李紫薇,阎秀峰,等. 龙牙楤木繁育技术与药理活性成分的研究进展[J]. 林业科学,2015,51(12):96-102.
[5]徐科焕,何志栋,袁虎林,等. 秦岭山脉特种楤木菜人工栽培技术[J]. 陕西农业科学,2002(9):37-39.
[6]番文健,张楼兰,杨云志,等. 楤木种子育苗技术[J]. 云南农业科技,2006(2):42.

[8]杨晓霞,杨 琳. 云南楤木组织培养快速繁殖试验[J]. 热带农业科技,2005,28(3):21-23.
[9]Lee K S,Lee J C,Soh W Y. High frequency plant regeneration fromAraliacordatasomatic embryos[J]. Plant Cell Tissue & Organ Culture,2002,68(3):241-246.
[10]李建民,张 程,马玉林,等. 龙牙楤木体细胞胚胎发生的细胞组织学研究[J]. 北方园艺,2011(14):116-119.
[11]杨振国,杜凤国. 长白楤木的组织培养与植株再生[J]. 植物生理学通讯,2005,41(2):194.
[12]李福安,李建民,李喜文,等. 培养因素对龙牙楤木体细胞胚胎发生的影响[J]. 四川大学学报(自然科学版),2004,41(6):1259-1263.
[13]李正楠,王 红,张爱军,等. 龙芽楤木体细胞胚状体发生及成苗的调控研究[J]. 北方园艺,2010(8):118-121.
[14]李建民,李喜文,李福安,等. 龙牙楤木组织培养与不定芽再生植株[J]. 青海师范大学学报(自然科学版),2004(4):69-72.
[15]王仲慧,刘金兵,刁卫平,等. 辣椒花药培养胚状体发生途径影响因素研究[J]. 核农学报,2015,29(8):1471-1478.
[16]闵子扬,李 涵,邹 甜,等. 南瓜未授粉子房离体培养及植株再生[J]. 植物学报,2016,51(1):74-80.
[17]达克东,张 松,高东升,等. 丽格海棠叶片培养胚状体发生和植株再生[J]. 园艺学报,2001,28(2):180-181.
[18]吕晋惠,吴月亮,孙 磊,等. 菊花叶片不定芽再生体系的研究[J]. 北京林业大学学报,2005,27(4):97-100.
[19]Ortiz J P A,Fama G,Vallejos R H,et al. cytodifferentiation and cell organization in the somatic embryogenesis of wheat(TritienmaestivumL.)[J]. Biocell,1996,20(1):61-66.
[20]秦公伟,曹小勇,徐 皓,等. 西洋参体细胞胚成熟萌发研究[J]. 北方园艺,2015(24):84-87.
