WT1多肽疫苗对荷人单核细胞白血病SCID小鼠的抗肿瘤免疫效应
2019-09-10张王刚刘海燕王慧渊
李 静,张王刚,钟 波,白 菊,刘海燕,王慧渊,耿 妍
(西安交通大学第二附属医院:1. 儿科;2. 血液内科,陕西西安 710004)
急性单核细胞白血病(acute monocytic leukemia, M5)具有髓外浸润明显、完全缓解率低、无病存活期短、死亡率高、预后差、常规化疗总体疗效有限等临床特点。免疫治疗是目前最有希望彻底清除白血病微小残留病灶、延长治疗后缓解期、预防复发的治疗方法[1]。肿瘤多肽疫苗具有特异性高、化学结构稳定、结构简单、易于制备及无潜在致癌性等特点,因此,在肿瘤治疗中,其应用前景非常广泛[2]。Wilms瘤基因(Wilms’ tumor gene 1, WT1)定位于染色体11p13,在急性髓性细胞白血病及大部分实体瘤中均存在高表达[3-5],因此,WT1肽是免疫治疗恶性肿瘤的优选靶抗原[6]。白血病及肿瘤患者体内存在高水平WT1特异性抗体和细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)[7-8],激发机体产生特异性免疫应答,从而达到预防恶性肿瘤、清除术后或放化疗后瘤细胞微小残留,以及根治恶性肿瘤的目的。目前国际上已有多个以WT1为靶点的恶性肿瘤主动特异性免疫治疗项目进入了临床转化研究阶段,部分进入临床Ⅱ期试验,并已经取得一定疗效[9-11]。但是,由于机体存在的免疫耐受及免疫逃逸会影响到肽疫苗的临床试验有效率,部分患者表现为治疗无效甚至肿瘤持续增长[12],所以,将WT1肽疫苗应用于恶性肿瘤的治疗或预防,仍然需要进一步研究。为此,本研究应用WT1多肽对荷人单核细胞白血病重度联合免疫缺陷(severe combined immunodeficiency, SCID)小鼠进行体内抗瘤试验,探讨WT1多肽疫苗对单核细胞白血病的抗肿瘤免疫效应,为WT1多肽疫苗成为单核细胞白血病的治疗途径提供实验依据。
1 材料与方法
1.1 实验对象C.B17/SCID纯系小鼠由空军军医大学动物实验中心提供,严格依照无特殊病原体(SPF)的标准进行管理,动物饲养条件三级。实验选择6~8周龄SCID 小鼠(雌性、体质量18~22 g)作为研究对象。细胞株:人类急性单核细胞白血病THP-1细胞,用含100 mL/L FBS的RPMl-1640完全培养基于37 ℃、50 mL/L CO2孵箱中培养。
1.2 实验仪器及试剂实验仪器:医用超净工作台(苏净集团安泰公司);台式高速离心机(上海安亭离心机厂);流式细胞仪FACScalibur(美国贝克曼公司);酶联免疫检测仪(Bio-Tek公司);光学显微镜及倒置显微镜(日本Olympus公司)。实验试剂:自然杀伤细胞抑制剂Anti-Asialo-GM1(美国eBioscience公司);乳酸脱氢酶细胞毒性检测试剂盒(美国Promega公司);PerCp-CD3/FITC-CD4/PE-CD8三联抗体(美国IVGN公司);CD4单克隆抗体(FITC标记)及CD25单克隆抗体(PE标记)均购自美国Biolegend公司;白介素2(interleukin-2, IL-2)、γ干扰素(interferon-γ, IFN-γ)、白介素10(interleukin-10, IL-10)、转化生长因子-β(transforming growth factor-β, TGF-β)和免疫球蛋白ELISA试剂盒均购自美国RayBio公司。
1.3 动物模型的建立随机将动物分成3组,包括对照组、辅助T细胞表位组(Th组)和WT1组,每组8只。以健康人外周血淋巴细胞重建SCID小鼠免疫系统24 h后,皮下接种THP1细胞,建立人免疫重建的荷单核细胞白血病THP-1的SCID小鼠模型。具体方法如下:①采用自然杀伤细胞(NK细胞)抑制剂Anti-asialo GM1封闭SCID鼠NK细胞活性。取兔Anti asialo GM1(1 mL)溶于1 mL生理盐水中,经腹腔注射给24只SCID小鼠,每只小鼠20 μL。②免疫重建。腹腔注射0.5 mL外周血淋巴细胞(浓度为8×107/mL)给24只SCID小鼠,24 h后皮下接种THP1细胞,接种部位包括左右腋窝和背部共3点,每点皮下接种THP1细胞1×107/mL共0.2 mL,观察成瘤情况,当肿瘤体积约为100 mm3时,接种疫苗。
1.4 疫苗的配制WT1多肽的氨基酸序列为RMFPNAPYL。辅助T细胞表位,即通用性T辅助细胞表位,氨基酸序列为QYIKANSKFIGITE。WTI多肽和辅助T细胞表位均由上海强耀生物科技公司合成,利用RP-HPLC(美国Waters公司)方法分析多肽纯度,使用质谱(美国PE公司)测定其分子量并进行鉴定,所有合成的多肽纯度均达到95%以上。疫苗配制方法:WT1多肽组为WT1多肽(50 μg)+T辅助多肽(50 μg)+不完全弗氏佐剂、辅助T细胞表位组为辅助T细胞表位(50 μg)+不完全弗氏佐剂、空白组为不完全弗氏佐剂。疫苗免疫量是每只小鼠50 μg。
1.5 取材疫苗注射14 d后,处死小鼠前,经眼球采血。小鼠应用颈部脱臼法处死,无菌状态下快速取出脾脏,放于盛有RPMI 1640培养液的培养皿中冲洗后,剪成1~2 mm大小放于不锈钢细胞筛上研磨、过滤,加入小鼠淋巴细胞分离液,以密度梯度离心法分离制备单细胞悬液。切除肿瘤组织,用100 mL/L中性甲醛固定24 h。
1.6 脾细胞CTL活性测定采用乳酸脱氢酶法检测小鼠脾细胞特异性CTL杀伤活性。
1.7 外周血CD3+/CD4+T细胞、CD3+/CD8+T细胞、CD4+/CD25+Treg细胞、IFN-γ、TGF-β、IL-10、IL-2及IgG测定利用流式细胞仪法检测小鼠外周血CD3+/CD4+T细胞、CD3+/CD8+T细胞及CD4+/CD25+Treg细胞表达水平;应用ELISA方法检测小鼠外周血IFN-γ、TGF-β、IL-10、IL-2及IgG水平。
1.8 病理学检查疫苗注射14 d后将SCID小鼠全部处死,取肿瘤组织,测量肿瘤重量,利用公式计算肿瘤体积。肿瘤体积计算公式:V=(长×宽2)/2[13]。肿瘤组织用100 mL/L甲醛固定24 h后进行包埋、切片及HE染色,镜下观察移植瘤病理组织特点。

2 结 果
2.1 小鼠脾细胞的CTL活性实验结果显示,WT1组体内诱导CTL对THP1细胞杀伤效应,随着效靶比提高,杀伤率相应提高。不同疫苗成分对THP1细胞的CTL活性检测结果显示,WT1组>Th组>对照组,WT1多肽疫苗诱导的CTL在各效靶比的杀伤率均明显高于Th及对照组(P<0.05,表1)。
表1 SCID小鼠脾细胞对THP1细胞的CTL活性

与对照组比较,*P<0.05;与Th组比较,#P<0.05。
2.2 小鼠外周CD3+/CD4+、CD3+/CD8+T细胞及CD4+/CD25+Treg细胞的表达实验结果显示,WT1组CD3+/CD4+及CD3+/CD8+免疫分子表达水平均明显高于Th组和对照组(P<0.05);WT1组CD4+/CD25+免疫分子表达水平明显低于Th组和对照组(P<0.05,表2,图1)。
表2 各组小鼠外周血CD3+/CD4+、CD3+/CD8+及CD4+/CD25+T细胞的表达


组别nCD3+/CD4+CD3+/CD8+CD4+/CD25+对照组812.6±2.317.1±1.641.3±2.5Th组818.5±2.817.8±2.238.4±2.1WT1组825.5±2.6∗ 23.5±1.8∗# 32.7±1.7∗#
与对照组比较,*P<0.05;与Th组比较,#P<0.05。
2.3 小鼠外周血中IgG、IFN-γ、TGF-β、IL-10、IL-2的水平实验结果显示,WT1组的IgG、IFN-γ和IL-2水平均明显高于Th组和对照组(P<0.05);但TGF-β及IL-10水平均明显低于Th组和对照组(P<0.05,表3)。
2.4 病理学检查WT1诱导的CTL使荷人单核细胞白血病SCID小鼠的肿瘤平均体质量及体积均明显缩小,与Th及对照组比较,差异有统计学意义(P<0.05,表4)。病理切片HE染色后光镜下观察显示,对照组可见大量生长活跃的肿瘤细胞,细胞外观大小不一,呈圆形、椭圆形或梭形,异型性明显。SCID小鼠经不同疫苗治疗后移植瘤病理组织特点:Th治疗组可见大量肿瘤细胞,少量肿瘤细胞坏死;WT1治疗组可见肿瘤细胞变性坏死,存活的肿瘤细胞减少(图2)。

图1 各组小鼠外周血CD3+/CD4+T、CD3+/CD8+T及CD4+/C25+Treg细胞流式细胞仪分析图
Fig.1 Analysis of peripheral blood CD3+/CD4+T,CD3+/CD8+T & CD4+/C25+T Treg cytometry
表3 各组小鼠外周血IgG、IFN-γ、TGF-β、IL-10、IL-2的水平
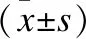
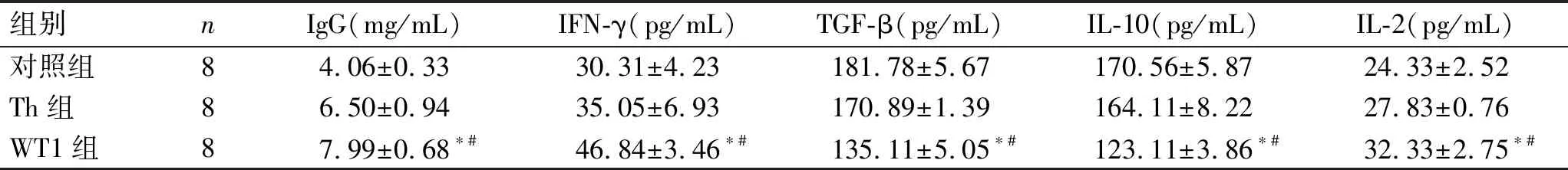
组别nIgG(mg/mL)IFN-γ(pg/mL)TGF-β(pg/mL)IL-10(pg/mL)IL-2(pg/mL)对照组84.06±0.3330.31±4.23181.78±5.67170.56±5.8724.33±2.52Th组86.50±0.9435.05±6.93170.89±1.39164.11±8.2227.83±0.76WT1组87.99±0.68∗#46.84±3.46∗#135.11±5.05∗#123.11±3.86∗#32.33±2.75∗#
与对照组比较,*P<0.05;与Th组比较,#P<0.05。
表4 各组小鼠移植瘤质量及体积


项目对照组Th组WT1组质量(g)2.82±0.612.93±0.580.78±0.19∗#体积(cm3)1.88±0.412.02±0.390.52±0.12∗#
与对照组比较,*P<0.05;与Th组比较,#P<0.05。
3 讨 论
WT1基因与急性髓性白血病、急性淋巴细胞白血病、慢性粒细胞白血病等血液系统肿瘤的发生有关[14],并能作为检测急性白血病微小残留病灶的标志物[15]。大量数据证实,WT1基因在血液系统肿瘤和实体瘤中均存在高表达[3-5,16],说明WT1是免疫治疗恶性肿瘤的广谱性靶抗原。近年研究发现,人体内产生的WT1特异性T细胞能够特异性杀伤白血病细胞而并不损伤造血前体细胞[17],提示WT1是肿瘤免疫治疗的新靶点。

图2 SCID小鼠经不同疫苗治疗后的移植瘤病理组织特点
Fig.2 Pathological features of transplanted tumor in SCID mice treated with different vaccines (HE, ×400)
肿瘤治疗与机体免疫功能密切相关。肿瘤多肽疫苗能够识别抗原递呈细胞表面的主要组织相容性复合体(MHC)分子,形成抗原肽-MHC-T细胞受体复合物,诱发机体产生特异性CTL,从而杀伤肿瘤细胞[8]。联合应用免疫佐剂和通用性辅助T细胞表位可增强多肽疫苗的免疫效应,因此,本实验中WTI组疫苗成分为WT1多肽联合辅助T细胞表位。另外,肿瘤多肽疫苗能够激活自身免疫系统诱导机体产生体液免疫和细胞免疫,增强机体的抗肿瘤能力[7]。实验结果显示,不同治疗组对THP-1细胞的CTL杀伤效应从高到低依次为WT1组、辅助T细胞表位组和对照组;WT1组肿瘤生长速度缓慢,肿瘤组织中大片肿瘤细胞变性坏死,部分细胞凋亡。这可能与以下因素有关:WT1多肽诱导产生的CTL细胞进入SCID小鼠体内,随后广泛分布于外周血液中,部分进入细胞免疫器官(如脾脏、淋巴结等)及组织内,继续增殖和衍化。由于该特异性CTL具有记忆性识别抗原表位的能力,当CTL细胞接触到表面递呈该表位的THP-1细胞后,可迅速识别并快速介导产生CTL细胞免疫效应。已有报道指出,WT1多肽可有效应用于急性髓性细胞白血病的治疗[18],本实验亦证实,WT1多肽组诱导的CTL杀伤效应明显高于其他组,说明WT1多肽具有较好的抗M5治疗效果。
CD4+T和CD8+T细胞介导抗肿瘤免疫应答,其中CD8+T细胞是抗肿瘤免疫的主要效应细胞。辅助T淋巴细胞(CD3+CD4+)在免疫反应中扮演中间角色,通过增生扩散来激活其他类型的免疫细胞,以产生直接免疫效应,并且参与T细胞调控或辅助其他淋巴细胞而发挥作用。细胞毒T淋巴细胞(CD3+CD8+)可以杀灭产生特殊抗原反应的目标细胞,因此,也被称为杀手T细胞[19]。CD4+/CD25+调节性T细胞(CD4+/CD25+regulary T cell, CD4+/CD25+Treg)能同时抑制CD8+T细胞和CD4+T细胞的抗肿瘤活性。去除或降低CD4+/CD25+T细胞水平可明显增强抗肿瘤活性。目前CD4+/CD25+Treg细胞的效应机制还未完全明确。CD4+/CD25+Treg细胞可抑制肿瘤效应细胞的发育和活化,从而降低体内抗肿瘤效应,因此,去除CD4+/CD25+Treg细胞可以解除其对肿瘤细胞的免疫无应答,促进肿瘤效应细胞的发育和活化[20]。本研究结果显示,WT1组细胞毒T淋巴细胞(CD3+CD8+)表达均明显高于其他治疗组,提示WT1可明显活化体内CD8+T细胞免疫效应,从而激发更有效的抗肿瘤免疫效应。WT1组的CD4+/CD25+Treg细胞水平明显减低,说明WT1多肽疫苗可抑制CD4+/CD25+Treg细胞的水平,促进肿瘤效应细胞的发育和活化,增强抗肿瘤CTL效应。
IFN-γ是Th1型细胞因子的重要成员之一,主要由活化的CD4+T细胞及NK细胞分泌。IFN-γ具有较强的抗肿瘤免疫调节功能:促进巨噬细胞杀伤肿瘤细胞及吞噬微生物;提高MHC-I类分子表达,诱发多种细胞表达MHC-Ⅱ类分子;加速T、B淋巴细胞分化。因此,测定CTL效应细胞体内IFN-γ的分泌水平可以反映其诱导Th1型细胞免疫的能力[21]。IL-2是诱发T细胞、NK细胞反应和刺激细胞增殖的细胞因子,具有较好的非特异性抗肿瘤免疫反应[22]。IL-10和TGF-β是免疫抑制因子,不能有效活化T细胞产生特异性抗肿瘤效应,即出现T细胞免疫耐受。因此,抑制体内IL-10和TGF-β水平可逃避T细胞免疫耐受,刺激细胞因子的合成及分泌,促进Th1细胞分化及CTL增殖,增强细胞毒性作用[23]。本实验结果显示,WT1多肽疫苗治疗组IFN-γ、IL-2及IgG水平明显高于其他组,说明WT1多肽疫苗刺激效应细胞提高体内IFN-γ、IL-2及IgG水平发挥抗肿瘤效应。WT1组IL-10及TGF-β水平明显低于其他组,说明WT1多肽疫苗可以通过抑制效应细胞IL-10和TGF-β的分泌,解除免疫抑制,增强机体的抗肿瘤能力。
总而言之,WT1多肽疫苗在体内可有效发挥CTL杀伤效应,促进肿瘤细胞变性坏死,提高CD3+/CD4+T细胞、CD3+/CD8+T细胞、IFN-γ、IL-2及IgG水平,下调免疫抑制因子CD4+/CD25+T细胞、IL-10及TGF-β水平。动物实验结果表明,WT1多肽疫苗可作为免疫治疗的有效靶分子应用于单核细胞白血病的免疫治疗,但能否将WT1多肽疫苗推广应用于M5的临床治疗,还需要进一步研究来提供依据。
