雌雄小鼠对伤害性刺激敏感度不同和缰外侧核反应有关
2019-09-10景兴科马小兰景玉宏
景兴科,马小兰,尹 洁,景玉宏
(1. 宝鸡职业技术学院医学院,陕西宝鸡 721013;2. 兰州大学基础医学院人体解剖与组织胚胎学研究所,甘肃兰州 730000)
研究表明雌雄小鼠对伤害性刺激的表现不同,雌性小鼠对伤害性刺激更为敏感,尚不明确雌雄小鼠对伤害性刺激的不同反应是否与脑内相关核团对伤害性信息的敏感度不同有关[1]。伤害性信息的巩固与储存和缰外侧核的关系非常密切,缰外侧核是大脑的一个重要组成部分,进化上相对保守,啮齿类动物的缰外侧核位于大脑皮层下、脑的中轴线附近,属于上丘脑的一部分,和其他核团分界清晰,分内外侧两部分,和分泌多巴胺的腹侧被盖核及分泌5-羟色胺(5-HT)的中缝背核之间有往返的纤维联系[2-3]。基于神经影像学研究发现抑郁患者缰外侧核活动度增加[4],在抑郁动物模型上也有类似发现[5],因此,缰外侧核是治疗重症抑郁的重要靶点。CaMK-2β是调节神经细胞内钙信号的重要蛋白,在多个脑区有表达[6]。研究表明小鼠给予伤害性刺激诱导抑郁样行为,缰外侧核神经元CaMK-2β表达水平会明显升高,给抗抑郁药氟西汀能显著下调缰外侧核中CaMK-2β蛋白的表达,抑郁症状也随之好转[7]。抑郁及创伤后应激综合征(PTSD)呈现出较为明显的性别差异,女性的发病率明显高于男性,但基础研究大多采用雄性动物,很少做雌雄两类动物的比较,有关缰外侧核的性别差异也鲜有报道。雌性和雄性动物对伤害性刺激的反应不同,是否和伤害性刺激导致的缰外侧核神经元反应性不同有关,目前尚不清楚。本研究探讨给予等量的伤害性刺激后,雌性和雄性C57B/L小鼠对伤害性信息的存储和反应有何不同,与缰外侧核CaMK-2β的表达有何关系,以期为同类研究提供实验参考。
1 材料与方法
1.1 实验材料CaMK-2β抗体购自Proteintech公司,GAPDH购自Immunoway公司,DAB试剂盒购自中杉金桥生物公司,一抗及二抗均购自北京博奥森公司。蛋白提取试剂盒购自上海碧云天生物科技公司。其他普通试剂购自上海生物工程公司。
1.2 实验动物60只SPF级C57B/L小鼠,体质量20~22 g(兰州大学实验动物中心提供),小鼠龄2个月,雌雄分开,每笼4只,安静清洁环境饲养,12 h光照周期,温度22~25 ℃,湿度40%左右,水和食物供给充分。适应环境1周后,利用旷场实验筛选探索行为相对趋同的48只小鼠用于实验,其中雌雄小鼠各24只,分别随机分为对照组(Control,无给电刺激)和电刺激组(stress),共4组。24 h后检测动物对伤害性场景的反应,48 h后检测小鼠条件性消退反应,随后处死动物,取材用于检测。全部实验经兰州大学医学实验动物伦理委员会批准。
1.3 行为学实验实验装置:泰盟STT-100穿梭实验视频分析系统。穿梭箱由2个箱体组成,每个箱体的规格(长×宽×高)为:14.3 cm×15.5 cm×21.0 cm,穿梭门洞4.0 cm×3.7 cm,顶部装有红外摄像头可记录小鼠的活动,底部为电栅栏(栅栏直径4 mm,中心距8.9 mm)与电刺激器相连。
训练过程(伤害性信息建立):包括测试场景的学习和熟悉、伤害性刺激信息的建立。第1天每只小鼠在1号穿梭箱适应180 s后接受5次声音和足底配对刺激(声音4 s,足底电刺激24 V,0.5 s,间隔60 s,图1A)。
伤害性场景测试(图1B):训练后24 h,放置小鼠于2号箱内,关闭声音刺激,去除电刺激,但有光刺激,持续时间3 min,记录小鼠在进入2号箱内,光照后静止不动的时间,作为探索潜伏期,以此时间长度代表动物对伤害性刺激的巩固程度。
条件性消退测试(图1C、D):伤害性场景测试完成后24 h,小鼠置于1号箱,给予声音刺激(4 s),但没有电刺激,声音刺激促使小鼠进入2号箱,2号箱内有光刺激,3个循环。测试期,关闭穿梭门洞,小鼠直接置于1号箱内,给予声音刺激(4 s),观察3 min内小鼠在1号箱内静止不动的时间,作为探索潜伏期,此时间长度代表给予消退治疗后小鼠对伤害性场景信息的巩固程度。

图1 行为学测试
Fig.1 Behavioral test
A:非条件联合条件刺激模式图;B:24 h后,检测小鼠对刺激场景反应的模式图;C:48 h后,给予3次消退训练,消退训练模式图;D:检测消退训练后对条件刺激反应模式图。
1.4 小鼠全脑连续冠状切片共4组动物,每组选取6只小鼠,共24只。水合氯醛(350 mg/kg,i.p)麻醉,固定于手术台上,开胸,暴露心脏,经左心室穿刺进针,连接蠕动泵,持续匀速(28 r/min)灌注9 g/mL的生理盐水20 min,灌注时长5 min。保证循环系统的血液全部置换冲洗干净,然后灌注0.1 mol/L 磷酸盐缓冲液(PB)配置多聚甲醛(40 g/L,PA)固定液30 mL,灌注时长7 min。灌注完毕,打开颅骨,分离全脑,剥除脑膜,继续放入PA后固定12 h,经梯度蔗糖脱水,恒冷切片机切片,全脑连续冠状冰冻切片,片厚25 μm,收集于冷冻保护液中,-20 ℃保存备用。
1.5 免疫组化染色参照小鼠脑图谱,选取缰外侧核平面(AP:-0.94 mm~-2.18 mm,以bregma为参照点)。采用漂片法,切片经0.01 mol/L磷酸盐缓冲盐水(PBS)漂洗5 min,3次。加入0.3 mL/L过氧化氢,室温孵育30 min。0.01 mol/L PBS漂洗,加入100 mL/L羊血清,37 ℃孵育1 h,加入兔抗CaMK-2β抗体(1∶200)4 ℃过夜,漂洗,加入生物素化羊抗兔IgG(1∶200),37 ℃孵育2 h。0.01 mol/L PBS漂洗,加入Strep-avidin-HRP(1∶200),37 ℃孵育2 h,0.01 mol/L PBS漂洗。DAB显色,脱水、透明、树胶封片,显微镜下观察并拍照。
1.6 缰外侧核新鲜脑组织分离和总蛋白提取4组动物,每组选取6只,断头处死,冰台上分离全脑,体视显微镜下分离缰外侧核。分离的新鲜组织,称重,加入RIPA蛋白裂解液(含有蛋白酶抑制剂),剪碎,经细胞超声破碎,提取总蛋白。利用Nanao Drop检测蛋白浓度。
1.7 Western blot检测缰外侧核CaMK-2β蛋白表达配置100 mL/L SDS-PAGE,蛋白上样总量为100 μg。电泳分离,转至PVDF膜,50 g/L脱脂牛奶封闭。加入兔抗CaMK-2β抗体(1∶1 000),4 ℃过夜,0.1 mol/L TBST漂洗,加入羊抗兔IgG-HRP(1∶2 000)。内参照加入小鼠抗GAPDH抗体(1∶2 000)。利用化学放光法显色,条带经灰度扫描,用相对表达量表示。
2 结 果
2.1 雌雄小鼠行为学测试结果伤害性场景测试结果可见,雌性小鼠[(23±3.1)s]在测试箱内(2号箱)对条件刺激诱导的潜伏期时间明显长于雄性小鼠[(10.2±2.6)s,图2A,P=0.007]。条件性消退测试结果可见,雌性小鼠对条件刺激诱导的潜伏期时间[(13.2±2.4)s]明显长于雄性小鼠[(9.6±2.1)s,图2B,P=0.032]。上述结果表明雌性小鼠对非条件刺激的敏感性高于雄性小鼠,且雌性小鼠对条件性消退训练的耐受性高于雄性小鼠。
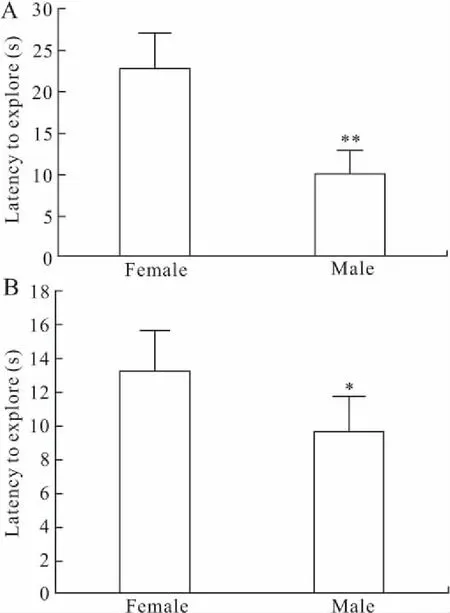
图2 雌雄小鼠行为学测试结果
Fig.2 Results of behavioral test (n=12)
A:雌雄小鼠对条件刺激反应潜伏期;B:雌雄小鼠对消退训练后刺激反应潜伏期。与雌性小鼠比较,*P<0.05,**P<0.01。
2.2 各组小鼠缰外侧核CaMK-2β阳性细胞计数在连续冠状切片上,每只动物挑取缰外侧核3~5个平面,免疫组织化学技术检测缰外侧核CaMK-2β阳性细胞数量。结果发现非条件刺激后48 h,雌性小鼠缰外侧核CaMK-2β阳性细胞计数[(210±8.9)μm2]明显高于对照组[(133.3±7.6)μm2],但雄性小鼠两组之间没有统计学差异(图3)。这说明伤害性刺激诱导雌性小鼠缰外侧核更多神经元出现活化。
2.3 各组小鼠缰外侧核CaMK-2β蛋白的表达水平Western blot结果显示,伤害性刺激后48 h,雌性小鼠缰外侧核CaMK-2β表达水平比对照组升高了1.43倍,差异有统计学意义(图4,P=0.027);雄性小鼠CaMK-2β和对照组比较无统计学意义(P=0.083)。
3 讨 论
神经退行性疾病及神经精神类疾病常常表现出一定的性别倾向,如阿尔茨海默病患者女性多于男性,帕金森病患者男性多于女性,抑郁和焦虑则女性更为易感[8],研究脑的性别二态性,可能会对此类疾病的发生提供有意义的解释。啮齿类动物也有类似反应,雌性和雄性小鼠对伤害性刺激的反应阈值往往不同,主要表现为雌小鼠对伤害性刺激更为敏感,更容易强化该行为信息,对此类伤害性信息的消退需要更长时间。这一特性可能是由于进化过程中,雌性动物在种群延续方面付出更多,因此行为模式的选择更为谨慎,攻击性、冒险性行为相对降低,伤害性信息在雌性动物脑内的预警系统阈值更低[9]。

图3 免疫组织化学技术检测小鼠缰外侧核CaMK-2β的表达
Fig.3 Immunohistochemical detection of the expression level of CaMK-2β in the lateral habenula nucleus (n=6)
A:CaMK-2β免疫组化代表性图片。虚线示意缰外侧核的位置,右上角黑框图片系虚线区局部高倍放大;蓝色箭头示意阳性细胞。B:阳性细胞计数。Control:对照组;stress:非条件联合条件刺激组。与对照组比较,*P<0.05。

图4 Western blot检测小鼠缰外侧核CaMK-2β的表达
Fig.4 The expression level of CaMK-2β in the habenula detected by Western blot (n=6)
A:Western blot检测结果;B:利用灰度扫描计算的CaMK-2β相对表达的比较。与对照组比较,*P<0.05。
行为的性别差异意味着脑的结构和功能存在性别二态性,哺乳动物性别二态性最明显的脑区是下丘脑的视前核,该区域和生殖行为关系密切,损伤雌性大鼠视前核导致动情周期及母性行为发生变化[10]。形态上,雄性大鼠视前核是雌性的5~8倍,人的视前核也呈现性别差异,男性是女性的2倍[11]。外侧缰外侧核不但在种系进化上相对保守,其功能也非常复杂,一般认为外侧缰外侧核在前脑与后脑、中脑单胺类神经元信息传导中起到重要的调节作用[12-13],涉及非常广泛的功能调节,如疼痛、对压力刺激的适应性反应、母性行为、昼夜节律、睡眠、成瘾、焦虑和抑郁等[14-17]。最近研究发现,缰外侧核参与负性情绪相关的神经信息处理,决定信息输出的阈值,与重度抑郁发病过程中无助感和快感缺失症状关系密切[18-19]。但对缰外侧核是否在结构上存在性别差异尚未见相关报道。本研究结果显示,雌性小鼠和雄性小鼠缰外侧核的形态并没有明显差异,对雌雄小鼠缰外侧核细胞密度(尼氏染色)的定量测量也未见显著差异(数据未展示)。但雌性小鼠对伤害性刺激的敏感性以及对伤害性信息消退的耐受性和雄性小鼠比较存在明显差异,这一差异可能和缰外侧核CaMK-2β的表达有关;雌性小鼠缰外侧核伤害性刺激诱导的CaMK-2β表达水平明显高于对照组,而CaMK-2β水平可以作为缰外侧核神经元活动性的标志,可以推断,在伤害性刺激后48 h,雌性小鼠缰外侧核神经元依然处于较高的活动水平,而雄性小鼠CaMK-2β的表达和正常对照组比较没有统计学差别,与行为学检测结果基本一致。
行为的性别差异是自然界非常普遍的现象,该差异很大程度上和中枢神经系统结构上的微细差别有关,尤其是本能行为,如求偶和幼仔照护行为在雌雄动物之间有明显不同[20-22]。哺乳动物神经结构上的细微差异可能是神经发育过程中雌激素和雄激素调控的结果。现有的研究证据也表明雌激素和雄激素通过各自的受体,影响神经元内性别特异性基因的表达,诱导发育期神经元发生不可逆分化,改变特定脑区神经元数量和神经元之间的连接方式,导致神经功能出现性别差异[23-27]。雄激素和雌激素受体在很多脑区均有表达,参与了神经功能的调节。其中腹侧被盖的多巴胺神经元和中缝背核的5-HT神经元发现有雌激素受体和雄激素受体的分布[28],这两个脑区参与奖赏环路和行为的动机形成,伤害性刺激诱导的厌恶行为,导致动物对伤害性环境的逃避增加、探索行为减少。目前认为缰外侧核是厌恶行为和逃避行为调节的关键脑区[29],腹侧被盖及中缝背核是奖赏行为调节的关键脑区[30]。缰外侧核和腹侧被盖及中缝背核之间有往返纤维,这表明对某种刺激,选择厌恶性逃避还是进一步探索,可能是上述脑区协同调节的结果。如果缰外侧核神经元有更多活化,对腹侧被盖及中缝背核的抑制可能增加,表现为探索行为减少。反之,奖赏环路活化,探索行为增加。本研究中,伤害性刺激导致的缰外侧核神经元活化(表现为CaMK-2β表达水平增加)可能抑制了奖赏环路,减少了行为动机,表现为探索行为的减少。但有关伤害性刺激的性别差异和缰外侧核在其中的作用,需要更多研究予以证实,尤其性激素在缰外核神经元的分布及调节功能需要进一步的研究。
