边缘前皮质α2肾上腺素受体调节帕金森病模型大鼠的抑郁样行为
2019-09-10吴仲恒惠艳娉李立博张巧俊
吴仲恒,王 涛,惠艳娉,李立博,张巧俊
(1. 西安交通大学第二附属医院康复医学科,陕西西安 710004;2. 西安交通大学医学部基础医学院生理学与病理生理学系,陕西西安 710061)
内侧前额叶皮质(medial prefrontal cortex, mPFC)在执行控制、整合感觉及情感等相关行为中起重要调控作用,影像学研究也显示,mPFC活动的增加与负性情绪的抑制有关,而mPFC活动的缺失与抑郁症状有关[1]。其中,位于mPFC腹侧部的边缘前皮质(prelimbic cortex, PrL)和边缘下皮质,主要参与情感、认知及记忆等活动调节[2-3]。前期研究显示,大鼠PrL内急性注射氯化钴可逆性灭活其功能,产生抗抑郁样作用[4]。本课题组研究显示,激活或阻断大鼠PrL内5-羟色胺(5-hydroxytryptamine, 5-HT)受体(5-HT1A/7)和α1肾上腺素受体可调控大鼠的抑郁行为[5-7]。可见PrL参与大鼠抑郁行为的调节。
肾上腺素受体主要由β、α1和α2构成,其中位于突触前膜α2肾上腺素受体属于自身受体,激活后可以抑制突触前肾上腺素能神经元合成和释放去甲肾上腺素(noradrenaline, NA),从而发挥负反馈调节作用[8],α2肾上腺素受体也分布在突触后的非肾上腺素能神经元而发挥重要的神经调节作用[9]。研究显示,α2肾上腺素受体功能失调与抑郁障碍密切相关[10]。
帕金森病(Parkinson’s disease, PD)的非运动系统症状如抑郁、焦虑等受到越来越多的关注,而且是导致患者生活质量下降的重要影响因素。以往研究和本课题组前期实验已经证实,采用6-羟基多巴胺(6-hydroxydopamine, 6-OHDA)损毁内侧前脑束(medial forebrain bundle, MFB)制备的PD大鼠模型具有抑郁样的临床特征,很好模拟了PD的非运动系统症状[5-7,11]。然而,6-OHDA损毁MFB后PrL内NA系统功能变化与抑郁的关系目前报道较少,尤其α2肾上腺素受体刺激后对PD模型相关抑郁行为的影响,目前尚无相关报道。本研究通过蔗糖偏爱和强迫游泳实验(forced swim test, FST)证明6-OHDA单侧损毁MFB后是否诱导大鼠抑郁样行为;观察激活或阻断PrL内α2肾上腺素受体对大鼠抑郁样行为的影响。
1 材料与方法
1.1 实验动物实验选用成年、雄性Sprague-Dawley大鼠146只,体质量225~320 g,由西安交通大学动物实验中心提供。动物许可证号:SCXK(陕)2012-003。大鼠在标准环境下饲养,12 h昼/夜循环,室温(22±2)℃,自由饮水、摄食。实验过程最大限度减少动物用量和减轻动物的痛苦。
1.2 主要试剂与仪器6-OHDA、阿朴吗啡(apomorphine, APO)、盐酸可乐定(clonidine hydrochloride)和盐酸咪唑克生(idazoxan hydrochloride)等购自美国Sigma公司。脑立体定位仪 (SN-2N)、微电极推进器(SM-21)、牙科电钻(PK-500)、数码摄像机(HR-550E)和微量注射器等。
1.3 大鼠PD模型的建立和检测大鼠被随机分为假手术组和MFB损毁组,每组73只。经腹腔注射40 g/L水合氯醛(400 mg/kg)麻醉成功后,将大鼠头部固定于脑立体定位仪上。根据Paxinos-Watson大鼠脑立体定位图谱确定右侧MFB位置(AP-4.4 mm,ML 1.2 mm,DV 7.8 mm距硬脑膜)[12]。利用牙科电钻在定位点钻孔,直径约2 mm,暴露脑表面。在钻孔上方固定充灌6-OHDA(12 μg)溶液的10 μL微量注射器,注射器前端粘有玻璃微电极,利用微电极推进器缓慢进针,到达注射部位后按0.5 μL/min缓慢注射4 μL,注射完毕后留针5 min,然后缓慢退针,缝合皮肤,再次消毒手术部位皮肤。以同样方式,在假手术组大鼠注射4 μL生理盐水作为对照。
外科手术1周后,采用APO诱发旋转实验评估6-OHDA损毁是否成功。大鼠颈部皮下注射APO(0.05 mg/kg),注射后15 min内,如果大鼠出现向6-OHDA损毁MFB对侧的持续旋转行为,且5 min内旋转次数大于20圈以上,则判定为合格的PD模型[13],可用于进一步的实验。
1.4 导向套管的埋置和PrL内药物注射参考Paxinos-Watson大鼠脑立体定位图谱确定右侧PrL位置(AP+3.3 mm,ML 0.7 mm,DV 2.0 mm距硬脑膜)[12]。利用牙科电钻在PrL颅骨表面定位标记点钻直径约2 mm的小孔,暴露脑表面。用螺丝刀在定位小孔周围拧紧消毒的3~4枚小螺丝。将不锈钢套管固定在夹持器上,定位在PrL定位孔上方,利用微量推进器将套管缓慢推进至PrL上方1 mm处,然后用牙科水泥均匀涂抹固定套管和螺丝。待牙科水泥冷却凝固后,小心移除夹持器,并向不锈钢套管内插入不锈钢内芯,防止后期套管因出血、渗出或异物堵塞。大鼠在套管埋置手术完成后恢复1周。
药物注射前,首先把与1 μL微量注射器连接的PE-10导管插入预先埋置的导向套管,导管尖端达套管末端下1 mm处,每次均注射0.5 μL药物,注射时间60 s,注射药物60 s后移除导管。为了检测6-OHDA损毁MFB及PrL内注射药物对大鼠行为的影响,两组大鼠随机分为如下3个亚组:溶媒(生理盐水)组(n=10只)、可乐定组(选择性α2肾上腺素受体激动剂)(1.25、2.5、5 μg/大鼠;n=10只/组)、咪唑克生组(选择性α2肾上腺素受体拮抗剂)(1、2、4 μg/大鼠;n=10只/组)。各药物注射间隔时间5 min,药物注射后10 min开始行为学实验测试,药物剂量基于大鼠在体实验研究报道[14-15]。
1.5 行为学实验所有行为学实验均在MFB内注射含2 g/L抗坏血酸(维生素C)的生理盐水或6-OHDA后第4周内进行。测试时间定于上午9∶00~12∶00间进行,检测地点选择在隔音的房间中进行。整个过程用HR-550E数码相机记录,结果由2名不了解实验分组情况的观察人员进行分析。
1.5.1旷场实验 选择旷场实验评估PrL内注射药物或6-OHDA损毁MFB对大鼠自发运动能力的影响[16]。旷场装置:黑色有机玻璃围成规格为100 cm(长)×100 cm(宽)×40 cm(高)的方形结构,内壁及底部为瓷白色,黑色线条将白色底部划分为25个20 cm×20 cm的方格。大鼠最初均被置于旷场中心,然后记录大鼠自发运动行为,主要观察指标包括穿格次数(代表大鼠水平运动能力)、站立次数(代表大鼠垂直活动能力)。
1.5.2FST观察 FST是用于评测各种原因导致抑郁和抗抑郁疗效的经典实验[17]。实验装置由透明树脂玻璃制成的圆柱形容器,直径34 cm,高45 cm,内充水的深度30 cm、温度(25±2)℃。预先将大鼠轻柔放入水中,适应性游泳训练15 min,24 h后开始正式测试,将大鼠放入该圆柱桶实验容器内,观察它们反应5 min并记录大鼠游泳“不动时间”。当大鼠静止漂浮于水面或仅有少量的动作以保持头部露于水面上时被认为是“不动状态”,不动时间的延长代表抑郁样行为[18]。
1.5.3蔗糖偏爱实验 蔗糖偏爱实验被广泛用于评测大鼠快感缺乏,快感缺乏是抑郁症的核心症状之一[19]。通过测量水和蔗糖消耗量以计算蔗糖偏爱比率,计算公式:蔗糖偏爱百分比=蔗糖水摄入量(g)/[蔗糖水摄入量(g)+水摄入量(g)]×100%。
1.6 组织学与免疫组织化学染色行为学实验完成后,用40 g/L水合氯醛(600 mg/kg)对大鼠进行深度麻醉,然后用0.01 mol/L PBS溶液150 mL快速心脏灌注,40 g/L多聚甲醛250 mL进行固定。断头,剥离脑组织,将剥离好的脑组织后固定4 h后转移至含300 g/L蔗糖溶液中直至沉底。在恒冷切片机上行连续冠状冰冻切片,片厚30 μm。对包含黑质致密部(substantia nigra compacta, SNc)和腹侧被盖区(ventral tegmental area, VTA)区的组织切片行酪氨酸羟化酶(tyrosine hydroxylase, TH)免疫组织化学染色,用于观察DA神经元的变性丢失程度评估MFB损毁情况。TH染色后对SNc及VTA中DA能神经元进行计数,每只大鼠选取3张切片进行计数后计算平均值。
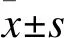
2 结 果
2.1 各组TH阳性神经元计数结果假手术组大鼠中,未注射侧与生理盐水注射侧内SNc和VTA区TH阳性神经元计数没有明显差异(P>0.05)(n=8,图1A)。在6-OHDA损毁MFB组大鼠中,6-OHDA注射侧VTA中的TH阳性神经元数目较未注射侧显著下降至(47±5)%(P<0.001,n=8,图1B)。而SNc中的TH阳性神经元几乎完全丢失。
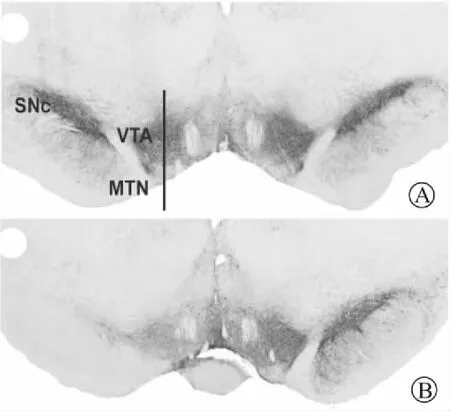
图1 假手术大鼠(A)和6-OHDA损毁组(B)大鼠中脑SNc和VTA的TH染色结果
Fig.1 TH immunostaining of the midbrain in the sham-operated (A) and the 6-OHDA lesioned rats (B)
左侧为注射侧,右侧为未注射侧。MTN:内侧终核(medial terminal nucleus of the accessory optic tract)。标尺=1 mm。
2.2 MFB损毁及PrL内α2肾上腺素受体激活和阻断对大鼠自发运动能力的影响在旷场实验中观察单侧6-OHDA损毁MFB以及PrL内分别注射生理盐水、可乐定和咪唑克生对大鼠水平及垂直运动能力的作用,结果表明6-OHDA损毁MFB后各组大鼠在水平运动和垂直运动能力均降低(F1,80=177.5,P<0.001;F1,80=358.950,P<0.001;F1,80=142.878,P<0.001;F1,80=260.942,P<0.001;图2,双因素方差分析)。多重比较表明,与同组溶媒组相比,PrL局部注射不同剂量的可乐定(1.25、2.5、5 μg/大鼠)和咪唑克生(1、2、4 μg/大鼠)未改变大鼠的运动能力,交互因素(MFB损毁×药物)对各组大鼠的水平和垂直运动能力无影响(图2)。

图2 6-OHDA损毁MFB和PrL局部注射可乐定或咪唑克生对大鼠自发运动能力的影响
Fig.2 Effects of complete unilateral 6-OHDA lesion of the MFB and intra-PrL injection of clonidine or antagonist idazoxan on locomotor activity measured by the open-field test
A、B:水平运动;C、D;垂直运动。与假手术组(Sham组)相比,***P<0.001;n=10;双因素方差分析、检验后多重比较采用Bonferroni检验。
2.3 6-OHDA损毁、激活和阻断PrL内α2肾上腺素受体对大鼠抑郁行为的影响6-OHDA损毁MFB及PrL内局部注射可乐定或咪唑克生对大鼠在FST中不动时间影响的双因素方差分析的结果显示,6-OHDA损毁MFB(F1,80=470.3,P<0.001;F1,80=100 1.0,P<0.001)和PrL内局部注射可乐定(F3,80=9.15,P<0.001)和咪唑克生(F3,80=10.7,P<0.001)后大鼠的不动时间均发生明显变化(图3A、B)。多重比较结果显示,在假手术组大鼠中,PrL局部注射可乐定2.5、5 μg后不动时间较溶媒组明显增加(P<0.05);而6-OHDA损毁MFB大鼠在注射可乐定5 μg的不动时间增加才具有统计学意义(P<0.001)。而假手术组和6-OHDA损毁MFB组大鼠PrL内局部注射咪唑克生的不动时间均出现不同程度缩短,假手术组2、4 μg注射组不动时间明显缩短(P<0.05),6-OHDA损毁MFB组4 μg剂量时不动时间明显缩短(P<0.001)。交互效应(MFB损毁×药物)对各组大鼠在FST中的不动时间没有影响(图3A和3B)。
6-OHDA损毁MFB及PrL内注射可乐定或咪唑克生对大鼠蔗糖偏爱影响的双因素方差分析的结果显示,6-OHDA损毁MFB(F1,80=60.518,P<0.001;F1,80=98.162,P<0.001)、PrL内注射可乐定(F3,80=7.258,P<0.001)或咪唑克生(F3,80=7.258,P<0.001)均影响大鼠蔗糖偏爱(图3C、D)。多重比较显示,在假手术组大鼠,与局部注射生理盐水相比,PrL局部注射2.5、5 μg可乐定时,蔗糖消耗量明显减少(P<0.05);而6-OHDA损毁MFB大鼠在注射5 μg可乐定时,蔗糖消耗量明显减少(P<0.001)。而假手术组和损毁组大鼠PrL内局部注射咪唑克生时,蔗糖消耗量出现不同程度增加,假手术组的2、4 μg剂量(P<0.05)组明显增加大鼠蔗糖偏爱,而6-OHDA损毁MFB组4 μg剂量组显著增加大鼠蔗糖偏爱(P<0.001)。交互效应(MFB损毁×药物)对各组大鼠蔗糖偏爱没有影响(图3C、D)。
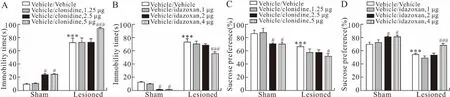
图3 PrL局部注射可乐定(A、C)或拮抗剂咪唑克生(B、D)对大鼠抑郁行为的影响
Fig.3 Effects of complete unilateral 6-OHDA lesion of the MFB and intra-PrL injection of clonidine (A,C) or antagonist idazoxan (B,D) on depressive-like behavior measured by the FST and sucrose preference test
与假手术组(Sham组)比较,***P<0.001;与同组大鼠PrL内注射溶媒比较,#P<0.05,###P<0.001。双因素方差分析、检验后多重比较采用Bonferroni检验。
3 讨 论
本研究证明,单侧6-OHDA损毁MFB导致大鼠的水平运动和垂直运动能力明显下降;单侧6-OHDA损毁MFB延长了大鼠在FST中的不动时间,降低了大鼠蔗糖偏爱,提示诱发大鼠的抑郁样行为;PrL局部注射选择性α2肾上腺素受体激动剂可乐定可诱发或增强假手术组及6-OHDA损毁MFB组大鼠的抑郁样行为,而 PrL局部注射α2肾上腺素受体拮抗剂咪唑克生产生抗抑郁效应,但损毁组需要更高的药物剂量才能诱发相应效应。
旷场实验在动物行为学实验或药理学实验中被广泛用于检测动物的自发运动能力以排除药物本身对于大鼠行为学的影响。本研究中单侧损毁MFB后导致大鼠的水平及垂直运动能力明显下降,这与本课题组之前的研究报道一致[5-7]。本实验PrL内注射可乐定或咪唑克生对假手术组和6-OHDA损毁MFB组大鼠在旷场中的自发运动能力均未产生影响,表明应用α2肾上腺素受体激动剂或拮抗剂诱导的大鼠抑郁行为可以排除运动能力的干扰。
单侧损毁MFB后导致大鼠在FST中不动时间的延长以及在蔗糖偏爱实验中蔗糖消耗量减少,即MFB单侧损毁制备的PD大鼠表现抑郁样行为特征,这与本课题组以前的报道一致[5-7]。抑郁是一种慢性疾病,影响着全世界大约20%人口[20],但其病理生理机制仍不清楚,尤其对于PD抑郁障碍发病机制更知之甚少。抑郁的单胺类神经递质假说显示抑郁的发病与脑内5-HT和NA的缺失有关[21]。因此,现有的抗抑郁药物多数是通过增加这些单胺类递质水平而发挥作用,但这些抗抑郁治疗方案仍存在许多局限性,如约30%患者对抗抑郁药反应效果较差甚至无效。正是基于这些局限性,需要研究新的抗抑郁治疗策略。一项有关新型抗抑郁药米安色林和米氮平的研究显示,药物可能通过阻断α2肾上腺素受体发挥抗抑郁作用[22]。另外,临床证据也显示,具有α2肾上腺素受体拮抗性质的抗抑郁药可以更快地发挥疗效[23]。有研究已经证实,α2肾上腺素受体拮抗剂如育恒宾可以自身发挥抗抑郁作用或改善动物模型中抗抑郁药物的疗效[24]。另一项研究也显示,腹腔注射新型合成胍类和2-氨基咪唑啉类复合物(具有α2肾上腺素受体拮抗性质的药物),导致实验大鼠在悬尾实验和FST中不动时间明显下降,表明具有抗抑郁作用[25]。但也有研究得出不同的结果,腹腔注射α2肾上腺素受体激动剂可乐定在自发运动实验中诱导出抑郁样行为,而在FST中并没有诱导抑郁样行为效应[26]。综上所述,α2肾上腺素受体激动剂或拮抗剂对于抑郁样行为的影响可能涉及更复杂的病理生理机制。上述实验中,给药方式大多数是通过体循环静脉或腹腔注射给药,受全身代谢等因素影响较多。对于PrL脑内局部给予α2肾上腺素受体激动剂或拮抗剂对于抑郁样行为的影响,尤其是6-OHDA损毁MFB后制备PD大鼠模型抑郁样行为的影响目前未见相关报道。本研究结果显示,PrL局部注射选择性α2肾上腺素受体激动剂可乐定可以诱发或增强假手术组及6-OHDA损毁MFB组大鼠的抑郁样行为,而PrL局部注射α2肾上腺素受体拮抗剂咪唑克生可产生抗抑郁效应,但在注射药物发挥作用的有效剂量中,损毁组剂量均高于假手术组。有研究证明,PrL内局部给予5-HT1A受体激动剂或拮抗剂可以调节大鼠抑郁样行为,但损毁组大鼠所应用的药物剂量明显高于假手术组,并且证实与5-HT1A受体在EAAC1(一种神经源性Glu转运体)阳性神经元上的表达下调有关[6]。据此,推测本实验结果可能与PrL内α2肾上腺素受体表达的下调或功能失调有关,但PrL内α2肾上腺素受体主要分布于胞体树突和轴突末梢的突触前膜[27],在细胞体分布较少。因此,需要进一步研究加以证实。
