Nac-1在神经干/祖细胞自我更新维持中的作用
2019-09-10崔晓萍陈建梅叶建新穆军山王魁花
崔晓萍,陈建梅,叶建新,穆军山,王魁花,林 航
(福建医科大学附属教学医院福州总医院:1. 神经内科;2. 骨一科,福建福州 350001)
神经干/祖细胞(neural stem/progenitor cells, NSPCs)具有自我更新和分化成多种神经细胞的潜能,是研究神经发育的理想模型;NSPCs作为潜在的修复中枢神经系统损伤的工具细胞,也具有很好的应用前景。研究NSPCs自我更新的分子机制,明确调节NSPCs自我更新和神经分化的关键调节基因对于阐明神经发育机制、了解神经系统疾病的发生有重要意义,也是发现潜在的治疗靶点以及实现神经细胞修复替代和功能重建等大规模临床应用的前提[1]。
参与NSPCs自我更新维持的一些基因如c-Myc、CIP2A等[2],均是原癌基因,研究其在NSPCs中的功能,不仅有助于阐明神经发育机制,对于NSPCs临床应用的安全性也至关重要。Nac-1(nucleus accumbens1)是POZ/BTB家族蛋白,因最先在大鼠脑伏核区发现得名,在脑组织中呈现高表达,与可卡因成瘾性有关。最近有研究发现,Nac-1对多种肿瘤的生长和复发有促进作用[3],也是胚胎干细胞(ESCs)多能性维持的核心转录因子成员。而目前尚未见关于Nac-1在NSPCs的多能性维持中作用的报道。
NSPCs除了从胚胎和成体的脑组织中分离获得,也可以通过诱导ESCs分化而产生。该细胞类似胚胎皮质心室区(VZ)的放射状胶质细胞,可以在体外连续传代培养,在适当条件下可分化为神经元和胶质细胞,还可充当细胞支架支持祖细胞迁移。更重要的是,ESCs诱导产生的NSPCs增殖速度快,并能够在移植后修复脑损伤,有良好的临床应用前景[4]。本研究主要通过RNA干扰法敲低Nac-1的表达,研究Nac-1在ESCs诱导产生的NSPCs自我更新维持中的作用。
1 材料与方法
1.1 材料细胞培养试剂均购自Gibco公司,细胞因子EGF和FGF2购自Peprotech公司。RNA干扰载体shRNA和对照质粒shCtrls购自Sigma。为排除RNA干扰方法有可能出现的脱靶效应,选取了作用位点不同的两个干扰序列,靶向Nac-1的序列[5]shRNA1:GATGAGCAGTACCGTCAGATC;shRNA2:GGTTTCCAGTCTGGCAGAA,由华大基因公司合成。Lipofectamine 2000购自Invitrogen公司,荧光素酶检测试剂盒购自Promega公司。Nac-1抗体购自Abcam公司,c-Myc抗体购自Santa Cruz公司。
1.2 质粒构建根据说明书将RNA干扰靶向序列插入shRNA载体,建立Nac-1 RNA干扰质粒,命名为Nac1-shRNA1和Nac1-shRNA2。通过PCR从小鼠基因组DNA中扩增c-Myc启动子[5],上游引物(-2 520):ACTGTGTGAGTTTCAGGCTAGCA,下游引物(+525):AGCCTTCAAACAGCTCGAGGAG,并插入到pGL3-Basic载体中,建立pGL3-Myc。
1.3 细胞培养及转染源自ESCs R1(ATCC)的NSPCs为本室保存,从ESCs分化而来,可以长期传代[4,6],在含有20 ng/mL EGF和10 ng/mL FGF2的N2培养基中培养,培养基每2 d更换1次。用含有10 mL/L FBS的N2B27进行分化。贴壁培养时,用多聚-L-鸟氨酸和纤维结合蛋白包被细胞板。同时,常规培养293FT细胞(Invitrogen),用于RNA干扰病毒的包装。
将质粒shCtrls、Nac1-shRNA1和Nac1-shRNA2分别与包装质粒pSPAX2和pMD2G共转染293FT细胞,质粒转染根据Lipofectamine 2000说明书操作。出现明显细胞病变时(转染72 h)取培养上清,6 000 r/min离心取上清,即为对照病毒shCtrls-V和干扰病毒Nac1-shRNA-V1、Nac1-shRNA-V2。
转染与分组:消化NSPCs并计数,分别取1×106细胞,对照组加入对照病毒shCtrls-V,实验组分别加入干扰病毒Nac1-shRNA-V1、Nac1-shRNA-V2,各组均同时加入4 μg/mL聚凝胺(Sigma),37 ℃振摇转染2 h后铺板,培养48 h进行后续实验。
1.4 定量RT-PCR和Western blot检测用Trizol试剂盒分别提取分化前后以及转染各组的总RNA,逆转录试剂盒(Roche)逆转录成cDNA。使用SYBR-PCR试剂,根据荧光定量PCR试剂盒(Roche)说明书进行PCR反应。各待检基因引物序列参照文献[2, 4-5],由华大公司合成,Western blot方法参照文献[7]进行。
1.5 细胞增殖曲线将实验组和对照组细胞消化成单细胞悬液并以1×103/cm2铺于明胶包被的培养皿,每组3皿,分别在接种后4、6、8 d计数。通过锥虫蓝(台盼蓝)染色排除死细胞,并在光学显微镜下用血细胞计数器手动计数。
1.6 流式细胞仪检测细胞凋亡将实验组和对照组细胞消化成单细胞悬液,用FITC-AnnexinV和碘化丙啶(PI)双染法,用流式细胞仪检测细胞凋亡变化。
1.7 荧光素酶分析用0.5 μg pGL3-Myc和0.01 μg pRL-SV40(Promega)共转染实验组和对照组细胞,pGL3-Basic作为空白对照,转染方法按照Lipofectamine 2000说明书进行。转染后48 h裂解细胞并使用双荧光素酶检测试剂盒(Promega)测量萤光素酶活性。

2 结 果
2.1 Nac-1在NSPCs中高表达并随着NSPCs的分化而下降该细胞系贴壁生长成双极性,在含有10 mL/L FBS的N2B27中分化7 d的NSPCs呈现多种形态(图1A)。
定量PCR检测显示:本室传代培养的NSPCs中,自我更新标记物Pax6、SOX2的mRNA高水平表达,分化培养7 d后显著下降;说明本实验细胞系能够在体外维持自我更新。而神经元和胶质细胞的标记物(其中神经元:MAP2;星形胶质:GFAP;少突胶质:OSP)在分化细胞中显著升高(图1B),说明该细胞系有向多个神经谱系分化的潜能。可见,本实验所用的细胞系具有神经干细胞的特性。
同时,在NSPCs分化前后,Nac-1的mRNA表达有明显差异,分化后下降了77%(图1B),提示Nac-1可能在NSPCs的自我更新维持过程中发挥功能。

图1 ESCs来源的NSPCs的鉴定
Fig.1 The identification of NSPCs derived from ESCs
A:NSPCs分化前后的形态比较;B:定量RT-PCR方法检测NSPCs分化前后各种标记物(自我更新:SOX2、Pax6;神经元:MAP2;星形胶质:GFAP;少突胶质:OSP)的表达水平。与分化前相比较,*P<0.05。
2.2 Nac-1的敲低效果观察及其对NSPCs增殖的影响定量PCR结果显示:与对照组(对照病毒shCtrls-V感染NSPCs)相比,实验组(感染干扰病毒Nac1-shRNA-V1、Nac1-shRNA-V2的NSPCs)中Nac-1的mRNA水平均显著下降,干扰效率分别是69%和66%;Nac-1的蛋白水平检测也显示RNA干扰取得了预期的效果(P<0.05,图2)。
Nac-1敲低时(实验组)NSPCs死细胞明显增多;增殖曲线显示,细胞增殖效率明显降低;Annexin-V染色的流式检测结果显示,Nac-1敲低时,细胞凋亡率比对照细胞显著增高,特别是早期凋亡增高明显,从4.13%增加到11.1%和9.62%(P<0.05,图3)。Nac-1的表达水平与NSPCs的凋亡率呈现负相关,提示Nac-1可能具有抑制细胞凋亡的作用,这可能是Nac1影响NSPCs增殖的主要原因。
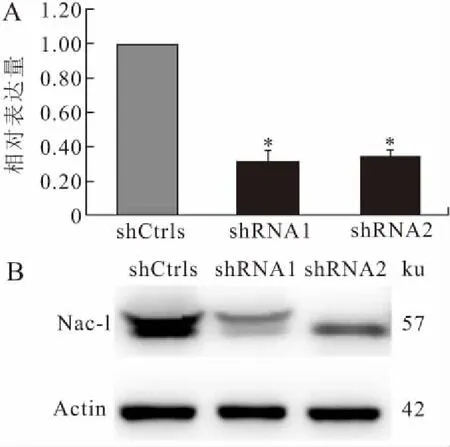
图2 Nac-1敲低的NSPCs中Nac-1的mRNA和蛋白表达的检测结果
Fig.2 The mRNA and protein expression of Nac-1 in NSPCs with Nac-1 knockdown
A:定量RT-PCR检测结果;B:Western blot检测结果。shCtrls:对照病毒感染组(对照组);shRNA1、shRNA2:干扰病毒感染组(实验组)。与对照组(shCtrls)比较,*P<0.05。
2.3 Nac-1敲低对NSPCs分化潜能的影响定量PCR检测NSPCs的自我更新和分化标志物的mRNA水平,结果显示,Nac-1敲低时细胞中SOX2和Pax6表达降低,而神经元和胶质细胞的标记物MAP2、GFAP和OSP均有升高(图4)。说明Nac-1对NSPCs的干性维持有重要作用。
2.4 Nac-1对c-Myc的转录调控作用对凋亡途径P53通路的活化情况和c-Myc的mRNA水平的检测结果显示,p53和p21(p53的靶基因,其表达水平可反映p53通路的活化)的mRNA表达在Nac-1敲低的NSPCs中变化不明显,而c-Myc的mRNA表达在Nac-1敲低时分别降低了46%和57%(图4)。
Western blot检测结果显示c-Myc的蛋白表达变化(图5A)与mRNA变化一致,说明c-Myc的表达可能受到Nac-1的调控。
荧光素酶实验检测结果显示,Nac-1敲低组细胞中,荧光素酶的活性下降了24%和36%;Nac-1敲低时NSPCs中c-Myc表达降低(图5B),说明Nac-1可调控NSPCs中c-Myc的转录活性。
Nac-1缺失引起的增殖缓慢、凋亡增加以及趋于分化等表型变化,可能均与c-Myc水平降低有关。另外,c-Myc还有促进NSPCs自我更新的作用[2],故Nac-1对NSPCs自我更新的影响可能也由c-Myc介导。


图3 RNA干扰敲低Nac-1时NSPCs的增殖和凋亡情况Fig.3 Detection of proliferation and apoptosis of NSPCs with Nac-1 knockdownshCtrls:对照病毒感染组(对照组);shRNA1、shRNA2:干扰病毒感染组(实验组)。A:细胞形态观察;B:增殖曲线;C:细胞凋亡。
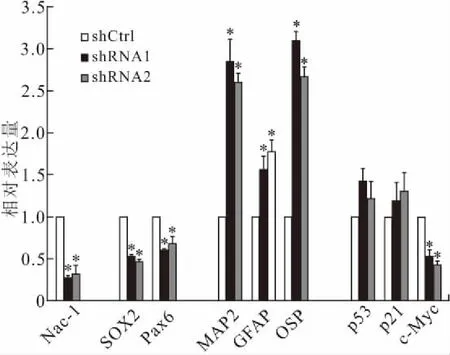
图4 Nac-1敲低时NSPCs中自我更新、分化及凋亡标志物的mRNA表达变化
Fig.4 mRNA expression of self-renewal, differentiation and apoptosis markers in NSPCs with Nac-1 knockdown
shCtrls:对照病毒感染组(对照组);shRNA1、shRNA2:干扰病毒感染组(实验组)。与对照组比较,*P<0.05。
3 讨 论
Nac-1在脑组织中呈现高表达,既往的研究主要集中在其与可卡因成瘾性的关系。本研究主要关注Nac-1在NSPCs自我更新维持中的作用,实验发现,敲低Nac-1表达,不仅不利于NSPCs增殖,也不利于其干性维持,因此,Nac-1是NSPCs自我更新所必需。
Nac-1所属的POZ/BTB蛋白家族,包括涉及正常细胞周期调控和特定恶性肿瘤发展的几种转录因子(BCL6和PLZF等),可以通过转录作用调控果蝇和哺乳动物的神经系统发育[8]。Nac-1与其他的POZ/BTB蛋白家族成员不同之处是其没有典型的DNA结合结构域,其C末端的BEN基序可能介导Nac-1的转录调节功能,但其转录调控作用尚不明确。本研究显示,Nac-1可以调控NSPCs中c-Myc的转录,并在NSPCs自我更新维持中必不可少。有研究报道,ESCs中Nac-1的功能发挥也与c-Myc有关[5],提示Nac-1/c-Myc可能是ESCs和NSPCs干性维持共有的调节途径。
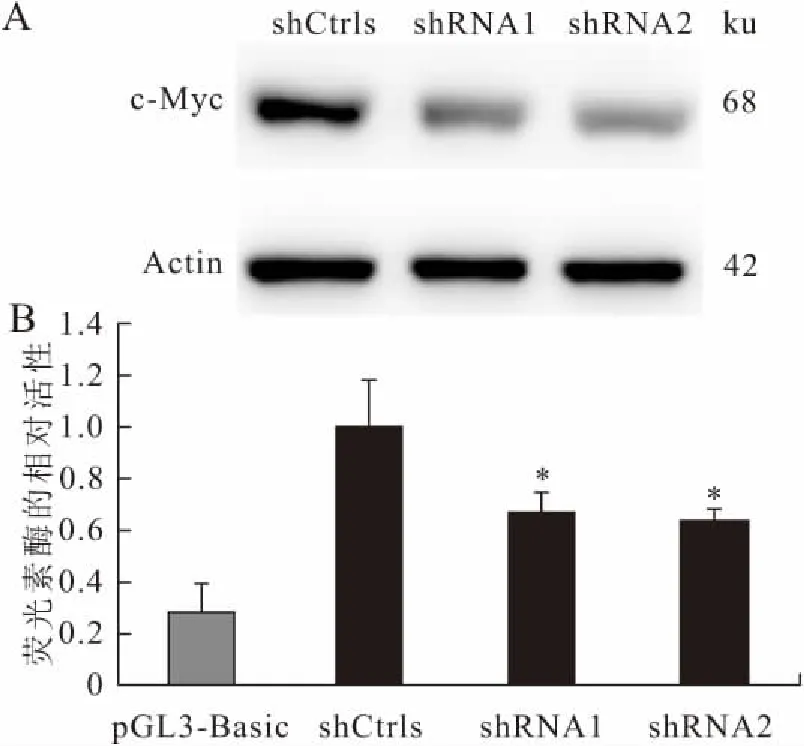
图5 Nac-1敲低影响c-Myc的转录及表达水平
Fig.5 Nac-1 knockdown reduced the transcription and expression levels of c-Myc
A:Western blot检测结果;B:荧光素酶实验检测Nac-1敲低对c-Myc启动子活性的影响。shCtrls:对照病毒感染组(对照组);shRNA1、shRNA2:干扰病毒感染组(实验组)。与对照组(shCtrls)比较,*P<0.05。
另一方面,Nac-1含有介导蛋白-蛋白相互作用的保守结构域,在ESCs中可以和Oct4、Nanog等核心转录因子结合,共同发挥作用;在肿瘤相关研究中发现,Nac-1能与组蛋白乙酰化酶HDAC3、HDAC4结合,影响组蛋白的乙酰化等,参与表观遗传学调控[3]。但尚不清楚Nac-1的这些功能在NSPCs中是否存在。本课题组用ChIP实验检测Nac-1与c-Myc启动子区域的结合能力,发现Nac-1与c-Myc启动子区域有结合但结合能力不强(结果未给出)。可能Nac-1对c-Myc的转录调控并非直接作用,而是借助蛋白-蛋白结合或组蛋白乙酰化等表观遗传学作用发挥功能,具体的分子机制有待进一步研究。
综上可见,NSPCs中Nac-1的表达丰度高,随分化而下降。Nac-1敲低的NSPCs增殖缓慢并趋向于分化。Nac-1可以调控c-Myc的转录水平。提示Nac-1是NSPCs维持自我更新所必需,Nac-1敲低引起的细胞功能变化可能是c-Myc的表达水平改变所引起。
