70份国外小麦品种(系)的苗期和成株期抗叶锈病鉴定
2019-09-10郑慧敏温晓蕾郝晨阳张培培GEBREWAHIDTakeleWeldu闫晓翠刘大群张学勇李在峰
郑慧敏 温晓蕾,2 郝晨阳 张培培 GEBREWAHID Takele Weldu 闫晓翠 刘大群 张学勇,* 李在峰,*
70份国外小麦品种(系)的苗期和成株期抗叶锈病鉴定
郑慧敏1温晓蕾1,2郝晨阳3张培培1GEBREWAHID Takele Weldu1闫晓翠1刘大群1张学勇3,*李在峰1,*
1河北农业大学植物保护学院/ 河北省农作物病虫害生物防治工程技术研究中心, 河北保定 071001;2河北科技师范学院, 河北秦皇岛 066000;3中国农业科学院作物科学研究所, 北京 100081
小麦叶锈病是小麦生产中的重要病害之一, 培育持久抗病品种是最经济、有效和环保的方法。本研究用19个不同毒力的叶锈菌小种苗期接种70份国外引进小麦品种(系)及36个已知抗叶锈病基因的载体品种进行抗性鉴定, 同时在2016—2017年度分别于河北保定和河南周口对70份国外引进品种进行田间抗叶锈性鉴定。为进一步检测材料中所携带的苗期和成株抗叶锈病基因, 利用12个与已知基因紧密连锁的分子标记进行检测, 综合基因推导、系谱分析和分子标记检测的结果, 在33份材料中鉴定出15个抗叶锈病基因, 包括、、、、、、、、、、、和, 田间鉴定筛选出39份品种表现慢锈性。苗期和田间表现表明, 国外品种中含有丰富的对我国叶锈菌小种有效的苗期和成株期抗叶锈病基因, 可作为小麦抗叶锈病抗源在抗病育种中加以利用。
国外引进小麦; 叶锈病; 基因鉴定; 慢锈性
由小麦叶锈菌()引起的小麦叶锈病是一种真菌性气传病害, 是危害小麦产量的重要因素之一, 病害严重流行年份可使小麦减产40%以上甚至绝收[1]。20世纪70年代, 小麦叶锈病在墨西哥西北部大流行, 致使小麦产量损失高达70%[2]。叶锈病在我国发生范围很广, 主要分布于河北、河南、山东、江苏、山西、贵州、四川、云南、黑龙江、吉林等省。2015年, 小麦叶锈病在小麦主产区之一的河南省全省爆发, 叶片在几天之内快速干枯死亡, 严重影响小麦正常灌浆, 对小麦生产造成了严重损失[3]。随着全球性气候变暖, 未来的温度和湿度条件可能会更加适合小麦叶锈病的发生和流行。因此, 选育和利用抗病品种是控制小麦叶锈病最经济、有效且对环境安全的重要措施。
小麦对叶锈病的抗性分为垂直抗性和水平抗性。垂直抗性是小种专化抗性, 表现为全生育期抗性, 由主效基因控制, 但抗性较脆弱, 常因叶锈菌小种的变异而导致抗性丧失; 水平抗性是非小种专化抗性, 又称慢锈性, 受多个微效基因控制, 具有加性效应和上位效应, 不易引起抗病性丧失, 因而较小种专化抗性更持久[4]。当前, 国际上对小麦叶锈病的研究较多, 1946年Ausemus等[5]首次用正式命名抗叶锈病基因。目前, 在小麦染色体上已发现了100多个抗叶锈病基因, 正式命名了79个[6], 但大多数为苗期抗病基因, 成株抗叶锈病基因仅有12个分别为、、(a和b)、、、、、、、和, 其中、、和为成株微效基因, 具有持久抗病性[7]。目前我国小麦生产上的流行小种为THTT、THTS[8]等, 因其毒性谱较宽导致多数主效基因已丧失抗性, 目前只有、、、、、、等少数基因仍保持有效的抗性[9-10], 因此鉴定国内外小麦材料所携带的抗病基因对利用基因布局和抗病育种防治小麦锈病具有重要的理论和实践意义。1973年, Browder[11]首次应用基因推导方法推导出了和; Gao等[9]、Li等[10]、刘志勇等[12]分别对我国部分生产主栽品种及抗叶锈育种圃高代品系进行了推导检测分析, 鉴定出、、、、、、、、、、、等多个抗病基因。伍玲等[13]用csLv34以及5对功能标记cssfr1~cssfr5对CIMMYT小麦材料成株抗性基因进行检测, 进一步验证了该功能标记的有效性。将基因推导、系谱分析和分子标记检测相结合, 可有效地提高鉴定小麦品种抗叶锈病基因的鉴定准确率。
本试验选取70份国外引进小麦品种进行苗期基因推导和成株慢锈性鉴定, 进一步利用12个与抗叶锈基因紧密连锁的分子标记进行标记辅助鉴定, 旨在明确这些小麦材料中的抗叶锈基因, 筛选出具有持久抗病材料, 为我国培育持久抗叶锈品种提供理论基础及有效抗源。
1 材料与方法
1.1 供试材料及叶锈菌系
来自北美洲的70份小麦品种, 其名称、系谱、类型及来源见附表1。36个已知抗叶锈病基因的载体品种、感病对照品种郑州5389、用于基因推导的19个单胞纯化后的小麦叶锈菌生理小种(FHRQ、FGHQ、FHHS、FHRS、PHHS、PHKS、PHTN、FHRS②、FHRQ②、THKT、TGTS、THDL、FHGQ、FGGQ、THGS、PHRT、FHGQ②、FHCQ、FHHQ)以及成株期所用的强毒力混合生理小种(THTT、PHTN、THKT、THDL、THGS)均由河北农业大学小麦锈病研究室提供。参照Long等[14]提出的三字母密码命名系统及后来扩展成的四字母命名法命名小种(https://www.ars.usda.gov/ ARSUserFiles/50620500/Cerealrusts/pt_nomen.pdf)。所有菌种均采集于中国小麦主产区且经单胞分离纯化, 保存于河北农业大学小麦锈病研究室。
1.2 苗期侵染型鉴定及基因推导
将36个携带已知抗叶锈病基因的载体品种、70份待测引进小麦和对照感病品种郑州5389共计107份材料(19套), 按顺序种于温室的育苗盘内。待小麦第一叶片完全展开即一叶一心时期, 采用扫抹法[15]分别接种19个不同毒力谱的叶锈菌生理小种, 然后置相对湿度100%的接种桶中覆盖塑料薄膜保湿, 在18℃的条件下黑暗保湿24 h后移置室温下(约25℃)培养15 d, 待感病对照品种5389充分发病时鉴定侵染型[16]。参照Roelfs等[17]的6级(0、;、1、2、3、4)标准调查记载侵染型, 0~2级为抗病, 3~4级为感病。并依据Dubin等[18]提出的抗病基因推导原则进行基因推导, 推导待测品种中所含抗叶锈病基因或基因组合。
1.3 田间试验和成株期抗叶锈病鉴定
2016—2017年度, 将70份国外小麦品种, 慢锈对照品种SAAR和感病对照品种郑州5389, 分别种植于河北保定河北农业大学小麦试验田(115.47°E, 38.85°N)和河南周口黄泛区农场试验田(114.53°E, 33.80°N), 采用完全随机区组设计、2次重复、行距0.25 m、行长1.5 m, 每10行种植一个高感对照品种郑州5389, 并且将郑州5389垂直种植作为接种行。参照Li等[10]的田间混合菌种(THTT、PHTN、THKT、THDL、THGS)接种和成株抗叶锈菌鉴定方法。
1.4 数据分析
利用软件SAS 9.1进行方差分析(Analysis of Variance, ANOVA)及计算品种(系)间的LSD (least significant difference)值。根据苗期与成株期的侵染型排除具有苗期抗性基因的品种(系), 将最大严重度(final disease severity, FDS)明显小于或与慢锈对照SAAR无显著差异的品种作为慢锈品种。
1.5 分子标记检测
利用CTAB法[19]提取小麦叶片基因组DNA, 并利用分光光度计对DNA浓度和纯度进行检测。同时用ddH2O稀释DNA至终浓度40 mg L–1用于PCR反应。采用与已知抗叶锈病基因紧密连锁的12个分子标记进行分子检测, 引物由生工生物工程(上海)股份有限公司合成(附表2)。所有引物的PCR体系为20 μL, 含10 μL 2×PCR Mix、6 µL ddH2O、2 μL 4mmol L–1引物、2 μL 40 mg L–1DNA模板。PCR反应程序为: 94℃预变性5 min; 94℃变性1 min, 56~66℃ (根据各个引物退火温度决定, 详见附表2)退火1 min, 72℃延伸2 min, 35个循环; 之后72℃延伸10 min, 4℃保存。根据扩增产物的分子量大小分别用1.5%琼脂糖或者12%非变性聚丙烯酰胺凝胶电泳检测分析(图1和图2)。
2 结果与分析
2.1 苗期抗病鉴定与分析
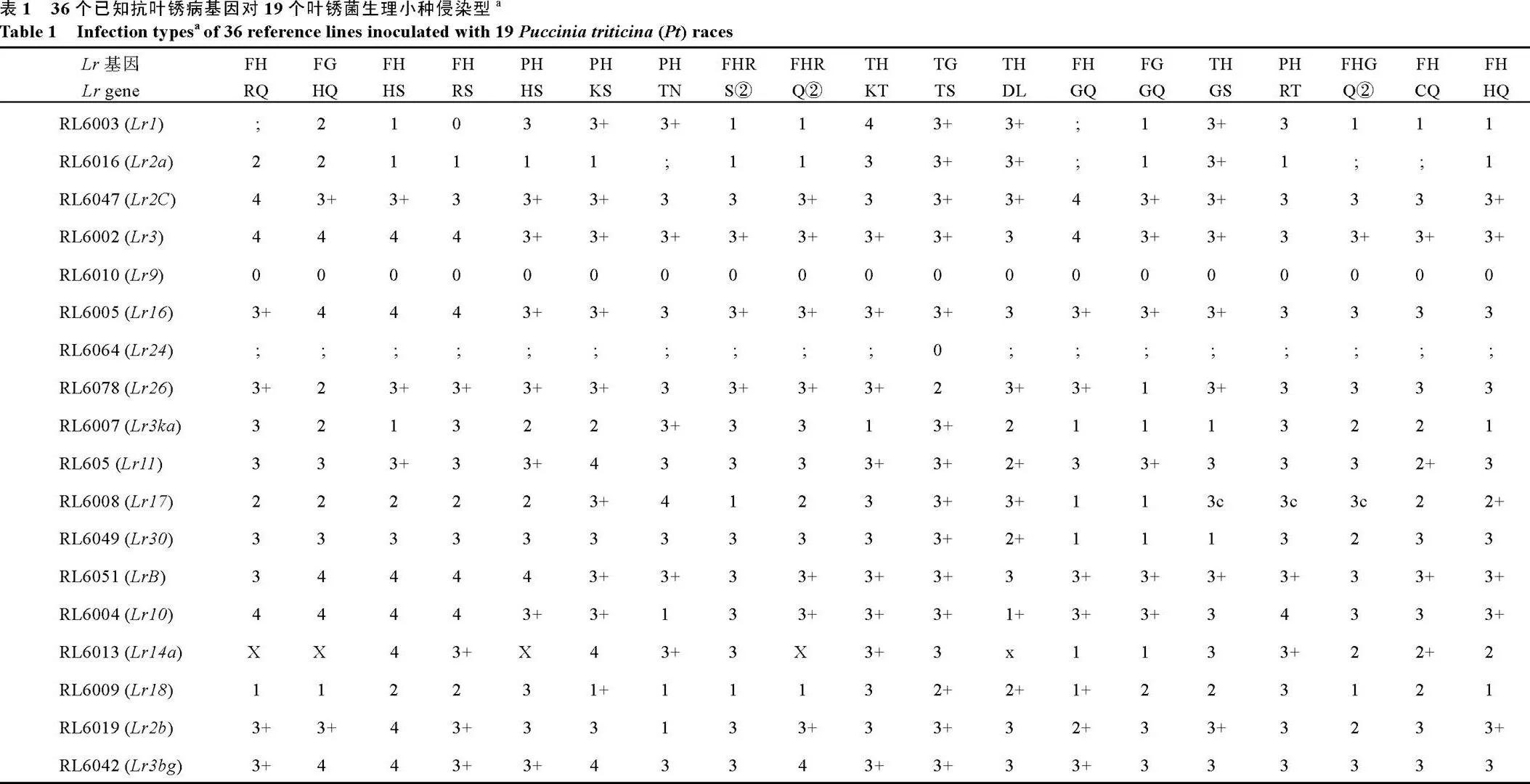
利用19个叶锈菌系对36个已知抗叶锈基因小麦载体品种、70份待测供试品种和感病对照品种郑州5389在苗期进行抗性鉴定(表1和表2)。其中, 感病对照品种郑州5389对19个生理小种均表现为高度感病, 在36个已知抗叶锈病载体品种中, 携带、、、、、、和的8个载体品种对所有供试叶锈菌种均表现抗病, 而携带、、、、、和的7个载体品种对19个供试叶锈菌生理小种均表现为感病, 因此上述15个抗叶锈病基因无法通过苗期抗性谱比较进行基因推导; 其余21个抗叶锈病基因对19个叶锈菌系均表现为不同的抗性谱, 可以通过苗期鉴定推导出来(表1)。

图1 Lr1、Lr9、Lr10、Lr19、Lr20、Lr24、Lr26、Lr34和Lr37部分PCR标记检测电泳图
M: DL 2000 marker; Z: Zhengzhou 5389; 1: Geneva; 2: Dodge; 3: Williams; 4: Lancer; 5: Madsen; 6: GR876; 7: Tiber; 8: Laura; 9: Marberg; 10: Karl; 11: Georgia 100; 12: Sharp; 13: Wakefield.
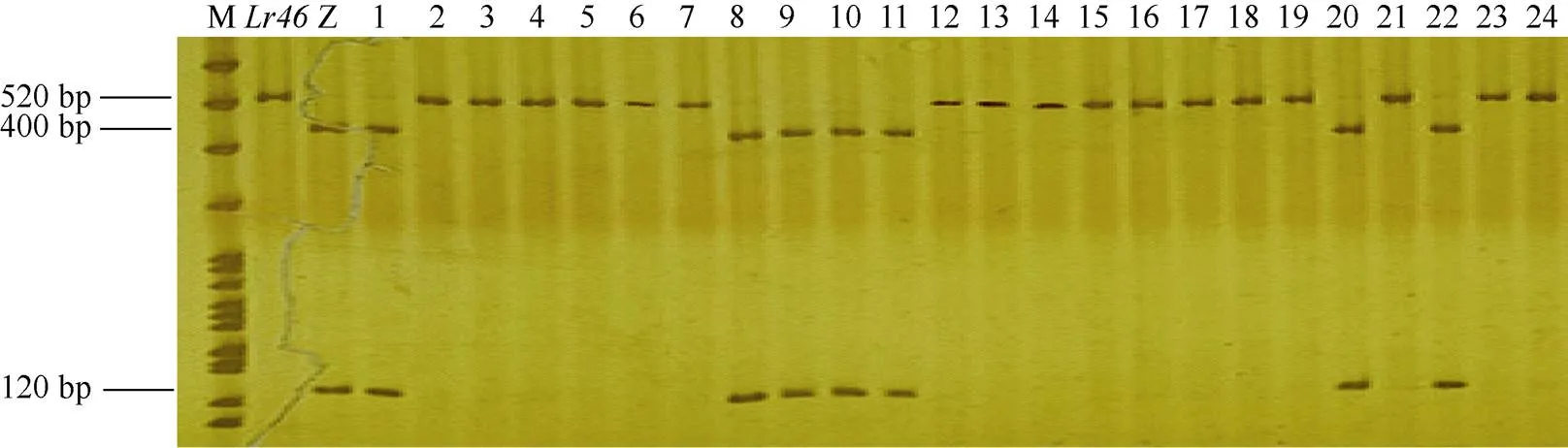
图2 Lr46分子标记检测结果
M: PBR 322 DNA/Imarker; Z: Zhengzhou 5389; 1: Glenman; 2: Siouxland; 3: Adder; 4: Copper; 5: Century; 6: Geneva; 7: Dodge; 8: Williams; 9: Lancer; 10: Madsen; 11: GR876; 12: Tiber; 13: Laura; 14: Marberg; 15: Karl; 16: Georgia 100; 17: Sharp; 18: Wakefield; 19: Hoff; 20: Gene; 21: Vista; 22: AC Taber; 23: Alliance; 24: McNeal.
对11个小种(FHRQ、FGHQ、FHHS、FHRS、FHRS②、FHRQ②、FHGQ、FGGQ、FHGQ②、FHCQ和FHHQ)表现为抗性, 对其余8个小种则表现为感病, 9个小麦品种Onas 53、Yukon、Glenman、Geneva、Dodge、Williams、Tiber、Sharp和Gene的抗性与相同或较表现为更广谱的抗性, 因此这些品种中可能含有基因。同时, 品种Yukon对无毒的2个小种(PHHS和THGS)也表现低侵染型, 因此该品种可能还同时携带。而品种Dodge又对和无毒的小种表现抗病, 因此, 品种Dodge可能同时携带基因、和。
对表现无毒的小种均同样表现为低侵染型, 因此携带的材料掩盖了基因的表达而不能推导出。同时,又对另外4个小种(PHHS、PHKS、PHTN和PHRT)表现抗病性, 本研究中3个小麦品种Georgia 100、AC Taber、Alliance对所有无毒小种表现为低侵染型, 因此这3个小麦品种中可能携带基因。品种Georgia 100同时对无毒小种(FHRQ、FGHQ、FHHS、FHRS、PHHS、PHKS、PHTN、FHRS②、FHRQ②、TGTS和THDL)表现抗性, 因此该品种可能同时携带和。
仅对3个小种(FGHQ、TGTS和FGGQ)表现为低侵染型, 8个小麦品种GR 876、McNeal、Cayuga、Jubilee、Goodstreak、Arrowsmith、Mace和Camelot对所有无毒小种均表现抗性, 表明这些材料中可能携带。
仅对小种PHTN和THDL表现抗病, 品种Onas 53、Neepawa、Inia 66 R、Madsen、Laura、Karl、Vista和AC Taber对所有无毒小种都表现低侵染型, 说明这8份材料可能含有。同时, 品种Madsen对和无毒小种均表现抗性, 因此, 该品种可能同时携带、和。品种Inia 66 R对和无毒小种也表现抗性, 该品种可能同时携带基因、和。
仅对2个小种(THDL和FHCQ)表现抗病性,品种Redman、Colt、Siouxland、Century、Williams、Madsen、Marberg对这2个小种表现相似的低侵染型, 表明这些材料可能含有。同时, 品种Marberg对无毒的2个小种(FHRS和FHGQ)表现抗性, 该品种可能同时携带基因和。
仅对3个小种(PHTN、FHGQ和FHGQ②)表现为低侵染型, 品种Neepawa、Inia 66R、Shasta和GR 876对所有无毒小种都表现为低侵染型, 这4个小麦品种中可能携带基因;对11个小种(FHRQ、FGHQ、FHHS、FHRS、PHHS、FHRS②、FHRQ②、FHGQ、FGGQ、FHCQ和FHHQ)表现为低侵染型, 品种Century、Lancer、Vista和Jubilee对所有无毒的小种都表现为低侵染型, 这4个小麦品种中可能携带;对12个小种(FHRQ、FGHQ、FHHS、FHRS、FHRS②、FHRQ②、FHGQ、FGGQ、THGS、PHRT、FHGQ②和FHHQ)表现为抗病性, 品种Century、Lancer、Karl对这12个小种也表现相似的低侵染型, 说明这些材料可能含有;对10个小种(FHRQ、FGHQ、PHHS、FHRQ②、THDL、FHGQ、FGGQ、FHGQ②、FHCQ和FHHQ)表现为抗病性, 品种Colt、Siouxland、Dodge对这10个小种也表现相似的低侵染型, 说明这些材料可能含有;对12个小种(FGHQ、FHHS、PHHS、PHKS、THKT、THDL、FHGQ、FGGQ、THGS、FHGQ②、FHCQ和FHHQ)都表现抗病性, 品种Neepawa、Dodge、Laura对所有无毒小种均表现抗性, 表明这些材料中可能携带(表1和表2)。
70份品种的苗期鉴定结果表明, 供试品种对我国叶锈菌小种表现出不同的抗感性, 4份材料(Laura、Marberg、Karl和Georgia 100)苗期表现较好抗性, 仅对19个小种中的个别菌株表现感病, 对其它小种则表现为抗病, 表明这些材料中可能携带未知抗病基因(表2)。
2.2 田间成株抗病性鉴定
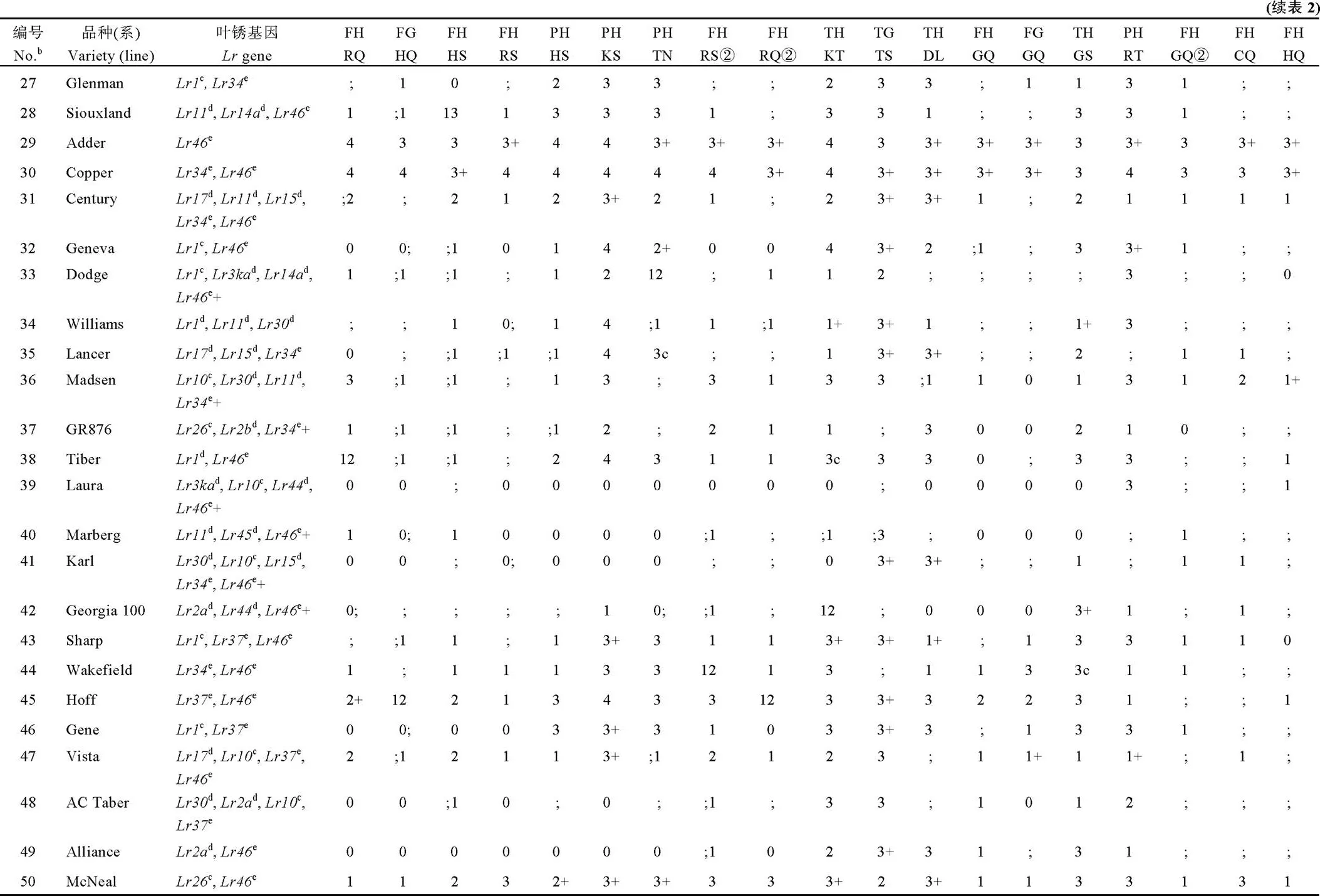
2016—2017年分别于河北保定和河南周口两地对这些材料进行成株期抗叶锈病鉴定。感病对照郑州5389在2个环境下都发病充分, 这保证了鉴定结果的可靠性。方差分析结果显示, 品种间、环境间以及品种与环境间都存在极显著差异; 这表明小麦叶锈病抗性基因的表达受基因型和环境共同影响(表3)。慢锈对照品种SAAR在田间的FDS值分别为7.5和8.0, 表现为明显的慢锈性。方差分析发现在70份国外引进材料中共有39个品种的FDS与慢锈对照品种SAAR的FDS差异不显著, 表现高水平抗性。在这39份品种中Neepawa、Dodge、Williams、Laura和Vista这5个品种表现全生育期抗性可能携带有效的主效抗病基因, Early Red Fife、Dirkwin、Stacy、Mit、Wheeler、Saluda、Copper、Tiber、Hoff、Gene、McNeal、Lambert、Pomerelle、Cayuga、Boundary、Caledonia、Millennium、Jubilee、Avalanche、Alson、Steel-ND和Grandin等22个品种在苗期对我国所有流行叶锈菌小种均表现感病, 另外12个品种(Satanta、TAM 105、Redman、Glenman、Century、Lancer、Madsen、GR 876、Karl、Sharp、Wakefield和AC Taber)仅对个别叶锈菌小种表现抗性, 对多数流行的叶锈菌小种表现感病性, 其在田间成株期对混合叶锈菌小种侵染型表现感病, 而田间最终严重度FDS值较低, 因此这些材料可能为慢锈品种(表4)。
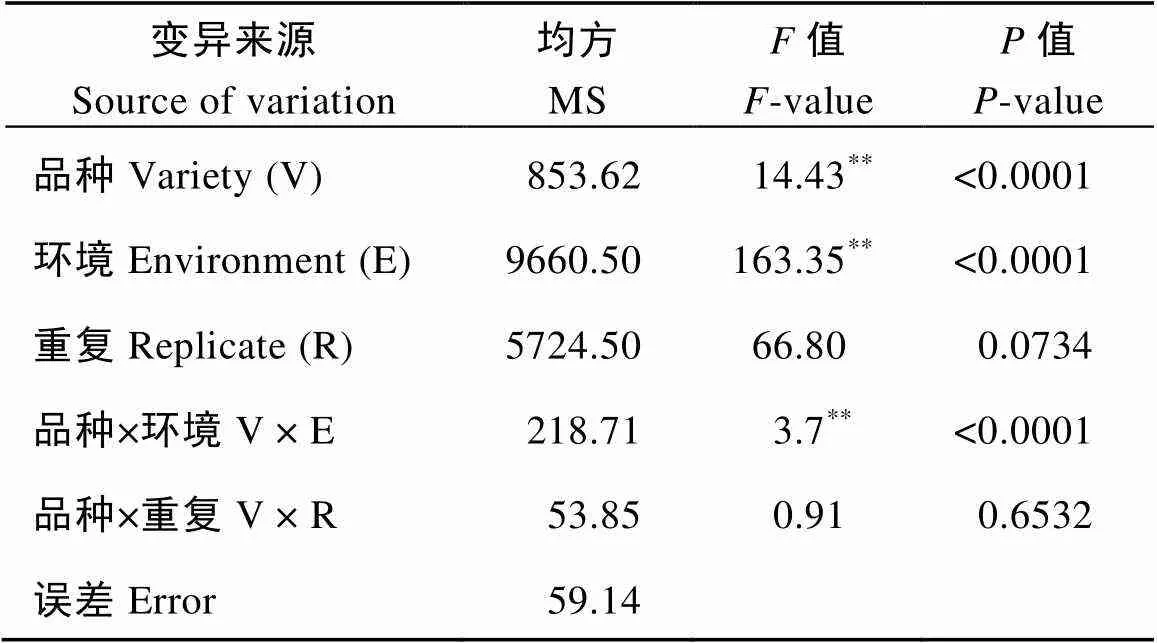
表3 70个小麦品种及慢锈SAAR和感病对照在2016−2017年分别在保定与周口最终病害严重度的方差分析
**表示差异达到0.01显著水平。
**Significance at the 0.01 probability level.

表4 慢锈品种SAAR、感病对照品种5389及具有慢锈性品种苗期对混合小种的反应型及成株期在2016−2017年的最终病害严重度

(续表4)
2.3 分子检测
70份待测品种进一步利用12个分子标记进行检测, 共检测到、、、、和的特异目的片段, 而未检测到、、和相应的特异条带。其中Onas 53、Yukon、Glenman、Sharp和Gene这5个品种中检测出, 而在其他品种中则未检测到与相同的条带; 在8个品种中检测出, 分别为Onas 53、Neepawa、Inia 66R、Madsen、Laura、Karl、Vista和AC Taber; 另外, 在GR 876、McNeal、Cayuga、Jubilee、Goodstreak、Arrowsmith、Mace和Camelot等品种中检测出与相同的带型。上述3个基因、和标记检测结果与基因推导结果完全一致, 可互相验证。、和是成株抗病基因, 用分子标记检测共筛选出64份材料携带成株抗病基因, 只携带成株基因的有7份, 只携带成株基因的有3份, 只携带成株基因的品种有41份, 同时携带成株基因和的有9份, 同时携带和的有4份(表2)。
3 讨论
本研究结合表型基因推导、系谱分析和分子标记检测多种方法, 对70份国外小麦进行苗期抗叶锈病分析, 18个已知叶锈基因、、、、、、、、、、、、、、、、和在70份待测材料中以单个基因或基因组合的方式存在。、、和无毒小种均对表现抗性, 因此, 当存在时,、、和不能被推导出来。同理和的无毒小种均对表现抗病, 当存在时,和也不能被推导出。
苗期鉴定推测小麦品种Neepapwa可能含有3个基因、、, 标记检测中检测出与相同的条带, 但该品种对16个菌系都表现抗性,且田间发病表现为较低的严重度甚至近免疫, 故该品种中可能还含有未知抗病基因; 4个小麦品种Laura、Marberg、Karl、Georgia 100苗期推测其可能含有、、、、、、、等多个抗病基因, 这4个品种对其中18个菌系表现较高抗性, 且田间成株期也表现抗病, 标记检测显示Marberg和Karl含有基因, 但抗病基因已丧失抗性[20], 这4个品种中可能携带多个抗病基因共同抵抗小麦叶锈菌, 也可能含有未知抗叶锈病基因。
基因推导法是鉴定小麦品种抗叶锈病基因最经典的方法, 它不通过杂交只根据侵染型来推导基因型, 且快速简便, 能够在短时间内对大量品种进行鉴定, 但它易受小种鉴别力不足、遗传背景或人为误差等因素的影响。分子标记检测方法快速、准确并且不受环境条件的限制, 但容易出现假阳性, 即扩增出非特异性条带, 影响结果的准确性。本试验联合两种方法加以鉴定, 它们能够相互验证, 说明了结果的可靠性。
系谱为HART/VA-66-54-10//KAVKAZ/PD-6693的小麦品种GR 876同时携带苗期基因和成株基因, 其亲本KAVKAZ中携带抗病基因和[21], 说明GR 876中的2个已知基因和可能都来自亲本KAVKAZ; 小麦品种Vista中检测出含有, 其系谱为NE-68513/NE-68457// CENTURK/3/BRULE, 两亲本CENTURK和BRULE中都检测出含有[21], 说明该品种中所含的基因可能来自这2个亲本的其中之一, 同时也说明本实验结果的准确性。和在田间已丧失抗性, 苗期仅对19个菌系中的3个或2个小种表现抗性, 对其他绝大多数小种则表现高度感病性, 表明这些基因在生产上已失去应用价值。
、、和是非常重要的持久抗病基因, 当其单独应用时仍有一定程度的发病, 但与、或这些几乎丧失抗性的基因共同存在时, 可明显提高其自身的抗性, 抗病性一般都大于其单独存在时的效果[22]。本试验中39份引进品种在田间成株期表现较高水平的成株抗性, 表明这些引进材料含有丰富的抗病基因, 且部分材料表现慢锈性, 可能具有持久抗性。相对来说国内品种含有的抗病基因相对单一, 田间多表现感病[9-10], 因此这些国外引进品种可作为抗源在抗病育种中加以利用。
本研究中还鉴定到一些材料苗期和成株期都表现高抗, 推测可能携带未知抗叶锈病基因, 需进一步利用遗传学方法鉴定和定位。
4 结论
利用苗期基因推导结合系谱分析和分子标记检测, 在70份国外小麦品种中共检测出6个已知抗叶锈病基因, 即、、、、和。含有的有5个品种, 含有的品种有7个, 含有的有8个品种, 携带成株抗病基因的有16个品种, 携带成株抗病基因的品种有9个, 此外有53个品种携带。39份品种(占供试品种的55.71%)表现慢锈性, 这些材料可用于我国小麦持久抗病品种的培育。
附表 请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuowxb. aspx。
附表1 70份引进小麦品种(系)系谱、来源

Supplementary table 1 The pedigree and origins of 70 introduced wheat variety (line)
--表示系谱未知。*表示品系。-- indicate pedigree unknow; * indicate lines.
附表2 分子标记的引物序列及PCR扩增程序
Supplementary table 2 Primer sequences and PCR amplification for different primer combinations

Lr基因Lr gene引物Primer引物序列Sequence of primer (5´→3´)退火温度Annealing temp. (°C)片段大小Size (bp) Lr1WR003FGGGACAGAGACCTTGGTGGA65760 WR003RGAC GATGATGATTTGCTGCTGG Lr9J13/1TCCTTTTATTCCGCACGCCGG661100 J13/2CCACACTACCCCAAAGAGAG Lr10Lrk10D1GAAGCCCTTCGTCTCATCTG58282 Lrk10D2TTGATTCATTGCAGATGAGATCACG Lr19SCS265 FGGCGGATAAGCAGAGCAGAG65512 SCS265 RGGCGGATAAGTGGGTTATGG Lr19SCS253 FGCTGGTTCCACAAAGCAAA60736 SCS253 RGGCTGGTTCCTTAGATAGGTG Lr20STS638-LACAGCGATGAAGCAATGAAA60542 STS638-RGTCCAGTTGGTTGATGGAAT Lr24Lr24 J 9/1TCTAGTCTGTACATGGGGGC57310 Lr24 J 9/2TGGCACATGAACTCCATACG Lr26Glu-B3FGGTACCAACAACAACAACCC65636 Glu-B3RGTTGCTGCTGAGGTTGGTTC Lr26ω-secalin FACC TTCCTCATCTTTGTCCT651076 ω-secalin RCCGATGCCTATACCACTACT Lr34csLV34 FGTTGGTTAAGACTGGTGATGG58150 csLV34 RTGCTTGCTATTGCTGAATAGT Lr37VENTRIUPAGGGGCTACTGACCAAGGCT65259 LN2TGCAGCTACAGCAGTATGTACACAAAA Lr46csLV46G22FAGG GAAAAGACATCTTTTTTTTC58335 csLV46G22RCGACCGACTTCGGGTTC
[1] Khan M H, Bukhari A, Dar Z A, Rizvi S M. Status and strategies in breeding for rust resistance in wheat., 2013, 4: 292–301.
[2] Dubin H J, Torres E. Causes and consequences of the 1976–1977 wheat leaf rust epidemic in northwest Mexico., 1981, 19: 41–49.
[3] 彭红, 吕国强. 王江蓉. 河南省2015年小麦主要病害发生特点及原因分析. 中国植保导刊, 2016, 36(4): 29–33. Peng H, Lyu G Q, Wang J R. Analysis on the characteristics and causes of main diseases of wheat in Henan province in 2015., 2016, 36(4): 29–33 (in Chinese)
[4] 闫晓翠, 李在峰, 杨华丽, 张换换, Gebrewahid Takele Weldu, 姚占军, 刘大群, 周悦. 30个重要小麦生产品种抗叶锈性基因分析. 中国农业科学, 2017, 50: 272–285. Yan X C, Li Z F, Yang H L, Zhang H H, Takele W G, Yao Z J, Liu D Q, Zhou Y. Analysis of leaf rust resistance genes in 30 important wheat cultivars., 2017, 50: 272–285 (in Chinese with English abstract).
[5] Ausemus E R, Harrington J, Reitz L P, Worzella W W. A summary of genetic studies in hexaploid and tetraploid wheats., 1946, 38: 1082–1099.
[6] Qureshi N, Bariana H, Kumran V V, Muruga S, Forrest K L, Hayden M J, Bansal U. A new leaf rust resistance genemapped in chromosome 3BL from the durum wheat landrace Aus26582., 2018, 131: 1091–1098.
[7] Li Z F, Lan C X, He Z H, Singh R P, Rosewarne G M, Chen X M, Xia X C. Overview and application of QTL for adult plant resistance to leaf rust and powdery mildew in wheat., 2014, 54: 1907–1925.
[8] 肖宇. 2012年我国小麦叶锈菌生理小种鉴定及毒性分析. 河北农业大学硕士学位论文, 河北保定, 2014. Xiao Y. Race and Virulence Frequency ofin China in 2012. MS Thesis of Hebei Agriculture University, Baoding, Hebei, China, 2014 (in Chinese with English abstract).
[9] Gao P, Zhou Y, Zhang P P, Yan X C. Identification of known leaf rust resistance genes in common wheat cultivars from Sichuan province in China., 2019, 115: 122–129.
[10] Li Z F, Xia X C, He Z H, Li X, Zhang L J, Wang H Y, Meng Q F, Yang W X, Li G Q, Liu D Q. Seedling and slow rusting resistance to leaf rust in Chinese wheat cultivars., 2010, 94: 45–53.
[11] Browder L E. Probable genotype of some‘Agent’ derivatives for reaction tof. sp.., 1973, 13: 203–206.
[12] 刘志勇, 王晓玲, 倪中福, 杨爱冬, 孙其信, 杨作民. 小麦抗叶锈基因、的分子标记辅助选择研究. 农业生物技术学报, 2000, 8(1): 14–16.Liu Z Y, Wang X L, Ni Z F, Yang A D, Sun Q X, Yang Z M. Molecular marker assisted selection (MAS) of leaf rust (f. sp.) resistance genesandin wheat., 2000, 8(1): 14–16 (in Chinese with English abstract).
[13] 伍玲, 夏先春, 朱华忠, 李式昭, 郑有良, 何中虎. CIMMYT 273个小麦品种抗病基因//的分子标记检测. 中国农业科学, 2010, 43: 4553–4561. Wu L, Xia X C, Zhu H Z, Li S Z, Zheng Y L, He Z H. Molecular characterization ofin 273 CIMMYT wheat cultivars and lines using functional markers., 2010, 43: 4553–4561 (in Chinese with English abstract).
[14] Long D L, Kolmer J A. A North American system of nomenclature for., 1989, 79: 525–529.
[15] 王佳真, 李在峰, 李星, 刘大群. 小麦品系5R618抗叶锈病基因的初步定位. 植物遗传资源学报, 2014, 15: 1348–1351. Wang J Z, Li Z F, Li X, Liu D Q. Genetic analysis of leaf rust resistance gene in wheat line 5R618., 2014, 15: 1348–1351 (in Chinese with English abstract).
[16] Roelfs A P, Singh R P, Saari E E. Resistance to leaf and stem rusts of wheat: concepts and methods of disease management Edo. DE Mexico: CIMMYT, Mexico D F, 1992. pp 42–45.
[17] Roelfs A P, Singh R P, Saari E E. Resistance to leaf and stem rusts of wheat. breeding strategies for resistance to the rusts of wheat. CIMMYT, Mexico D F, 1988. pp 10–22
[18] Dubin H J, Johnoson R, Stubbs R W. Postulated genes for resistance to strip rust in selected CIMMYT and related wheats., 1989, 73: 472–475.
[19] Sharp P J, Kreis M, Shewry P R, Gale M D. Location of β-amylase sequence in wheat and its relatives.1998, 75: 286–290.
[20] 张小村, 李斯深, 赵新华, 范玉顶, 李瑞军. 小麦纹枯病抗性的QTL分析和抗病基因的分子标记. 植物遗传资源学报, 2005, 6: 276–279. Zhang X C, Li S S, Zhao X H, Fan Y D, Li R J. QTL and molecular markers for resistance gene of wheat sharp eyespot., 2005, 6: 276–279 (in Chinese with English abstract)
[21] McIntosh R A, Wellings C R, Park R F. Wheat rusts: an atlas of resistance genes. Dordrecht, the Netherlands: CSIRO Australia, Sydney, Kluwer Academic Publishers, 1995. pp 182–200.
[22] Kolmer J A. Enhanced leaf rust resistance in wheat conditioned by resistance gene pairs with.1992, 61:123–130.
Seedling and slow rusting resistance to leaf rust in 70 introduced wheat lines
ZHENG Hui-Min1, WEN Xiao-Lei1,2, HAO Chen-Yang3, ZHANG Pei-Pei1, GEBREWAHID Takele Weldu1, YAN Xiao-Cui1, LIU Da-Qun1, ZHANG Xue-Yong3,*,and LI Zai-Feng1,*
1College of Plant Protection, Hebei Agricultural University / Biological Control Center of Plant Disease and Plant Pests of Hebei Province, Baoding 071000, Hebei, China;2Hebei Normal University of Science & Technology, Qinhuangdao 066000, Hebei, China;3Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Leaf rust is one of the most important wheat diseases which has a great influence on yield. Breeding cultivars for durable resistance can effectively and economically control the disease. In this study, seventy introduced wheat varieties, including susceptible control Zhengzhou 5389 and thirty-six donor lines, were inoculated with 19 Chinese pathotypes offor leaf rust resistance genes postulation at seedling stage, and to detect APR genes at adult plant stage during the 2016−2017 cropping seasons in Zhoukou of Henan province and Baoding of Hebei province. Zhengzhou 5389 and Saar lines as a susceptible and resistance control, respectively, and thirty-six tester lines with knowngenes were also used in the present study. Based on the results of gene postulation, marker-assisted detection and pedigree analysis, fifteengenes, including,,,,,,,,,,,,,,and, were identified among the tested cultivars. Wheat cultivars with the identified resistance genes in the present study can be used for breeding resistant cultivars of wheat leaf rust in China.
introduced wheat of abroad; leaf rust; identification of genes; slow-rusting resistance
本研究由国家自然科学基金项目(31571662, 31601299)和引进国际先进农业科学技术项目(2016-X16)资助。
This study was supported by the National Natural Science Foundation of China (31571662, 31601299) and the Program of Introducing International Super Agricultural Science and Technology (948 Program) (2016-X16).
李在峰, E-mail: lzf7551@aliyun.com; 张学勇, E-mail: zhangxueyong@caas.cn
E-mail: 2458737090@qq.com
2019-01-07;
2019-05-12;
2019-06-19.
10.3724/SP.J.1006.2019.91003
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20190612.1040.006.html
