山西省玉米大斑病菌生理小种鉴定
2020-03-04吉佩畅引东王琦李新凤张作刚徐玉梅姚宏亮郑戈文曹改萍王建明
吉佩,畅引东,王琦,李新凤,张作刚,徐玉梅,姚宏亮,郑戈文,曹改萍,王建明*
(1.山西农业大学 农学院,山西 太谷 030801;2.山西省农业种子总站,山西 太原 030006)
玉米大斑病(NorthernLeafBlightofCornNCLB)自1876年首次在意大利发现以来,逐渐在世界各地流行至今[1~3]。我国最早于1899年在东北发现此病害[3]。自上世纪70年代至今,该病害一直在我国玉米种植区发生危害,严重爆发年份可减产50%以上[4]。目前防治该病最有效的方法是种植抗性品种[2]。玉米大斑病菌随种植地区、品种、时间和气候的变化而产生的生理分化现象,是导致其产生新生理小种和玉米品种抗性丧失的主要原因[5]。因此,研究不同地区玉米大斑病菌的生理分化,对品种的合理布局和抗病育种以及有效防治该病害的危害都具有重要的科学意义。
1923年印度学者Mitra首次报道玉米大斑病菌存在生理分化现象[6]。1974年,Lim等人提出玉米大斑病菌生理小种划分的毒力公式[7]。据此,世界各地相继报道了1(新0号)、2(新1号)、3(新23号)、4(新23N)、5号(新2N)等多个生理小种。20世纪90年代以来,随着对玉米大斑病菌生理小种鉴定的深入研究,世界各地不断发现新的小种。美国报道了0、1、2、23、2N和23N[8~10];墨西哥报道了23、2和23N,赞比亚报道了0、23和23N,乌干达报道了0、1、2、3、N和23N[11];巴西报道了0、1N、12N和123N[12];肯尼亚,德国和奥地利报道了的0、1、2、3、N、12、13、23、3N、123、13N和23N[13]。2018年,Weems和Bradley 利用Ht1、Ht2、Ht3、Htn、Htm5个单抗性基因从美国中北部鉴定了0、1、2、M、N、12、13、23、1M、1N、MN、123、1MN、2MN、23M、23N、12MN、23MN、123M和123MN号,共20个生理小种[14]。综上所述,各国玉米大斑病菌的生理小种种类差异明显,且分化日趋复杂。
我国对大斑病菌生理小种的研究始于上世纪70年代。1980年潘顺法等首次报道我国大斑病菌为1号小种(新0号)[15]。上世纪80~90年代,我国不断出现新小种,在我国先后发现2(新1号)[16]、3(新23号)[17]、4号(新23 N)[18]等小种,其中1号小种(新0号)一直是我国的优势小种。进入本世纪后,利用含不同单抗性基因(Ht1、Ht2、Ht2、HtN)的玉米自交系作为鉴别寄主,研究人员陆续报道了许多新的生理小种。目前,我国已报道的大斑病菌生理小种有0、1、2、3、N、12、13、1N、23、2N、3N、12N、13N、123、23N和123N共16个类型[19]。上个世纪90年代,李勇[20]、陈刚[21]和高卫东[22]等人对采自于山西的标样进行鉴定,结果表明只存在1(新0号)、2号(新1号)小种。20世纪以来,孙淑琴等将从山西长治采集的标样鉴定为12号小种[4];赵辉等报道山西小种为0、12号[23]。2009年,隗爽[24]首次对山西省部分地区的玉米大斑病进行研究,鉴定出0、1、2、12、13、23、12N和123N号,共8个生理小种;2013年张治家等[25]从山西运城、忻州、晋东南3个主要玉米产区采集玉米大斑病标样,共鉴定出N、0和123N号3个生理小种。以上数据表明,山西已报道的生理小种共有9个[24,25]。
综上所述,国内外不同地区、不同年份的小种种类及分布存在显著差异,且分化严重。玉米是山西的第一大粮食作物,山西省南北气候差异大,种植品种繁、多、杂。大斑病流行面积广、危害损失大,品种抗性丧失明显[26],小种的分化亦比较复杂,但对山西省大斑病菌生理小种的系统研究比较少,且较为滞后。有关山西小种的种群结构、分布和毒力频率等尚无系统的研究报道。因此,本试验将采用玉米Ht单抗性基因鉴别寄主法,对采自山西省14个市县的玉米大斑病菌进行生理分化研究,以期明确小种的种群结构、分布和毒力频率等,为抗病育种、品种布局和有效防治该病害提供理论基础和科学依据。
1 材料与方法
1.1 供试菌株
本试验所用32供试菌株菌,为2017年从采自山西省14个市县的罹病玉米叶片上分离并鉴定的的玉米大斑病菌,由山西农业大学农学院植物病理实验室提供(表1)。
1.2 供试鉴别寄主
鉴别寄主选用一套具有Ht1、Ht2、Ht3和HtN单基因以及不含任何上述主效抗病基因的玉米自交系,分别为A619Ht1、A619Ht2、A619Ht3、A619HtN和A619(对照)(鉴别寄主由山西农业科学院玉米研究所王富荣研究员馈赠)。
1.3 鉴别寄主的种植
选取籽粒饱满的玉米籽粒,经浸种、催芽处理后,选取露白整齐的种子播种于直径15 cm的花盆中,待长到4~6叶期时接种备用,每个品种3个生物学重复。
1.4 孢子悬浮液的制备及接种
将活化的菌株转接至PDA平板中,待其大量产孢后,用带有10%吐温80的无菌水洗脱孢子,并用3层纱布过滤,将滤液配置成浓度为104~105个·mL-1的孢子悬浮液。采用涂抹法对培育好的鉴别寄主进行接种,在保湿棚内保湿24 h后进行正常管理。待出现典型病斑后进行调查。
1.5 鉴定标准
供试材料的生理小种鉴定以其在鉴别寄主上的2种病斑反应类型为标准。R型病斑最初为水浸状或褐色窄条形,中期为中间褐色、边缘黄色晕圈梭型病斑,其出现早,枯死慢,不产生或产生很少孢子,称为褪绿斑;S型病斑最初为水浸状斑,中期为中间灰褐色、边缘无明显晕圈的梭型病斑,出现晚,枯死快,病斑周围有明显的萎蔫和中毒区,条件适宜时产生大量褐色霉层,称为萎蔫斑[27]。
1.6 生理小种的命名
小种的命名采用Leonard的命名方法,以无效抗性基因的序号作为该小种的名称[28]。同时参照刘国胜等[29]提出的毒力频率公式(某抗病基因的毒力频率/%=有毒力菌株数/测定总菌株数 × 100)对分离菌株进行毒力频率的分析。
2 结果与分析
2.1 山西玉米大斑菌生理小种鉴定结果及出现频率
从表1和图1中可知,供试的32株大斑病菌被鉴定为0、1、2、3、N、12、2N、3N、12N、13N、23N和123N,共12个生理小种,其中123N号小种出现频率最高,为25.00%;12N号出现频率为12.50%;12、3N、23N号,各占9.38%;N、2N、13N号,各占6.25%;0、1、2、3号均为1株,出现频率均为3.13%。试验结果表明,山西玉米大斑病菌生理分化十分明显,且呈多样性和复杂化。12、3N、12N、23N和123N号5个小种出现频率占总数的65.64%,是构成山西玉米大斑病菌的主要致病小种群体。其中,原来的优势小种0号和1号各占3.13%,123N号成为山西省的新优势小种,占25.00%。

表1 山西玉米大斑病菌生理小种鉴定结果Table 1 Identification result of physiological races of E. turcicum in Shanxi

图1 山西玉米大斑病菌生理小种频率图Fig.1 Isolation frequency of physiological races of E. turcicum in Shanxi
2.2 山西玉米大斑病菌生理小种毒力频率分析
由表2可见,在供试菌株的32个菌株中,对Ht1、Ht2、Ht3和HtN四个单抗性基因无毒性的0号小种仅出现1株(表1),出现频率仅为3.13%,而剩余的31株对Ht单抗性基因的毒力频率在56.25%~78.13% 之间。其中,对含HtN抗性基因的毒力频率最高,为78.13%;对Ht2的毒力频率次之,为68.75%;对Ht1和Ht3的毒力频率最低, 均为56.25%。但供试菌株对含Ht双基因组合、Ht三基因组合和Ht四基因组合的毒力频率分别为81.25%、56.25%和25.00%。由此可知,4个Ht单抗性基因的抗病效能已显著降低,含Ht3基因的有效抗性相对最低,而含Ht1或Ht3基因的玉米品种对大斑病菌抗病性相对最高。同时,随着含Ht抗性基因组合数的增加,病菌的毒力频率逐渐降低,品种抗病性则逐渐增强。
2.3 山西不同地区生理小种的组成
由表3可见,忻州生理小种的种类最多,共分离鉴定出1、2、2N、12N、13N、123N号6个小种,总出现频率为25.00%;其次是大同,分别为N、2N、3N、12N号4个生理小种,总出现频率为12.50%;最少的为长治、太原和朔州仅鉴定出1个小种,这3个地区的总出现频率分别为3.13%、3.13% 和9.38%。从山西地理位置来看,山西南部地区(包括运城、临汾、晋城和长治)有7个小种,分别是3、N、12、12N、13N、23N和123N号小种,总出现频率为31.26%;中部地区(包括晋中、吕梁和太原)有5个小种,分别是0、12、12N、3N和23N号小种,总出现频率为21.89%;北部地区(包括忻州、朔州和大同)有8个小种,分别是1、2、N、2N、3N、 12N、13N和123N号小种,总出现频率为46.88%。由此可知,山西各地区生理小种种类存在明显差异,北部小种最为丰富,南部次之,中部最少。
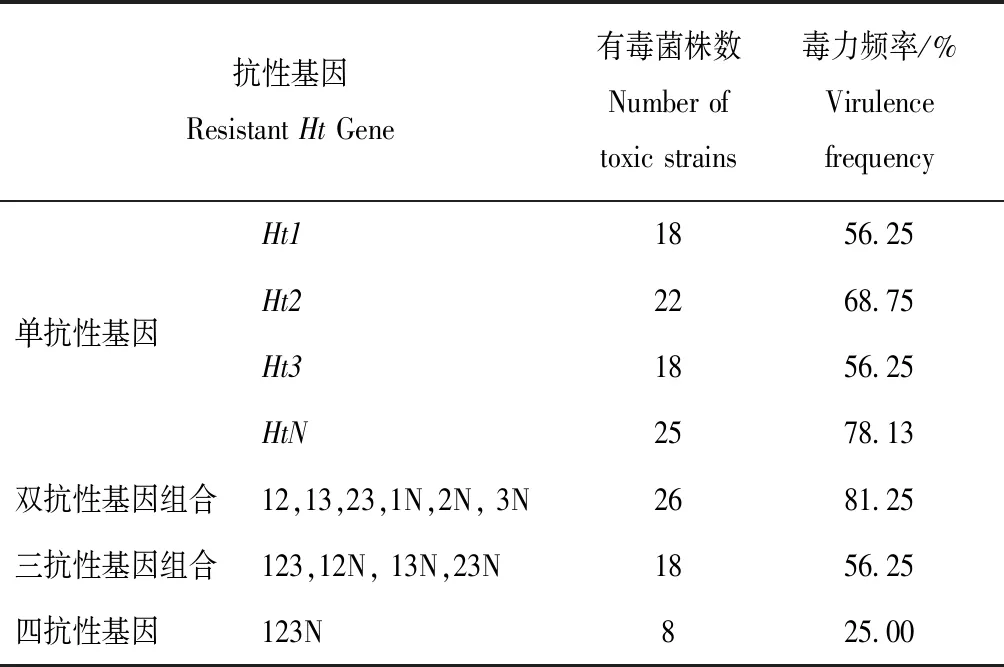
表2 山西玉米大斑病菌对Ht抗性基因的毒力频率
3 讨论与结论
近年来,我国各省在玉米大斑病菌的小种鉴定方面做了大量工作,其中,云南省[30]、东三省[31]、河北省[32]和甘肃省[33]等地先后鉴定出11个、14个、15个和10个生理小种。山西小种组成的复杂性和云南、东三省、河北、甘肃比较相似。本试验共鉴定出12个小种,加之以前报道过,但本研究未发现的13和23号小种,山西已有14个生理小种,存在较大的生理分化。这可能是由于山西玉米种植生态类型多、种植品种多、气候条件复杂所造成的。本试验中仅对32株大斑病菌的生理小种进行研究,且采用的是国内通用的4种鉴别寄主进行鉴定,而国外现已采用Ht1、Ht2、Ht3、Htn和Htm共5个单基因鉴别寄主进行小种鉴定[14],所以有关山西省玉米大斑病菌生理小种种类及其分布的结果存在一定的局限性。因此,今后应在扩大采集范围、菌种样本和鉴别寄主种类的基础上继续进行小种鉴定,这对更深入、系统的了解山西省玉米大斑病菌生理分化情况具有重要意义。

表3 山西省不同地区玉米大斑病菌生理小种组成及出现频率Table 3 Physiological races composition and isolation frequency in different areas of Shanxi Province
自上世纪60年代以来,我国玉米大斑病的优势小种主要为0号和1号[21~23]。大量的研究结果表明,自上个世纪90年代以来,我国大斑病菌的小种种群结构发生了比较大的变化,针对Ht1、Ht2、Ht3和HtN这4个抗性基因,均分化出了具有相应毒性基因的生理小种。从本世纪初开始,已在我国多个地区发现了对带Ht抗性基因的玉米均能致病的123N号生理小种[4,5],但出现频率都比较低。到2011年,致病力强的123N号已经成为云南、贵州等地玉米种植区的优势小种[30,34],在这些地区单一的Ht抗性基因品种对玉米大斑病菌抗性作用已基本丧失,这与本研究结果相符。因此,仅依靠4个Ht单基因的垂直抗病品种已不能有效的防治玉米大斑病,而且针对含有2~4个Ht抗性基因的小种的出现频率呈上升趋势。针对Ht抗性基因的抗病效能需慎重对待,筛选新的抗源及培育和选育多基因抗性的抗病品种刻不容缓。
