伏立康唑谷浓度在血液科患者中的分布特征及影响因素
2019-09-07张瑞霞天津市第一中心医院药学部天津300192
张瑞霞,张 艳,张 弋,付 鹏,冯 浩(天津市第一中心医院药学部,天津 300192)
血液科患者由于服用免疫抑制剂、治疗中接受放化疗等因素发生侵袭性真菌感染的风险较高[1]。近年来,曲霉菌已经超过念珠菌作为血液系统恶性肿瘤患者侵袭性真菌感染的主要原因。两者感染所带来的死亡率都很高[2-4]。
伏立康唑作为对念珠菌和曲霉菌均有抗菌活性的抗真菌药物,现常用于血液病患者化疗及造血干细胞移植等过程中真菌感染的预防及治疗。但其血药谷浓度个体间甚至个体内差异较大、治疗窗窄,评估疗效临床缺乏直观依据,因此对其进行血药浓度监测为评估疗效及安全性提供了有效手段[5-6]。本研究通过测定伏立康唑血药谷浓度及CYP2C19 基因型,分析其在治疗和预防时血药谷浓度变异度及达标率;评估CYP2C19 基因型对伏立康唑谷浓度的影响,为伏立康唑个体化给药提供依据。
1 资料与方法
1.1 资料来源
回顾性收集2017 年1 月- 12 月于我院血液科接受伏立康唑预防或治疗侵袭性真菌感染的患者85例,收录相关信息。入选标准:1)血液科患者;2)在住院期间同时进行血药浓度监测和CYP2C19基因型测定。
1.2 治疗药物监测
采用高效液相色谱法(HPLC)测定伏立康唑血药浓度。本研究纳入的血药浓度均为谷浓度,若给予负荷剂量,收集第3 天以后血药浓度;若未给予负荷剂量,收集第7天以后血药浓度。本院设定的伏立康唑血药浓度有效治疗范围为1.0 ~ 5.5 mg·L-1。
1.3 基因检测
采用焦磷酸法测序。本研究只测定CYP2C19*2和CYP2C19*3基因型。CYP2C19*17位点在亚洲人中的突变频率仅为0.15% ~ 0.92%[7-8],因此未考虑该位点。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析,符合正态分布的计量资料以表示,采用t检验进行组间比较;不满足正态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用秩和检验进行组间比较。构成比以例数(百分比)表示,采用卡方检验或Fisher精确检验进行比较。多重线性回归用于确定导致C0血药浓度变异性的影响因素。
2 结果
2.1 一般资料
在2017 年1 月- 12 月,共有85 例血液病患者同时进行了血药浓度监测和CYP2C19 基因测定,患者一般资料见表1。根据《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》(第五次修订版)的治疗标准,纳入病例中用药目的有10例为目标治疗,37例因临床怀疑真菌感染给予经验治疗/诊断驱动治疗,38例因预防真菌感染给予预防治疗。
2.2 伏立康唑谷浓度在血液科患者的分布特征
本研究纳入85例血液病患者,共测定谷浓度201例次。其中有42例谷浓度< 1.0 mg·L-1,5例超出了推荐治疗范围5.5 mg·L-1。伏立康唑个体间谷浓度变异系数(CV)为65.6%,个体内谷值水平最大变异系数为56.6%。伏立康唑谷浓度水平与剂量之间没有相关性(r2≤ 0.033)。
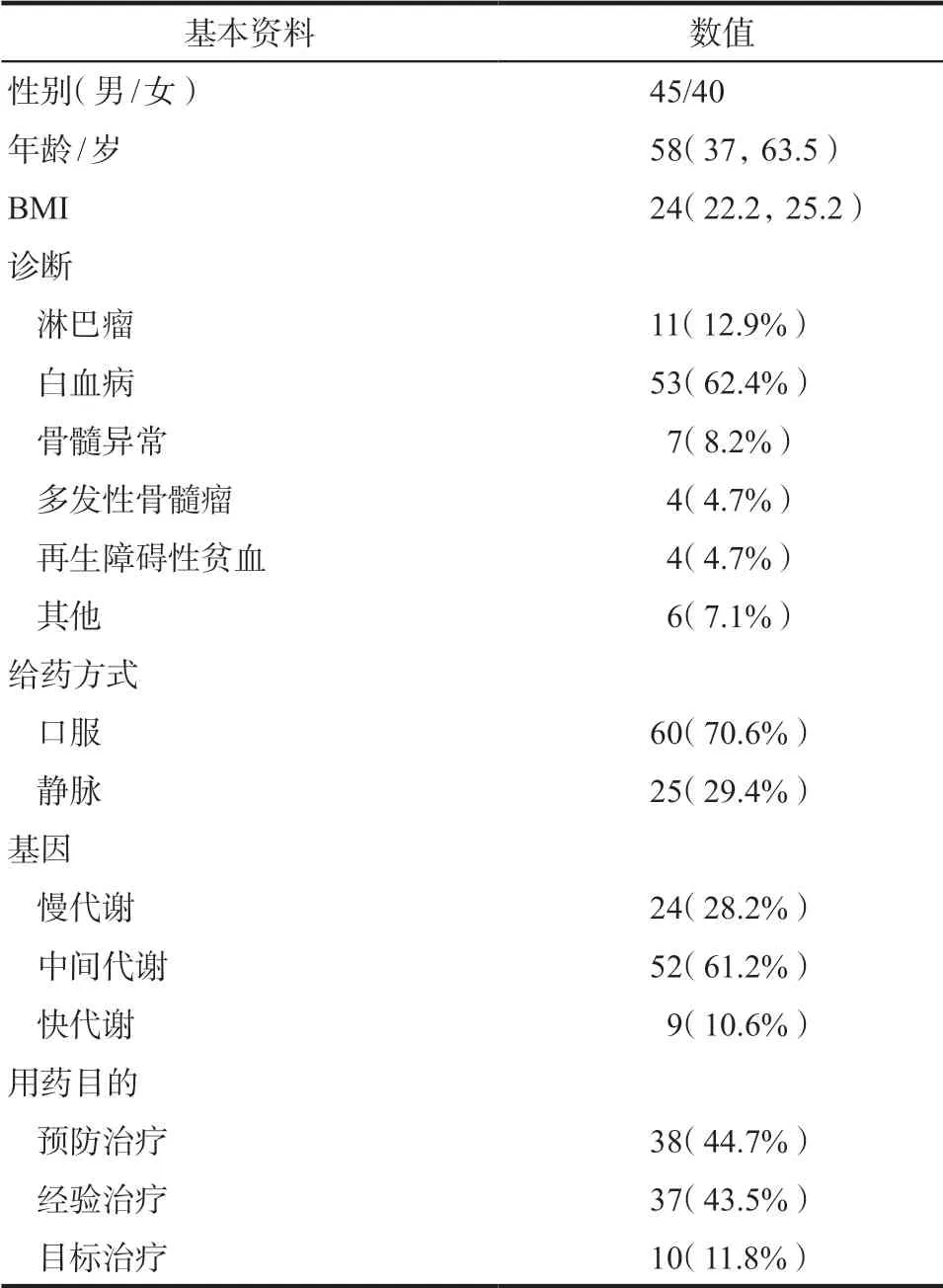
表1 85例血液科患者人口学特征、临床和实验室数据Tab 1 Demographic, clinical, and laboratory data for 85 hematological patients with therapeutic drug monitoring of voriconazole
按照不同给药剂量统计伏立康唑谷浓度未达标情况(见表2)。以治疗为目的伏立康唑血药浓度有效治疗范围为1.0 ~ 5.5 mg·L-1。预防的最低有效浓度目前尚未有定论,依据文献分别统计了以0.5 mg·L-1和1.0 mg·L-1为界限的达标率。
对各构成比进行Fisher 精确检验,结果显示,全部病例中三组给药剂量中谷浓度< 1 mg·L-1构成比差异具有统计学意义(P = 0.021),> 5.5 mg·L-1构成比差异没有统计学意义(P = 0.391)。预防给药病例中三组给药剂量谷浓度< 0.5 mg·L-1构成比和< 1 mg·L-1构成比差异具有统计学意义(P 分别为0.002,0.016),> 5.5 mg·L-1构成比差异没有统计学意义(P = 0.116)。
2.3 CYP2C19基因型
根据CYP2C19 基因型将患者分为3 组,分别为纯合子快代谢基因型(extensive metabolizer,EM)组、杂合子中间代谢基因型(intermediate metabolizer,IM)组及慢代谢基因型(poor metabolizer,PM)组。EM(CYP2C19*1/*1)发生率为30.6%(26/85);IM 发生率为57.6%(49/85),其中CYP2C19*1/*2 者44 例,CYP2C19*1/*3 者5 例;PM 发生率为11.8%(10/85),其中CYP2C19*2/*2 者2 例、CYP2C19*2/*3 者8 例、CYP2C19*3/*3者0例。
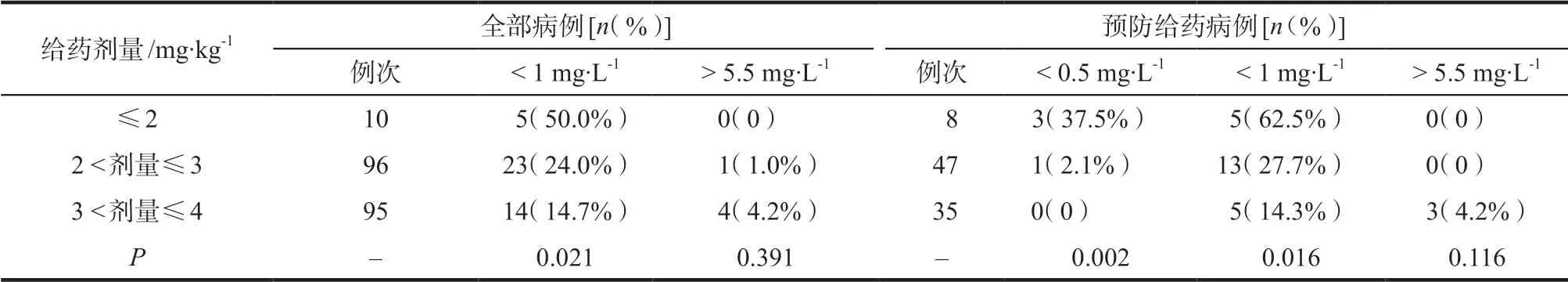
表2 伏立康唑不同给药剂量血药浓度未达标情况Tab 2 Unqualified blood concentration of voriconazole in different doses
比较不同CYP2C19 基因组中伏立康唑血药谷浓度的分布差异,采用Kruskal-Wallis H检验。各组伏立康唑血药谷浓度的分布不全相同,差异具有统计学意义(H = 12.252,P = 0.002)。
EM组伏立康唑谷浓度中位数为1.69 mg·L-1(n = 62),IM组伏立康唑谷浓度中位数为1.97 mg·L-1(n = 125),PM组伏立康唑谷浓度为2.95 mg·L-1(n = 14),总的伏立康唑谷浓度中位数为1.90 mg·L-1(n = 201)。
采用Bonferroni法校正显著性水平的事后两两比较发现,伏立康唑谷浓度的分布在EM和PM组(调整后P = 0.002)、IM和PM组(调整后P = 0.031)的差异有统计学意义,EM 和IM 组间的差异无统计学意义(调整后P = 0.181)。
3 讨论
伏立康唑作为对多种真菌具有活性的三唑类药物,目前在临床应用广泛,尤其是在血液科、移植、ICU等科室。但临床对其进行治疗药物监测的意义仍存在争议。
本研究主要分析了我院血液科患者伏立康唑谷浓度分布特征以及CYP2C19 基因型对其血药谷浓度的影响。本研究发现伏立康唑个体间谷浓度CV 为65.6%,个体内谷值水平最大CV 为56.6%,有20.9%的谷浓度< 1 mg·L-1。本研究纳入的病例除两例给予150 mg,q 12 h外,其余均按照常规剂量给予200 mg,q 12 h。但由于患者体质量不一致,大部分患者给药剂量低于说明书的推荐剂量4 mg·kg-1。由表2数据可得出给予患者< 4 mg·kg-1的剂量,可以显著增加伏立康唑谷浓度≥1 mg·L-1不达标率,但并不明显减少超过谷浓度上限的比例。因此按照体质量给药4 mg·kg-1相较固定剂量给药更有利于提高其血药浓度达标率。
对于血液科患者,很多时候伏立康唑被用来预防真菌感染。关于预防用药的血药浓度范围目前仍存在争议。一篇关于三唑类抗真菌药TDM 的研究[9]推荐伏立康唑预防谷浓度应≥0.5 mg·L-1。而德国血液肿瘤学会感染性疾病工作组在《预防血液系统恶性肿瘤患者侵袭性真菌感染的推荐意见》中推荐伏立康唑用于预防真菌感染时浓度范围为1 ~ 2 mg·L-1[10]。目前还没有针对我国人群的伏立康唑预防谷浓度推荐。在临床有时医生会认为既然是预防用药较低的剂量更利于患者。但是从本研究表2中可看出给药剂量太小血药浓度不达标的概率也增加。真菌感染对血液病患者往往具有较高的死亡率。因此预防治疗也应考虑给足剂量,更优的选择是进行伏立康唑谷浓度监测,从而制定最优方案。
伏立康唑主要经肝脏CYP2C19 代谢,部分由CYP3A4代谢,少部分由CYP2C9代谢。有研究证明CYP2C19基因多态性对伏立康唑血药浓度影响最大。与白种人(2% ~ 3%)相比,12% ~ 23%的亚洲人属于慢代谢型[11],我国慢代谢型的人群比例高达25%[12]。因此,对亚洲人监测伏立康唑血药浓度更为必要。本研究中28.2%的患者属于慢代谢型,但本研究为观察性试验,样本人群构成与正常人群存在差异,因此比例可能有所偏移。对伏立康唑不同基因型谷浓度分布进行非参数检验,谷浓度的分布在非慢代谢型(快代谢和中间代谢型)和慢代谢型的差异均有统计学意义。因此CYP2C19基因型对伏立康唑谷浓度具有一定影响,尤其是对于慢代谢人群影响显著,其结果与国内外一致。
目前已有多篇文献[13-14]以血液科患者为目标研究了伏立康唑的血药浓度个体差异及CYP2C19 基因型对其谷浓度的影响,均发现伏立康唑个体差异大,变异度大。CYP2C19 基因型对慢代谢型患者伏立康唑谷浓度影响更大。但现有的研究均未对预防用药达标情况进行分组分析。本研究结果与现有研究基本一致,同时评估了以预防为目的时伏立康唑谷浓度达标情况,结果显示以预防为目的应用伏立康唑时也应监测血药浓度,按说明书的推荐剂量4 mg·kg-1可减少其不达标率。
综上,无论用药目的是预防还是治疗,均建议对患者进行伏立康唑谷浓度的监测。CYP2C19 基因型对伏立康唑谷浓度具有一定的影响,尤其是在谷浓度异常时可评估患者基因型排除相关因素。
