质量守恒定律在初中化学解题中的应用探究
2019-09-06罗生华
罗生华
[摘 要]质量守恒定律是化学学科中的重要定律。为使学生深刻理解质量守恒定律,教师应总结教学经验,借助经典例题为学生讲解质量守恒定律的具体应用,使学生彻底掌握,灵活应用。
[关键词]质量守恒定律;初中化学;解题
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2019)20-0065-03
在初中化学质量守恒定律的教学中,教师应认真分析学生的理解误区,注重从宏观与微观的角度对质量守恒定律进行解释,使学生既能掌握质量守恒定律的“表”,又能掌握其“理”,充分理解质量守恒定律的内涵。
一、初中生质量守恒定律理解误区
初中化学教材中质量守恒定律的相关内容较为简单,但要想深入理解并非易事,一些学生常常进入理解的误区。实践表明,部分学生对质量守恒定律的理解存在以下误区:
1.概念掌握不牢固
质量守恒定律特别强调的是“参加反应的物质”,而非“反應物”。部分学生解题过程中将“参加反应的物质”理解为“反应物”,导致错误。究其原因是学生对质量守恒定律掌握不牢固,记忆与理解概念似是而非,解题时很容易受到其他因素的干扰,做出错误判断。
2.范围把握不准确
质量守恒定律的运用范围局限于化学反应,但部分学生常使用该定律来解释一些物理变化。如“将100 g的水和100 g的酒精混合后,其质量为200 g”这一结论虽然正确,但两者未发生化学反应,因此,并不能用质量守恒定律进行解释。
3.本质理解不透彻
部分学生对质量守恒定律的本质理解不透彻,尤其是对物质燃烧或有气体生成的化学反应,常认为它们不符合质量守恒定律。
针对以上误区,教师应做好引导工作,以确保学生正确、深入地理解质量守恒定律。一方面,抓住定律中的“变”与“不变”。其中一定不变的量有反应前后各物质的总质量、元素质量、元素种类、原子质量、原子数目、原子种类;一定改变的有物质种类、分子种类等;可能改变的是分子数目、元素化合价等。另一方面,需要注意的是守恒的是“总质量”,不是部分反应物和生成物的质量。
二、质量守恒定律在初中化学解题中的应用原则
在初中化学解题中质量守恒定律的应用应遵守一定的原则,只有如此才能帮助学生深刻理解,获得事半功倍的教学效果。
1.循序渐进
基于质量守恒定律的初中化学题目多种多样,有难有易。为了帮助学生树立自信,教师在创设相关问题时应运用一定的教学策略,注意由易到难、循序渐进,使学生体验到应用质量守恒定律解题的成就感,进一步牢固记忆、深刻理解质量守恒定律。
2.积极引导
为使学生养成应用质量守恒定律解题的意识与习惯,教学实践中教师应积极引导。一方面,优选经典例题,为学生详细讲解解题过程,使学生感受质量守恒定律的应用优势,充分认识到质量守恒定律的重要性。另一方面,针对难度稍大的化学试题,教师应给予思路上的点拨,使学生尽快找到解题思路,少走弯路。
3.注重反思
应用质量守恒定律解答初中化学试题时,为获得良好效果,应从两方面做好反思:一方面,教师应注重教学反思。反思教学环节存在的不足,及时采取有效措施加以优化、改进。另一方面,引导学生做好解题反思,掌握不同的化学试题类型,总结应用质量守恒定律解题的方法与技巧。
三、质量守恒定律在初中化学解题中的应用策略
初中化学教师要使学生掌握质量守恒定律这一重要知识点,灵活应用质量守恒定律解答各种化学试题,应做好教学总结与研讨,寻找有效教学策略。
1.纠正误区,夯实基础
为使学生正确理解与应用质量守恒定律,教师应依托经典例题,纠正学生的理解误区,使学生切实夯实基础,抓住质量守恒定律的本质,以不变应万变。
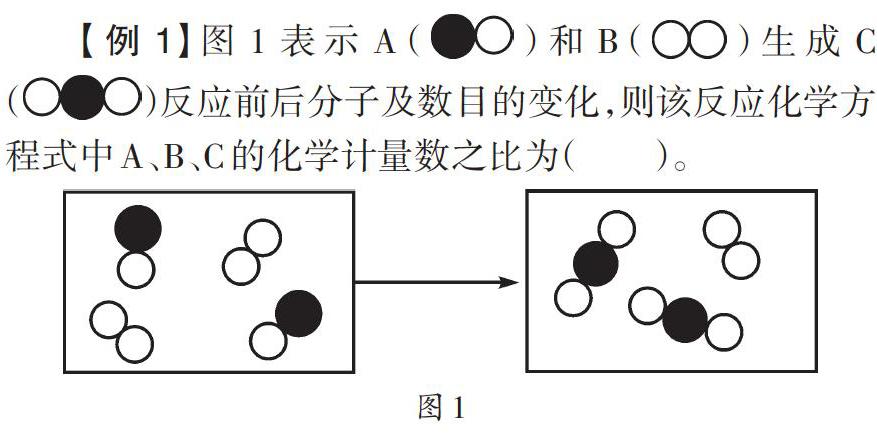
分析:根据化学反应前后分子变化,求解化学计量数之比,是质量守恒定律应用的具体体现。解答该类题目时,学生应认真读图,分析反应前后分子的变化情况,牢牢把握质量守恒定律的本质,找到参与反应与生成的分子个数。分析可知,B有一个分子未参加反应。参与反应的有两个A分子,一个B分子,生成两个C分子,因此,其化学反应方程式为:2A+B=2C,正确答案为A。
方法点拨:解答该类试题时应认真对比反应前后分子数的变化,以参与反应的分子数为准,未参加反应的分子不做考虑。
2.借助实验,加深理解
实验是研究化学反应规律及相关定律的重要手段,在加深学生理解的同时,可很好地培养学生的学习兴趣。教学实践中,为加深学生对质量守恒定律的理解,教师应创设相关实验问题,引导学生正确应用质量守恒定律分析实验过程、实验现象,鼓励学生思考、解答。
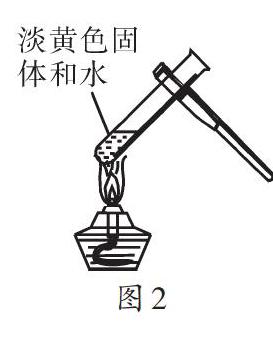
【例2】小刚为研究质量守恒定律,做镁粉在空气中燃烧的实验。该实验的化学反应方程式为: 。实验结束,他发现产物中存在少量黄色固体,为研究黄色固体的成分,做了如下探究:
查资料得知,镁可和氮气发生剧烈反应,生成氮化镁(Mg3N2),Mg3N2和水发生剧烈反应生成的氨气可使湿润的红色石蕊试纸变蓝。
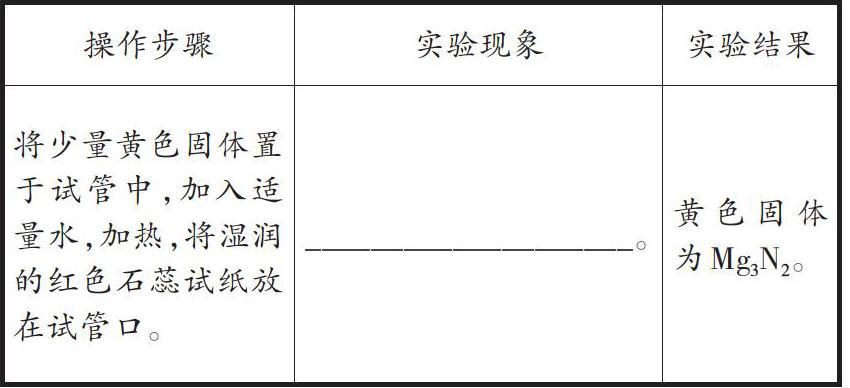
小刚使用图2所示的实验装置(部分操作未画出)验证黄色固体为Mg3N2。请填写发生的实验现象:
小亮使用图3装置进行实验,发现试管口出现液滴,澄清石灰水变浑浊,试管中有白色固体出现。实验后,小亮觉得小红的猜想也是不对的,原因是 。
分析:该题目以实验为背景,考查质量守恒定律的应用。认真读题,充分理解题意是解答该题的关键。其中,镁粉在空气中燃烧生成氧化镁的化学方程式为:[2Mg+O2点燃2MgO]。根据资料,氮化镁和水发生剧烈反应生成氨气,而氨气可使湿润的红色石蕊试纸变蓝。因为MgO为白色固体,因此,小刚的猜想是错误的。实验后,小亮认为小红的猜想不正确,原因在于澄清石灰水变浑浊表明有CO2生成,而Mg(OH)2中不含C元素。
方法点拨:解答此类型实验题时,要求学生熟练掌握常见物质的化学反应方程式,尤其在解答与质量守恒相关的实验题目时,应牢牢抓住反应前后“不变”的量,根据实验现象准确判断存在的元素种类。
3.积极训练,积累经验
为提高学生应用质量守恒定律解答化学试题的能力,教师应注重积累典型題目对学生进行训练,使学生在训练中加深理解,积累解题经验,不断提高解题水平。
【例3】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质的量如图4所示,下列说法错误的是()。
分析:该题目中文字与图像相结合,对学生的读图能力以及质量守恒定律的应用要求较高。观察可知,反应中甲和丁的质量减小,是反应物;乙的质量增加,为生成物,因此该反应为化合反应,A正确。丙在反应前后质量不变,可能是催化剂,也可能不是催化剂同时不是反应物与生成物,B正确。乙、丁的质量变化比为(32-4)∶(24-4)=7∶5,C正确。甲、乙的质量变化比为(16-8)∶(32-4)=2∶7,D错误。
方法点拨:解答该类题目时应认真读图,找到图中的“变”与“不变”的量,以及“变化量”之间的关系,运用质量守恒定律逐一分析各选项,最终确定正确答案。
4.注重拓展,提升能力
运用质量守恒定律解答初中化学试题时,教师应注重拓展,为学生创设有难度的问题,在夯实学生所学知识的同时,不断提高学生的应用能力。
【例4】一定条件下,一密闭容器中发生某反应,测得反应前后各物质的质量如下表所示,则下列说法错误的是()。
分析:解答该题目需要应用到质量守恒定律。其中反应后质量减少的是反应物,质量增加的是生成物。差量是生成的质量或参与反应的质量,c质量增加20 g-10 g =10 g,c是生成物。d质量增加20 g -15 g = 5 g,d是生成物。两种物质质量增加15 g,而b只有5 g,因此,a一定是反应物,A正确。如果b是反应物,则(30 - x)+(5 - y)=10 + 5,得x + y = 20;如果b是生成物,则30 - x = 10 + 5 +(y - 5),得x + y =20,B正确。x不可能是0,C错误。反应生成c与d的质量之比为10∶5 = 2∶1,D正确。故选C。
方法点拨:解答该类题目时,应根据表格以及质量守恒定律认真分析,找到物质质量减少与增加的规律,如无法判断,应进行分类讨论,保证考虑问题的全面性。
总之,初中化学教学中,为使学生深刻理解、灵活应用质量守恒定律,教师应注重总结教学经验,明确学生的理解误区,遵守相关的应用原则,依托具体例题进行讲解,使学生感受质量守恒定律的应用过程,总结与积累质量守恒定律的应用方法与技巧。
[ 参 考 文 献 ]
[1] 刘维维.质量守恒定律在初中化学中的应用分析[J].中国校外教育,2018(13):123-124.
[2] 梁俊.“质量守恒定律”教学案例的分析与思考[J].化学教与学,2018(5):73-75.
[3] 林秋香.浅谈守恒定律在初中化学解题中的运用[J].中小学教学研究,2016(12):26-27+30.
(特约编辑 温 简)