内部沸腾法提取茶树菇多糖的工艺探究
2019-09-04杨财容苟丽萍叶美金祁伟亮刘松青
杨财容,苟丽萍,叶美金,祁伟亮,刘松青
(成都师范学院化学与生命科学学院,四川成都 611130)
近年来,国内外关于真菌多糖及其复合物所具有的生物活性以及生物学功能是一大热点内容,同时随着对真菌多糖的提取方法、生理功能、制备合成、以及药理学等研究的深入,现已取得了明显的成就。目前,关于茶树菇多糖的提取方法以传统的热水浸提法[1-3]为主,传统热水浸提法虽然操作简便,不需要特殊设施,提取工艺成本也较低,但普遍存在提取时间长、提取率低、产物杂质多等问题。韦藤幼[4]提出了植物有效成分的解吸-热提两步提取法即内部沸腾法,该方法是先用少量的低沸点有机溶剂将提取物料完全浸润后,加入温度高于有机溶剂沸点的提取剂提取一段时间。内部沸腾法的原理是高温度的提取剂使渗透到物料内部的低沸点有机溶剂发生内部沸腾引起对流扩散,从而将被提组分挟带至提取溶剂内,达到强化提取的效果[4]。目前,内部沸腾法已被应用于多种植物有效成分的提取中,如香菇[5]、金银花[6]、火龙果果皮[7]、壶瓶枣[8]等中多糖类物质的提取,松针[9]中有机酸类物质的提取,银杏叶[10]黄酮类物质的提取,结果表明内部沸腾法是一种提取速率快、提取率高并且产物杂质少的提取方法。
内部沸腾法现已应用于香菇多糖的提取工艺中,但未见其在茶树菇多糖提取工艺方面的运用,因此本试验以茶树菇为原料,选择乙中醇为解吸剂,蒸馏水为提取剂,主要考察乙醇用量、乙醇浓度、乙醇解吸时间、用水量与物料的比例(液料比)、提取温度、提取时间六个影响因素对茶树菇多糖提取率的影响,通过单因素试验和正交优化试验探究内部沸腾法提取茶树菇多糖的最佳工艺条件,为茶树菇多糖的开发、利用提供科学依据和技术支持。
1 材料与方法
1.1 材料与试剂
茶树菇子实体干品,购于成都永辉超市,产于四川省青川县;葡萄糖(AR);无水乙醇(AR);苯酚(AR);浓硫酸(AR)。
1.2 主要仪器设备
JA1203B型电子天平(上海良平仪器仪表有限公司)、A550型九阳粉碎机(九阳股份有限公司)、UV-2102型紫外分光光度计(上海菁华科技仪器有限公司)、SHB-III型循环水式多用真空泵(郑州长城科工贸有限公司)、DHG-9123A型恒温鼓风干燥箱(上海一恒科学仪器有限公司)、DHG-9123A型电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.3 方法
1.3.1 工艺流程
茶树菇预处理(烘干、粉碎、过筛)→乙醇解吸→热水浸提→减压抽滤→茶树菇多糖提取液→茶树菇多糖含量测定→茶树菇多糖提取率计算。
1.3.2 操作要点
(1)茶树菇预处理:将茶树菇置于恒温干燥箱中烘干,烘干后用九阳粉碎机粉碎得到茶树菇粉末。
(2)乙醇解吸:精确称取1.00g茶树菇粉末于烧杯中,用一定浓度、一定量的乙醇溶液充分渗透茶树菇粉末,并解吸一定时间。
(3)热水浸提:乙醇解吸完成后立即加入一定温度、一定量的蒸馏水,恒温热水浸提一定时间。
(4)减压抽滤:将经热水浸提后的上清液减压抽滤至100mL容量瓶中,并用蒸馏水洗涤茶树菇粉末残渣2~3次,将洗涤液转移至容量瓶中,加蒸馏水定容至刻度线,得到茶树菇提取液。
1.3.3 单因素试验
准确称取18组茶树菇粉末,每组5份,每份1.00g,将茶树菇粉末用5mL的40%乙醇溶液解吸25min后加入液料比为15∶1温度为90℃的蒸馏水提取5min。1组5份,分别对应1个单因素试验中的5个水平,每个单因素进行3次平行试验,每个单因素实验完成后得到3组共计15份多糖提取液。其中乙醇体积分数设置的5个考察水平分别为20%、30%、40%、50%、60%;乙醇用量设置的5个考察水平分别为3.0mL、4.0mL、5.0mL、6.0mL、7.0mL;解吸时间设置的5个考察水平分别为10min、15min、20min、25min、30min;液料比设置的5个考察水平分别为10∶1、15∶1、20∶1、25∶1、30∶1;提取温度设置的5个考察水平分别为80℃、85℃、90℃、95℃、100℃;提取时间设置的5个考察水平分别为5min、6min、7min、8min、9min。
1.3.4 正交试验
根据单因素试验结果,从6个影响因素中选取3个主要因素,设计L9(33)即3因素3水平正交试验,平行3次试验得到27组多糖提取液,通过对提取液中多糖含量及提取率的测定和计算,使用SPSS19.0软件对实验数据进行方差分析,分析数据后得出内部沸腾法提取茶树菇多糖的最佳工艺参数组合。
1.4 分析方法
1.4.1 多糖含量测定采用苯酚-硫酸法
参考SN/T4260-2015出口植物源食品中粗多糖的测定[11]完成葡萄糖标准曲线的制备,得回归方程为Y=0.5369X+0.192(R2=0.9992)。
取茶树菇多糖提取液1mL于100mL容量瓶中稀释定容,移取1mL稀释液置于50mL比色管,参照香菇中粗多糖含量测定方法[12]测定吸光值,根据标准回归方程计算茶树菇多糖提取液中的含糖量。
1.4.2 多糖提取率计算
根据公式(1)计算茶树菇多糖提取率。

式(1)中,M1:测得的茶树菇多糖含量(mg);V1:茶树菇多糖提取液定容体积(mL);N:多糖提取液稀释倍数,100倍;V2:测定吸光度时移取多糖提取液的体积(mL);M2:茶树菇粉末质量(g);0.9:将葡萄糖换算成葡聚糖的校正系数。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 乙醇体积分数对茶树菇多糖提取率的影响
由图1可知,茶树菇多糖提取率随乙醇体积分数增大先升高后降低,在乙醇体积分数的5个水平间多糖提取率变化范围在7.70%~11.97%,各水平间效果差异明显,说明乙醇体积分数是影响多糖提取率的主要因素之一。当乙醇体积分数为20%时,反应体系中乙醇含量少,内部沸腾强度低,多糖提取率仅有7.70%。增加乙醇体积分数后,反应体系中的乙醇含量增加,内部沸腾强度增大,多糖提取率增加。当乙醇浓度达到40%时,多糖提取率最大为11.97%,继续增加乙醇体积分数,由于多糖不溶于高浓度的乙醇,多糖溶解度开始降低,提取率也随之降低。因此初步确定本实验中乙醇最佳体积分数为40%左右。

图1 乙醇体积分数对茶树菇多糖提取率的影响
2.1.2 乙醇用量对茶树菇多糖提取率的影响
由图2可知,随着乙醇用量的增加茶树菇多糖提取率先增加后逐渐趋于稳定,在乙醇用量的5个水平间多糖提取率变化范围在10.33%~12.41%,效果差异不明显,因此乙醇用量为次要因素。当乙醇用量为3mL时,乙醇溶液不能完全浸润茶树菇样品粉末,解吸不充分影响多糖溶出,多糖提取率较低;当增加乙醇用量后,乙醇溶液能完全渗透到茶树菇内部,利于多糖溶出,多糖提取率增加。当乙醇用量增加至5mL后继续增加乙醇用量,多糖提取率趋于平稳,说明乙醇解吸作用已基本达到饱和。从节约资源的角度考虑,本实验最佳乙醇用量为5mL。
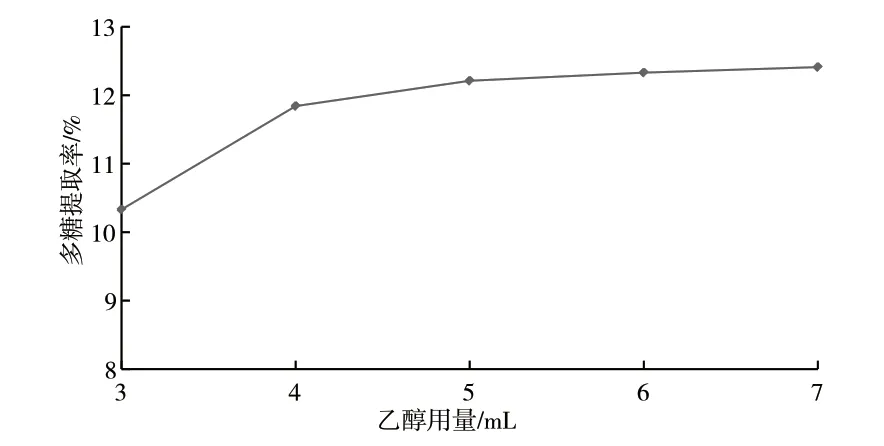
图2 乙醇用量对茶树菇多糖提取率的影响
2.1.3 解吸时间对茶树菇多糖提取率的影响
如图3所示,茶树菇多糖提取率随着解吸时间的增加而增加,在解吸时间5个水平间多糖提取率由7.1%增至13.21%,各水平间的效果差异明显,解吸时间是影响茶树菇多糖提取率的主要因素之一。当解吸时间为10min时,解吸时间短,反应体系中乙醇溶液和茶树菇粉末接触不充分,多糖提取率仅有7.1%,增加解吸时间后乙醇渗透充分,解吸越来越充分,多糖提取率增加,当解吸时间为25min时多糖提取率为12.95%,解吸时间继续增加至30min时,多糖提取率为13.21%,多糖提取率的增幅速率较小但仍有增加的趋势,因此还需增加大于30min的水平进一步判断本实验的最佳解吸时间。

图3 解吸时间对茶树菇多糖提取率的影响
2.1.4 液料比对茶树菇多糖提取率的影响
由图4可知,茶树菇多糖提取率随着的液料比的增大而升高,在液料比5个水平间多糖提取率由10.81%升至12.87%,相对其他影响因素液料比各水平间效果差异较小,为次要因素。当液料比为10∶1时,用水量少,茶树菇细胞胞内的多糖溶出量低,多糖提取率较低;增加用水量后,多糖溶出加快,残留在茶树菇内部的多糖减少,多糖提取率升高;当用水量达到为物料的15倍后,继续增加用水量,提取率仅有0.18%的变化,说明多糖提取已基本完全。同时,用水量过大会造成其他水溶性成分的溶出,从而影响最终的实验结果准确度。因此本实验最佳液料比为15∶1。

图4 液料比对茶树菇多糖提取率的影响
2.1.5 提取温度对茶树菇多糖提取率的影响
由图5可知,茶树菇多糖提取率随着提取温度的升高先增加后降低,在提取温度的5个水平间多糖提取率变化范围在8.26%~14.46%,各水平间的差异变化明显,提取温度是影响茶树菇多糖提取率主要因素之一。当提取温度为80℃时,提取温度小于40%乙醇溶液的沸点83.1℃,乙醇不能发生沸腾,多糖溶出困难,多糖提取率仅有8.26%;增加提取温度后,提取温度大于40%乙醇的沸点,茶树菇内部发生沸腾,多糖分子以对流扩散的方式大量扩散到蒸馏水中,多糖提取率增加;当提取温度升至90℃时,茶树菇多糖提取率达到14.46%;继续升高温度至100℃,多糖提取率出现下降,分析其原因可能是提取温度过高,多糖分子因热不稳定性而产生分解,导致提取率出现下降。故初步判定本实验最佳提取温度为90℃左右。

图5 提取温度对茶树菇多糖提取率的影响
2.1.6 提取时间对茶树菇多糖提取率的影响
由图6可知,茶树菇多糖提取率随着提取时间的增加先升高后下降,在提取时间5个水平间,多糖提取率变化范围在11.46%~14.97%,相对其他影响因素各水平间的效果差异较不明显。当提取时间为5min时,提取时间短,反应体系中蒸馏水与茶树菇接触不充分,多糖提取率较低;当增加提取时间,反应体系中物料与试剂接触越来越充分,多糖扩散慢慢达到平衡,多糖提取率增加,提取时间增加为8min时有最大提取率;继续增加提取时间,多糖提取率出现下降,分析原因可能是提取时间较长,茶树菇中其他非多糖类水溶性成分溶出,影响多糖溶出,提取率下降。因此,本实验中最佳提取时间为8min。

图6 提取时间对茶树菇多糖提取率的影响
2.2 正交试验结果分析
在单因素试验结果的基础上,对乙醇体积分数、解吸时间、提取温度三个因素设计三因素三水平的正交试验。因素水平见表1,正交试验及结果见表2。

表1 正交试验因素水平表
由表2中极差值R可知,B(解吸时间)>C(提取温度)>A(乙醇体积分数)这说明在这三个考察因素的取值范围内,影响茶树菇多糖提取率最主要的因素是乙醇解吸时间,提取温度的影响次之,而乙醇体积分数对提取率的影响最小。
由表2比较各因素间不同水平的效果值,对于因素A(乙醇体积分数)有k2>k3>k1说明A2水平的多糖提取率效果最佳,对于因素B(解吸时间)有k1>k3>k2说明B1水平的多糖提取率效果最佳,对于因素C(提取温度)有k1>k3>k2说明C1水平的多糖提取率效果最佳。因此确定最佳因素水平组合为A2B1C1,即乙醇体积分数为40%、乙醇解吸时间25min、热水浸提温度为88℃。

表2 正交试验及极差分析结果
采用SPSS19.0软件对表2中数据进行数据分析处理,方差分析结果见表3。由表3中P值可知,PA=0.200>0.05说明因素A(乙醇体积分数)在取值范围内对茶树菇多糖提取效果差异不显著;PB=0.017<0.05说明因素B(解吸时间)在取值范围内对茶树菇多糖提取效果存在差异性显著;PC=0.034<0.05说明因素C(提取温度)在取值范围内对茶树菇多糖提取效果存在显著差异。
由PA=0.2>0.05>PC=0.034>PB=0.017,说明因素B(解吸时间)差异显著性大于因素C(提取温度)的差异显著性大于因素A(乙醇体积分数)的差异显著性。结合F值检验结果FB>FC>F0.05=19.164>FA,同样说明因素B(解吸时间)组间有显著的差异,因素C(提取温度)组间有显著性差距,因素A(乙醇体积分数)组间无显著性差异,同时因素B(解吸时间)差异性大于因素C(提取温度)。对实验结果影响更大,因此,在整个实验过程中应严格控制乙醇解吸时间,要使茶树菇物料被乙醇浸润完全,解吸充分,从而提高茶树菇多糖提取率,以达到试验预期效果。
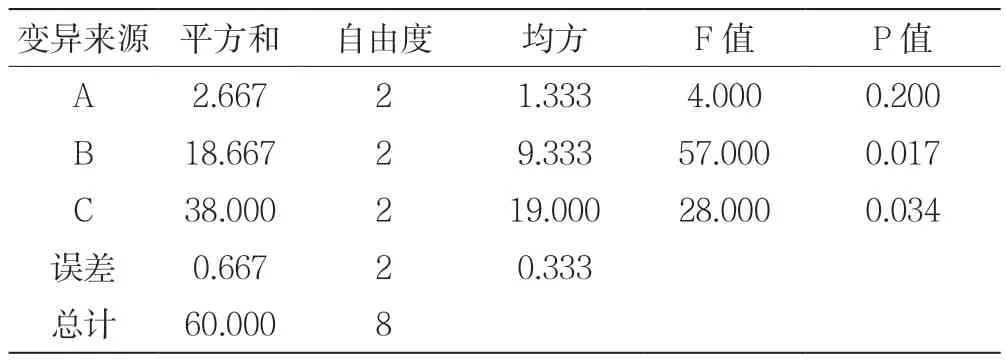
表3 方差分析结果
2.3 验证试验
结合单因素实验分析和正交实验分析结果,最终得出内部沸腾法提取茶树菇多糖的最佳工艺参数为:乙醇用量5mL、乙醇体积分数40%、乙醇解吸时间25min、蒸馏水提取温度88℃、蒸馏水用量为茶树菇用量的15倍、蒸馏水提取时间8min,这样的参数组合没有出现在正交试验中,为检验实验结果的准确性,按照上述最优工艺参数提取茶树菇多糖测定多糖提取率进行验证,重复实验3次测得茶树菇多糖提取率分别为22.24%、22.14%、22.10%,平均值为22.16%,高于正交试验表中最大提取率20.16%,故认为该组合是内部沸腾法提取茶树菇多糖的最佳工艺组合。在最优提取工艺条件下,茶树菇多糖提取率具有稳定性,试验重复性较好,说明正交试验得出的最佳提取工艺是合理的。
2.4 内部沸腾法与热水提取法的比较
将最优试验条件下提取的茶树菇多糖提取率、提取时间、工艺参数等与传统热水浸提法相比较,结果如表4所示。

表4 内部沸腾法与热水浸提法的比较
(1)热水浸提法提取茶树菇多糖提取率为13.10%[3],内部沸腾法提取茶树菇多糖提取率为22.16%,多糖提取率增加了69.16%。
(2)热水浸提法提取一次需要4h[3],而内部沸腾法提取工艺整个流程仅需0.5h,极大的缩短了提取时间。
3 结论
本研究采用内部沸腾法提取茶树菇多糖,确定最佳提取工艺参数为乙醇用量5mL,乙醇体积分数40%,乙醇解吸时间25min,液料比15∶1,提取温度88℃,提取时间8min。在最佳提取工艺下,内部沸腾法提取茶树菇多糖的多糖提取率达到22.16%,与传统热水浸取法相比较多糖提取率提高了69.16%,提取时间缩短了3.5h,降低了蛋白质、色素等其他非糖物质的溶出机率。同时,内部沸腾法提取茶树菇多糖具有用时短、提取率高、杂质少、操作简单、成本低等优点。
