银杏酸C17:1衍生物增效达托霉素抗粪肠球菌的发现与机制的初步研究
2019-09-02陆璐翟贯星王金鑫金慧子李慧梁陈代杰
陆璐 翟贯星 王金鑫 金慧子 李慧梁,* 陈代杰
(1 华东理工大学生物工程学院,上海 200237;2 上海交通大学药学院,上海 200240;3 上海师范大学生命与环境科学学院,上海 200234;4 第二军医大学药学院,上海 200433)
近年来,抗生素滥用导致的细菌耐药严重威胁着人类的健康生活,引起了全球关注。新型化学合成或微生物来源的抗生素相对匮乏,因此,人们试图从中草药中寻找具有抗菌活性或是增效作用的化学物质。银杏具有多种生理活性作用,已被广泛用于临床。银杏中主要存在3类活性物质,分别是银杏内酯、银杏黄酮以及银杏酸。银杏酸具有细胞毒性[1-3],很多不良反应与之相关,我国对于银杏药物质量的控制指标是银杏酸含量低于百万分之十[4],但是银杏酸在抗菌[5]、抗炎[6]、杀虫等方面具有很好的活性,也可抑制多种肿瘤的生长[7-8]。目前有大量研究将熊果酸、大黄素等天然产物和抗生素联用抗菌取得了不错的进展[9],但是将银杏酸作为一种抗菌增效剂[10]和抗生素联用进行研究的文献基本没有,银杏酸的抗菌研究还只停留在单独作用[11-14]。
银杏酸存在于银杏的叶、果、外种皮中,其中外种皮的含量最高[15]。银杏酸由5种同系物组成,银杏酸C17:1结构为在水杨酸C6位连接含有17个碳,1个双键的长碳链。本文对银杏酸C17:1衍生物的抗菌作用以及增效作用进行了研究。
1 材料与方法
1.1 样品
(1)实验菌株:标准菌株:耐甲氧西林金黄色葡萄球菌ATCC43300、耐万古霉素粪肠球菌ATCC51299、鲍曼不动杆菌ATCC19606、铜绿假单胞菌ATCC27853、肺炎克雷伯菌ATCC13883、敏感粪肠球菌ATCC29212、敏感屎肠球菌ATCC35667;临床分离菌株:耐万古霉素粪肠球菌临床株1株、敏感屎肠球菌临床株5株。
(2)化合物:银杏酸C17:1、银杏酸C17:1衍生物Ⅰ、银杏酸C17:1Ⅱ、达托霉素均购于湖北健源化工有限公司。
(3)主要试剂:脑心浸出液肉汤(BHI)购于北京三药科技开发有限公司、营养肉汤培养基(LB)购于北京奥博星生物技术有限责任公司、活性氧试剂盒购于碧云天生物公司。
1.2 方法
1.2.1 银杏酸C17:1衍生物的合成
取银杏酸C17:1(2.0g,5.34mmol)溶于25mL乙醚中,0℃条件下分批次加入氢化铝锂(304mg,8.01mmol),室温搅拌12h。反应结束后,0℃条件下缓慢滴加盐酸水溶液(1mol/L),使反应体系pH=3~4,再用乙酸乙酯萃取(25mL,3次),合并有机层用饱和食盐水洗,并用无水硫酸钠干燥,减压旋干后得到衍生物I 1.8g(4.97mmol,纯度93%)。
取银杏酸C17:1衍生物I(1.0g,2.77mmol)溶于5mL甲醇中,分别加入氯化钯(49.1mg,0.277mmol)聚甲基硅氢氧烷[0.55mL,8.31mmol(以单体估算)]。反应体系升至40℃,并在该温度下加热24h。反应结束后体系降至室温,将体系减压旋干,直接进行柱层析分离(PE/EA,10:1)得到衍生物II854mg(2.47mmol,纯度89%)。
1.2.2 银杏酸C17:1的结构表征
测定银杏酸C17:1衍生物Ⅰ和Ⅱ的熔点、质谱(ESI.MS)和核磁共振谱(13C NMR、DEPT 90和135),并将其与银杏酸C17:1的波谱数据比较,对银杏酸C17:1衍生物进行结构表征。
1.2.3 菌悬液的制备
按照美国临床和实验室标准指南(CLSI)提供的步骤进行实验,具体步骤如下:首先配制所需固体培养基进行铺板,然后从-80℃冰箱取甘油管在固体平板上划线活化,于37℃培养箱过夜培养,再挑取单菌落至含1mL液体培养基的试管,将其置于转速220r/min、37℃的摇床中培养12~16h,用培养基稀释至菌落数为107CFU/mL数量级,4℃冰箱保存备用。
1.2.4 联合抗耐药菌作用的测定
参考CLSI 2012标准执行,采用微量肉汤稀释法,针对各种致病菌选用临床上常用的抗生素和衍生物联用。运用棋盘法分别测定银杏酸C17:1及其衍生物Ⅰ、Ⅱ与抗生素的联合抗菌作用。主要过程是选定4μg/mL化合物的浓度联合抗生素,参照CLSI M07-A9[16]标准制备倍比稀释的抗菌药物,以含单一抗生素的培养液为阳性对照,不接种细菌的培养物为阴性对照,将96孔板置于37℃恒温培养箱中,培养18~24h后,观察细菌的生长情况[17],并判读药物单独的最低抑菌浓度(MIC),计算两者联用的部分抑菌浓度指数(FICI),其 计 算 公 式 为:F I C I=M I CA联用/MICA单独+MICB联用/MICB单独,其中MICA联用和MICB联用为A和B联用时MIC中A和B的浓度;MICA单独和MICB单独即为A和B单用时各自的MIC;A为银杏酸C17:1或是其衍生物Ⅰ、Ⅱ,B为抗生素。判断联用效果的标准为:FICI≤0.5,协同作用;0.5<FICI≤4,无关作用;FICI>4,拮抗作用[18]。
1.2.5 时间杀菌曲线测定
将过夜培养的耐万古霉素粪肠球菌ATCC 51299按照1:10000的比例接入含4mL液体培养基的试管中并向试管中分别加入16μg/mL达托霉素,4μg/mL衍生物II+2μg/mL达托霉素,4μg/mL衍生物II+4μg/mL达托霉素,4μg/mL衍生物II+8μg/mL 达托霉素,4μg/mL衍生物II+16μg/mL达托霉素,同时以不加任何药物和只加衍生物II的做空白对照组,在0、2、4、6、8和24h进行定量取样。将取出的菌液依次10倍稀释,分别选取合适的稀释倍数的稀释液100μL;涂布于计数培养基平板上,且每个稀释度涂布2~3个平行板,在37℃恒温培养箱中倒置培养16~20h,进行活菌菌落计数,以菌落形成单位(colony-forming units,CFU)表示。将各培养管菌落计数的对数与培养时间在直角坐标作图得到时间杀菌曲线,评价组合药物的杀菌效力[19]。
1.2.6 Zeta电位测定
细菌培养至对数生长期后离心,用PBS洗涤并重悬至细菌的浓度为1×109CFU/mL,4μg/mL达托霉素和GADII混合药液作为实验组,只加达托霉素或只加衍生物II的作为对照组,细菌与药物在37℃、100r/min下孵育20min,然后进行Zeta电位测定。
1.2.7 活性氧水平的测定
将耐万古霉素粪肠球菌模式菌株ATCC 51299接种后培养6~8h左右,用PBS洗涤2次重悬,将探针DCFH-DA(10mmol/L)加入到菌液中至10μmol/L。37℃环境下孵育20min,无菌PBS缓冲液洗涤3次,以去除未装载进细菌的DCFH-DA。在96孔板中用二倍稀释法配置成不同浓度的达托霉素和GADII混合药液以及只加达托霉素的实验组,空白对照加入等量的PBS缓冲液,阳性对照加入Rosup至浓度为15μg/mL,37℃下刺激时间30min。将菌液转移至96孔板中,通过酶标仪测定其荧光强度,激发波长和发射波长分别为488和525nm。
1.2.8 N-苯基-1-萘胺吸收测定
细菌在BHI培养基中培养至对数生长期,通过1500g离心10min,洗涤两次并再悬浮在pH7.4 HEPES缓冲液中,调整菌落数至1×107CFU/mL,往准备好的菌液中加入N-苯基-1-萘胺(NPN)至浓度10μg/mL混匀分装至96孔板中,96孔板中含有不同浓度的达托霉素和银杏酸C17:1衍生物的混合物,孵育1h。用荧光酶标仪测定荧光强度变化,荧光的发射波长和激发波长分别设定为350和420nm。
2 结果
2.1 银杏酸C17:1衍生物的合成和结构表征
2.1.1 银杏酸C17:1衍生物I的合成和结构表征
衍生物I的MS、NMR波谱数据和理化常数如下:无色油状物,易溶于二氯甲烷、乙酸乙酯等有机溶剂。1H NMR(500MHz,Chloroform-d) δ 7.10(t,J=7.8Hz,1H),6.74(dd,J=7.8,5.2Hz,2H),5.41~5.32(m,2H),4.83(s,2H),2.63~2.53(m,2H),2.04(td,J=7.3,6.1,3.6Hz,4H),1.51(p,J=7.4Hz,2H),1.43~1.20(m,20H),0.95~0.88(t,J=6.9,3H) ppm;13C NMR(126MHz,Chloroform-d) δ 156.16,142.39,129.87,129.85,129.23,121.69,120.58,114.08,66.08,33.31,31.97,30.11~28.33(6C) 27.22,26.92,22.70,22.66,22.34,14.11,14.00ppm; HRMS(m/z):[M+H]+calcd for [C24H41O2]+361.5900; found 361.5907。
2.1.2 银杏酸C17:1衍生物II的合成和结构表征
衍生物IIMS、NMR波谱数据和理化常数如下:白色粉末,易溶于二氯甲烷、乙酸乙酯等有机溶剂。1H NMR(500MHz,Chloroform-d) δ 6.99(t,J=7.8Hz,1H),6.75(dd,J=7.6,1.2Hz,1H),6.63(dd,J=8.0,1.2Hz,1H),4.83(s,1H),2.67~2.51(m,2H),2.20(s,3H),1.64~1.47(m,2H),1.47~1.17(m,28H),0.89(t,J=6.9Hz,3H) ppm;13C NMR(126MHz,Chloroform-d) δ 153.75,142.96,126.00,121.89,121.61,112.45,33.71,31.92,30.54,29.69-29.65(9C),29.61,29.54,29.35,22.68,14.10,11.07ppm.HRMS(m/z):[M+H]+calcd for [C24H43O]+347.6070; found 347.6077。
2.2 联合抗耐药菌作用
本实验选用世界卫生组织公布的12种致病菌中的5种,这5种菌株均是标准菌株,运用棋盘格法设计试验,在96孔板上分别测定银杏酸衍生物Ⅰ、Ⅱ分别与临床上常用抗生素的联合抗菌的作用,结果发现,只有银杏酸C17:1衍生物Ⅱ联用达托霉素抗粪肠球菌具有协同作用,其FICI值为0.125~0.25,说明它具有协同作用,在此基础上,我们又对1株临床的粪肠球菌和5株屎肠球菌进行测定,发现衍生物Ⅱ联合达托霉素只对粪肠球菌有增效作用,对屎肠球菌无增效作用,结果参见表1。
2.3 时间杀菌曲线
与空白对照组相比,4μg/mL浓度的银杏酸C17:1衍生物Ⅱ对细菌的生长没有很大影响。固定用4μg/mL的银杏酸衍生物Ⅱ与不同浓度达托霉素联合使用时,相比较单独使用抗生素,它具有杀菌速度快杀菌效果好等特点,16μg/mL达托霉素作用下的杀菌效果等同于8μg/mL达托霉素和4μg/mL银杏酸C17:1衍生物Ⅱ共同作用,其结果如图2所示。
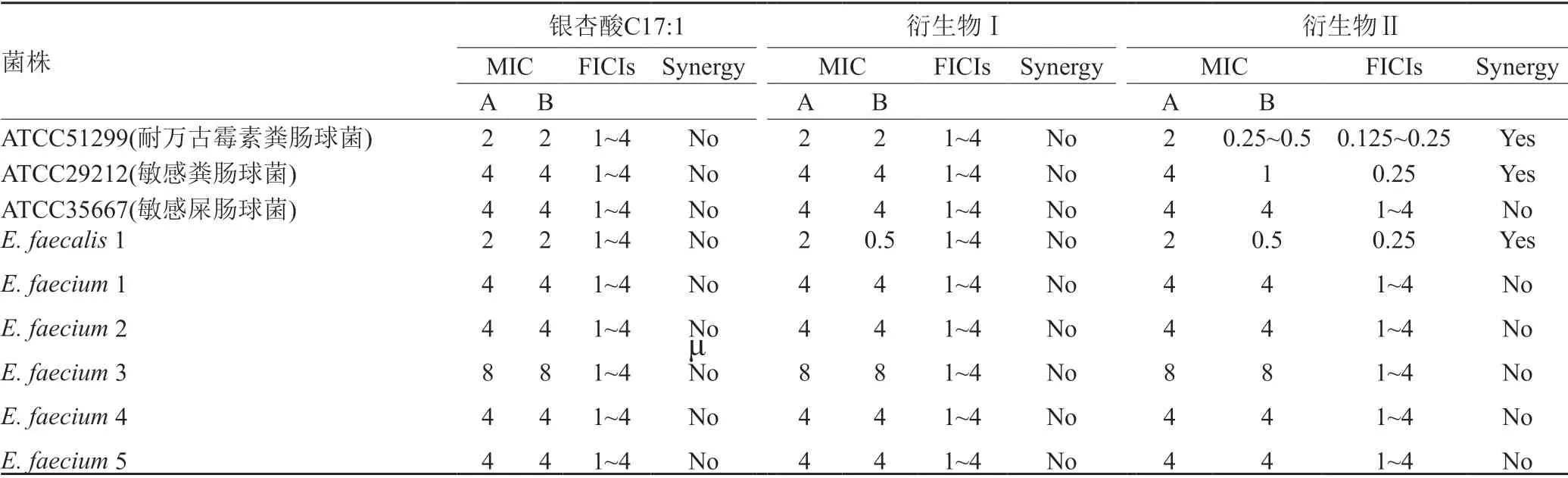
表1 银杏酸C17:1衍生物Ⅰ、Ⅱ联合达托霉素抗肠球菌的部分抑菌浓度指数(FICIs)Tab.1 Fractional inhibitory concentration indices(FICIs) of ginkgolic acid derivatives Ⅰ or Ⅱ combined with antibiotic against VRE
2.4 药物对Zeta电位的影响
一般细菌细胞膜表面电位是负值,当带正电荷的药物与其结合,改变了细菌细胞膜表面电位,从而对细菌的生长产生影响。通过测定单独达托霉素以及它和银杏酸C17:1衍生物Ⅱ共同结合粪肠球菌的表面电位变化,推测其对细菌细胞膜的作用情况。由图3可以看出,耐万古霉素粪肠球菌的表面电位为(-22.3±0.2)mV,4μg/mL浓度衍生物Ⅱ作用于菌体表面电位为(-22.6±0.2)mV,但当4μg/mL浓度衍生物Ⅱ与不同浓度的达托霉素共同作用菌体后的表面电位低于单独达托霉素作用时的电位,这说明衍生物Ⅱ的增效作用可能与其他因素相关。
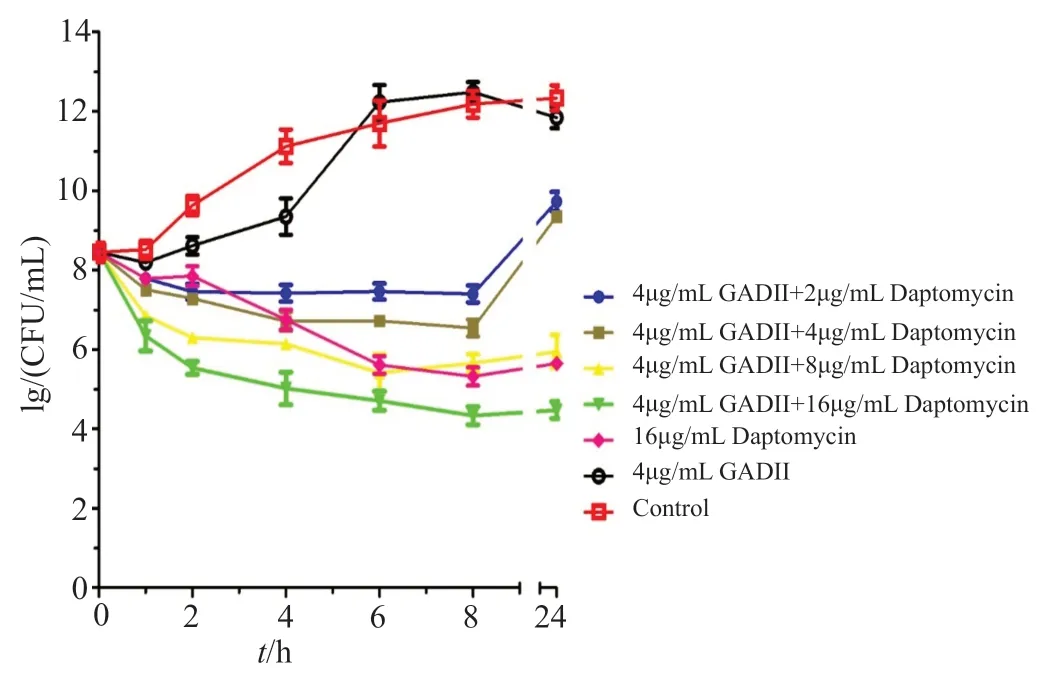
图2 银杏酸C17:1衍生物Ⅱ联合达托霉素对ATCC 51299的时间杀菌曲线Fig.2 Time-kill curve established for daptomycin,ginkgolic acid derivatives Ⅱ and the combination against ATCC 51299
2.5 药物对耐万古霉素粪肠球菌胞内活性氧(ROS)的影响
大量文献调研发现,细菌接触杀菌性抗生素后能够产生活性氧是抗生素杀菌的一个重要的机制,我们的研究发现:达托霉素能够使细菌产生活性氧,且随着浓度的增加而增加,而在相等的浓度下,加入4μg/mL浓度的衍生物Ⅱ,能够显著地增加细菌产生活性氧(图4),推测其与增效作用有关。
2.6 N-苯基-1-萘胺摄取检测
在疏水性的环境下,NPN能够产生很强的荧光,但是在水中它的荧光极低。当药物作用细菌,改变细胞膜的通透性,NPN能够顺利进入到细菌内,其在胞内疏水性环境下能够产生较强的荧光。为此,本文研究了衍生物Ⅱ增效达托霉素抗万古霉素肠球菌的作用,是否与增加细菌细胞的通透性,进而增加胞内抗生素的浓度有关。其结果如5所示 ,不同浓度的达托霉素中分别添加4μg/mL浓度的衍生物Ⅱ时其相对荧光强度显著增加,推测衍生物Ⅱ可能在一定程度上增加了细胞膜的通透性。

图3 银杏酸C17:1衍生物Ⅱ联合达托霉素作用于ATCC51299的Zeta电位的变化Fig.3 The effect of daptomycin,ginkgolic acid derivatives Ⅱ and the combination on zeta potential after treating ATCC 51299

图4 银杏酸C17:1衍生物Ⅱ联合达托霉素作用细菌胞内ROS水平的变化Fig.4 The effect of daptomycin,ginkgolic acid derivatives Ⅱ and the combination on the production of ROS in bacterial cells
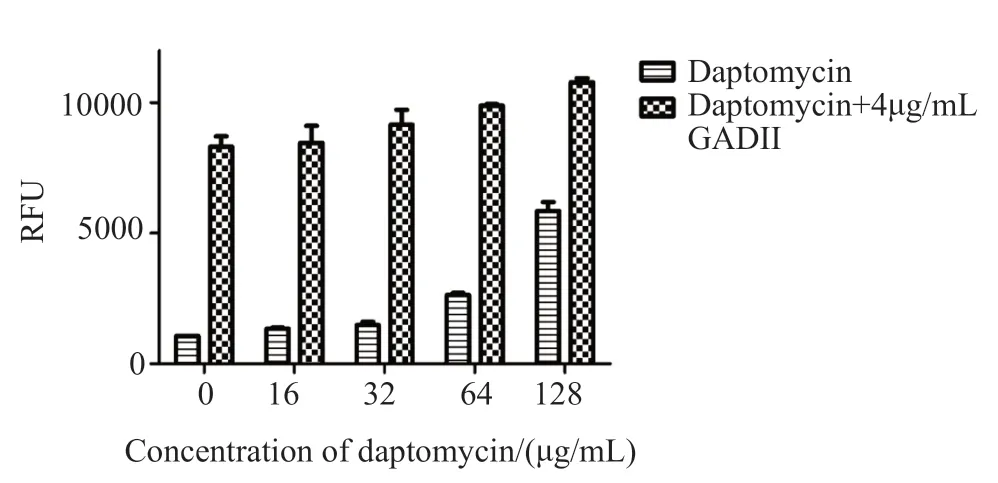
图5 银杏酸C17:1衍生物Ⅱ联合达托霉素作用于ATCC51299后NPN荧光强度的变化Fig.5 The fluorescence intensity of daptomycin,ginkgolic acid derivatives Ⅱ and the combination after treating ATCC51299
3 讨论
抗菌增效剂具有减少抗生素使用量从而减轻药物副作用和不易产生耐药菌株等优点。寻找新型的抗菌增效剂来应对细菌耐药性是有效的方法之一[20]。天然产物来源广泛、种类繁多,是抗菌增效剂的一个宝库[21]。银杏酸含量是银杏制剂的重要控制指标,过量的银杏酸会导致很多不良反应,本文对银杏酸C17:1进行了结构修饰,需要进一步探究其衍生物的毒性作用。银杏酸C17:1衍生物Ⅱ对达托霉素具有很好的增效作用,与其改变了细胞膜的通透性有关。细胞膜通透性的改变是否在一定程度上使得更多的达托霉素透过细胞膜从而杀灭细菌,需要进一步探究。
