双拷贝tylD、tylF和tylJ弗氏链霉菌工程菌株构建及其发酵性能研究
2019-09-02马次郎陈奕公刘晓明王文超朱慧苏建宇
马次郎 陈奕公 刘晓明 王文超 朱慧 苏建宇,*
(1 宁夏大学生命科学学院 西部特色生物资源保护利用教育部重点实验室,银川 750021;2 宁夏泰瑞制药股份有限公司,银川 750101)
泰乐星(tylosin,Tyl)是一类十六元大环内酯类兽用抗生素,其抗菌谱广,在应对革兰阳性菌感染以及畜牧增产方面发挥了巨大作用,被广泛应用于兽药及饲料添加剂。目前,在大规模工业生产中,弗氏链霉菌(Streptomyces fradie)是泰乐菌素的主要生产菌[1-3]。
弗氏链霉菌泰乐菌素生物合成基因簇(tylgene cluster)从抗性基因tlrB延伸至tlrC,共有85kb,含43个ORFs提供泰乐菌素合成所需完整的结构基因[4],分为tylIBA区域,tylLM区域,tylG区域,tylCK区域和tylEDHFJ等5个主要区域[5]。tylJ、tylD和tylF位于tylEDHFJ区域,其中tylJ和分别编码TDP-脱氧己糖3-差向异构酶(TDP-deoxyhexose 3-epimerase)和TDP-脱氧己糖4-酮基还原酶(TDP-deoxyhexose 4-ketoreductase),催化TDP-4-酮基,6-脱氧葡萄糖(TDP-4-keto,6-deoxyglucose)转化为TDP-6-脱氧阿洛糖(TDP-6-deoxyallose)[6]。tylF编码的大菌素-O-甲基转移酶(macrocin-O-methyltransferase,MOMT)催化大菌素转化为泰乐菌素,是泰乐菌素生物合成中的关键限速酶[7]。
泰乐菌素的合成受各种结构基因及多种相关酶调控,除主代谢通路以外,还存在着众多的分支途径[8],在这个过程中会生成多种中间产物和副产物(包括很多未知成分),构成错综复杂的代谢网络[9]。弗氏链霉菌合成泰乐菌素的代谢过程中,O-碳霉氨基糖泰乐内酯(O-mycaminosyltylonolide,OMT)形成后有两条代谢流,一条结合6-脱氧-D-阿洛糖糖基形成去甲基拉克亭霉素,另一条转化为6-脱氧-D-阿洛糖泰乐菌素(demycinosyltylosin,DMT),后者产生更多副产物,影响泰乐菌素的质量。为削弱DMT的合成通路,可选择增加6-脱氧-D-阿洛糖合成路径上的两个关键基因tylJ和tylD的拷贝数,以此来强化OMT到去甲基拉克亭霉素的合成转化。大菌素甲基化转化为泰乐菌素是泰乐菌素合成代谢中的关键限速步骤,增加编码大菌素-O-甲基转移酶的tylF基因拷贝数可提升大菌素的转化速率,在缩短发酵周期的同时提高泰乐菌素发酵水平[10]。综合以上分析,采取倍增tylJ、tylD和tylF基因拷贝数的策略对弗氏链霉菌进行分子改造,能够实现强化泰乐菌素主代谢流,减少发酵过程中副产物生成,提高目的产物产量和质量(纯度)目的,获得具有优良发酵性状的泰乐菌素工程菌株。
1 材料与方法
1.1 菌株与质粒
弗氏链霉菌工业菌株;E.coliDH5α,本实验室保存;E.coliET12567(pUZ8002),中国科学院微生物研究所杨科迁教授惠赠;pSET152质粒,中国农业大学宋源教授惠赠;pTYL02质粒(pSET152衍生质粒,含PermE),本实验保存。
1.2 培养基和主要试剂
1.2.1 培养基
LB培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠10,pH7.0(用于大肠埃希菌培养);高氏一号培养基(购自青海海博生物科技有限公司):用于弗氏链霉菌固体培养;MS培养基(g/L):甘露醇20,黄豆饼粉20,MgCl3·6H2O 4,琼脂粉15,pH7.0(用于大肠埃希菌-弗氏链霉菌属间结合转移培养);TSBY培养基(g/L):酵母提取物5,胰蛋白胨15,大豆蛋白胨5,NaCl 5,pH7.0(用于弗氏链霉菌液体摇瓶发酵)。胰蛋白胨(tryptone)、酵母提取物(yeast extract)购自Oxoid公司;D-甘露醇、琼脂粉、溶菌酶购自Sarloio公司。
1.2.2 抗生素
硫酸安普霉素和萘啶酮酸:购自Sigma公司;泰乐菌素标准品(1026U/mg):购自国家兽药监察所。
1.2.3 工具酶
EcoRI、BamHI、EcoRV购自Fermentas公司。
1.3 目的基因的获得
根据插入片段的碱基序列使用引物设计软件Primer Premier 6分别设计PermE、tylF-tylJ、tylD的引物,其中在PermE的上下游引物两端分别引入酶切位点EcoRI和BamHI,在tylF-tylJ的上下游引物两端分别引入酶切位点BamHI和EcoRV,在引物tylD的上下游引物两端引入酶切位点EcoRV,并在tylFtylJ、tylD的上游引物上分别添加了核糖体结合位点(ribosomal binding site,RBS)(表1)。分别以pTYL02质粒DNA和弗氏链霉菌基因组DNA为模板,PCR扩增获得所需目的基因片段。
1.4 表达载体的构建
首先将PermE基因片段与载体pSET152连接,得到重组质粒pSET152-PermE,对其进行EcoRV与BamHI双酶切,然后将tylF-tylJ基因片段与重组质粒pSET152-PermE连接,得到重组质粒pSET152-PermE-tylF-tylJ,然后对其进行EcoR V单酶切。为防止发生载体自连,单酶切回收后的载体用去磷酸化酶进行处理,然后与tylD基因片段连接,构建重组质粒pSET152-PermE-tylF-tylJ-tylD(图1)。
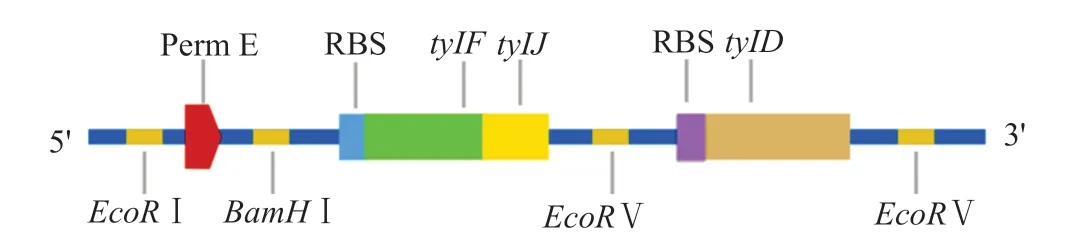
图1 pSET152-PermE-tylF-tylJ-tylD结构Fig.1 Structure of pSET152-PermE-tylF-tylJ-tylD
重组质粒导入感受态E.coliET12567中,涂布 LB抗性平板(含卡那霉素50μg/mL、安普霉素50μg/mL),37℃过夜培养,挑选单菌落接入新鲜LB培养液中,37℃过夜培养后,提取其质粒,使用表1中引物进行PCR验证和酶切验证。
1.5 表达载体的结合转移及重组菌株的筛选
重组质粒pSET152-PermE-tylF-tylJ-tylD转化感受态E.coliET12567菌株,涂布LB抗性平板(含卡那霉素50μg/mL、安普霉素50μg/mL)进行阳性转化子筛选。筛选的阳性转化子接入新鲜LB培养液中,37℃过夜培养后提取质粒,进行PCR验证和酶切验证。验证后的重组E.coliET12567菌株与弗氏链霉菌的预萌发孢子液(受体菌)混合涂布在MS培养基平板上,通过大肠埃希菌-链霉菌属间接合转移,将pSET152-PermE-tylF-tylJ-tylD转入弗氏链霉菌出发菌株内,得到弗氏链霉工程菌株FJD。
1.6 弗氏链霉菌工程菌株验证
随机选取30个工程菌株单菌落,分别接种至发酵培养基中,以出发菌株为对照,28℃、200r/min摇瓶发酵7d,测定发酵液泰乐菌素效价。
工程菌株FJD接入发酵培养基中,28℃、200r/min摇瓶发酵48h,取样,以15%接种量接入新的培养基中传代培养。连续传代10代后,收集菌体,提取基因组DNA,卡那霉素和安普霉素抗性验证工程菌株质粒稳定性。
1.7 工程菌株tylD、tylF、tylJ基因表达分析
以rpoB作为内参基因,采用ΔΔCT值法[11],对工程菌株tylD、tylF、tylJ基因相对于出发菌株对应基因的表达量进行qPCR分析。
1.8 泰乐菌素效价测定
1.8.1 标准曲线制备
称取泰乐菌素标准品,用去离子水配制400、500、600和700μg/mL的泰乐菌素标准品溶液;分别吸取不同浓度的标准品溶液1mL于25mL容量瓶中,加入0.1mol/L HCl定容,得到12、16、20、24和28μg/mL的泰乐菌素标准液,往复颠倒摇匀静置;290nm下测定标准液吸光度A值(0.1mol/L HCl为参比),以标准液浓度为纵坐标,A值为横坐标,绘制泰乐菌素标准曲线(图2)。
1.8.2 发酵液泰乐菌素效价测定
取50mL发酵液,加入2mL 20% Al2(SO4)3溶液进行絮凝,过滤;取过滤液,根据预估效价对滤液进行适当稀释;吸取1mL稀释液于25mL容量瓶内,加入0.1mol/L HCl定容,往复颠倒混匀;290nm下测A值(0.1mol/L HCl为参比),根据标准曲线表结合稀释倍数计算发酵液中泰乐菌素含量。
泰乐菌素效价(U/mL)=测试样品泰乐菌素含量(μg/mL)×1.026,式中1.026为根据泰乐菌素标准品确定的效价/质量换算系数。
2 结果与分析
2.1 表达载体的构建
重组质粒经PCR和酶切验证,分别得到了与预期大小一致的tylF~tylJ片段(1434bp)和tylD(1026bp)片段,表明重组质粒pSET152-PermE-tylF-tylJ-tylD构建成功(图3)。
2.2 弗氏链霉菌FJD工程菌株泰乐菌素发酵效价
出发菌株与30株工程菌株泰乐菌素摇瓶发酵效价见表2。结果表明,随机选取的30株工程菌中,20株泰乐菌素发酵效价高于出发菌株,其中最高的1株发酵效价较出发菌株提高了28.1%,具有良好的生产应用价值。
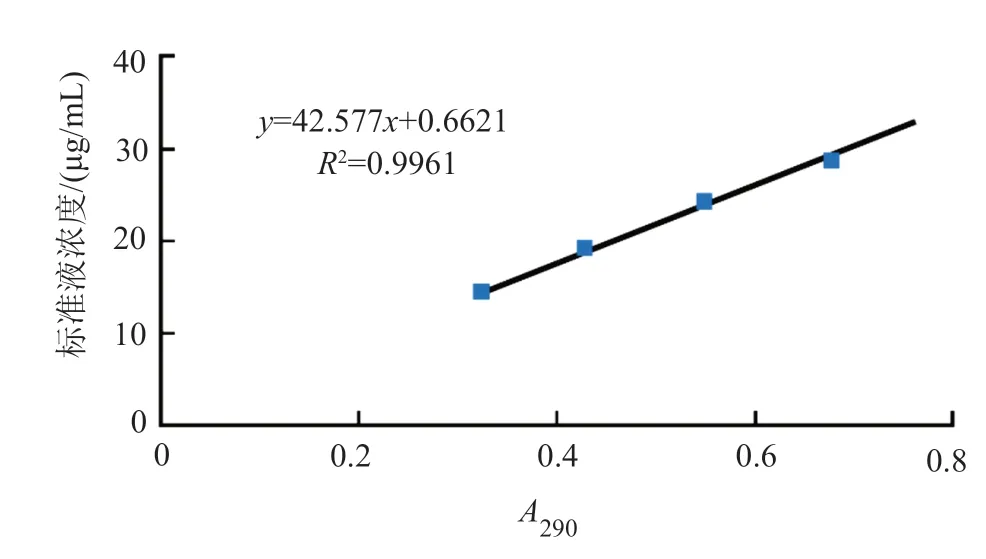
图2 泰乐菌素标准曲线Fig.2 Standard curve of tylosin

图3 重组质粒pSET152-PermE-tylF-tylJ-tylD鉴定Fig.3 Identification of recombinant plasmid pSET152-PermEtylF-tylJ-tylD

表2 30株工程菌与出发菌株摇瓶发酵效价Tab.2 Shaking flask fermentation potency of 20 engineering strains and initial strain
2.3 工程菌株的稳定性
pSET152质粒不含链霉菌复制起始位点。重组质粒pSET152-PermE-tylF-tylJ-tylD通过大肠埃希菌-链霉菌属间接合转移至弗氏链霉菌后,如没有整合到染色体上,将不能在弗氏链霉菌中复制,从而在菌体生长过程中丢失,工程菌也因此丧失质粒所携带的卡那霉素和安普霉素抗性。 以摇瓶效价最高的1株工程菌株为供试菌株,发酵培养基中连续传代10次后,工程菌在安普霉素抗性平板上生长良好,与对照的无抗生素平板上生长状态没有差异,表明重组质粒已经稳定的整合在弗氏链霉菌染色体上。
2.4 工程菌株tylD、tylF、tylJ基因表达分析
将工程菌株目的基因CT值用对应的内参基因rpoB的CT值进行标准化处理,采用ΔΔCT法计算tylD、tylF和tylJ在弗氏链霉菌出发菌株中的相对表达,并以出发菌株中相应目的基因的表达水平为参照,计算工程菌中tylD、tylF和tylJ的相对表达情况,结果如图4~6。
在168h的发酵周期中,工程菌tylD的表达较出发菌株均有提高,其中24h时工程菌tylD的表达水平为出发菌株的1.26倍,72h时达到出发菌株的2倍,并一直保持较高的表达水平。
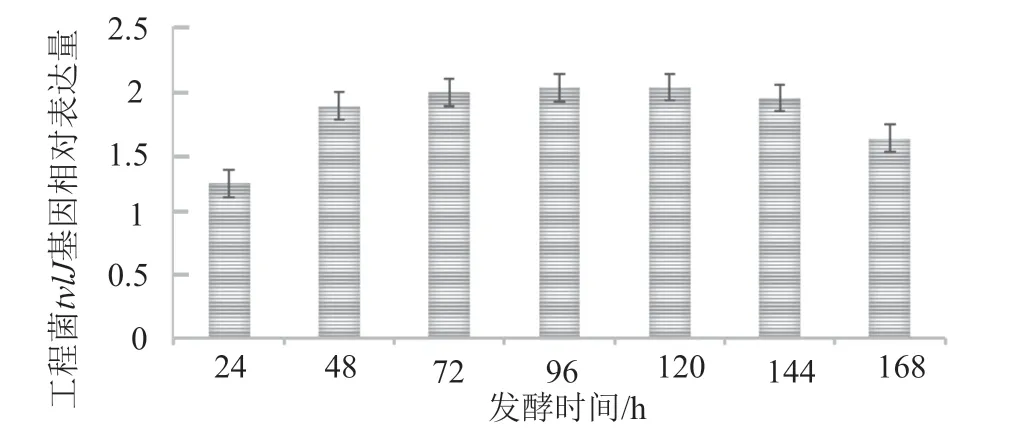
图4 工程菌株tylD基因相对于出发菌株的表达量Fig.4 Expression of tylD gene of engineering strain relative to that of initial strain

图5 工程菌株tylF基因相对于出发菌株的表达量Fig.5 Expression of tylF gene of engineering strain relative to that of initial strain
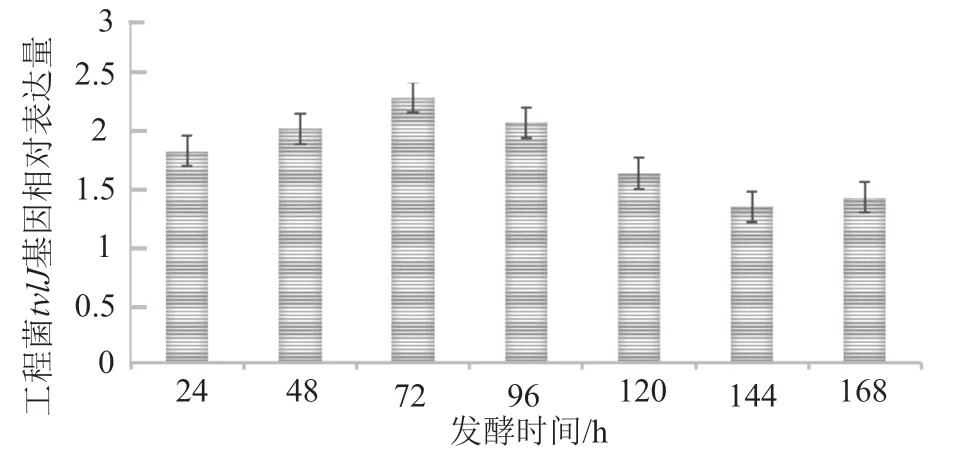
图6 工程菌株tylJ基因相对于出发菌株的表达量Fig.6 Expression of tylJ gene of engineering strain relative to that of initial strain
发酵24h时tylF表达量与出发菌株一致(相对表达量为1),发酵48h时tylF相对表达量开始升高,至96h时达到最高水平,约为出发菌株的2.18倍,并在之后发酵过程中始终保持较高的表达量。
整个发酵过程中工程菌tylJ的表达量始终高于出发菌株,其中发酵前期工程菌tylJ基因表达量显著高于出发菌株,72h时其表达量达到出发菌株的2.3倍,其后该基因的相对表达量逐渐下降,至发酵144h时,工程菌tylJ表达量保持在出发菌株表达量的1.4倍左右(表3)。
qPCR分析结果表明,转入的tylD、tylF和tylJ基因在弗氏链霉菌中均得到有效的表达,工程菌中上述3个基因的表达水平均高于出发菌株。
3 讨论
增加合成代谢途径中关键酶基因的拷贝数是链霉菌代谢工程育种的有效手段[12]。范亮等[13]构建了具有双拷贝tylF基因的泰乐菌素基因工程菌,其泰乐菌素摇瓶发酵效价较出发菌提高了32.7%。由于泰乐菌素合成代谢网络的复杂性,增加tylF的拷贝数能降低发酵产物中中间代谢产物大菌素的含量,提高泰乐菌素的产量,但无法降低DMT等发酵副产物(杂质)的积累。本研究针对泰乐菌素生产中组分转化及主要副产物产生情况,在对弗氏链霉菌泰乐菌素代谢调控网络分析的基础上,选择碳霉糖合成路径上的两个关键基因tylD与tylJ以及泰乐菌素合成途径中关键的限速酶基因tylF,构建具有双拷贝tylD、tylJ和tylF的弗氏链霉菌工程菌株,以达到调整并强化泰乐菌素的主合成代谢通路,提高抗生素产量,减少DMT等发酵副产物的目的。
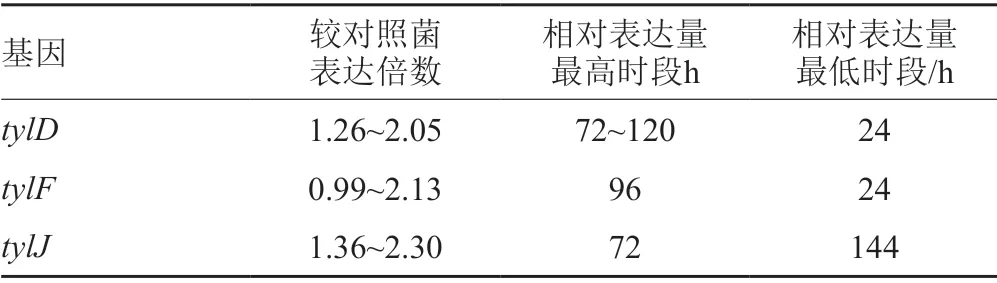
表3 发酵过程中工程菌株tylD、tylF和tylJ基因表达特性Tab.3 Expression characteristics of tylD,tylF and tylJ in engineering strains during fermentation
在工业生产链霉菌工程菌株的构建中,整合型质粒的运用以及最适启动子和核糖体结合位点的调节对链霉菌合成目的产物有极大的促进作用[14-17]。本研究以弗氏链霉菌基因组DNA为模版,克隆得到目的基因tylD和tylF-tylJ;使用整合型表达载体pSET152和组成型强启动子PermE,保证发酵过程中工程菌的稳定性,强化多拷贝的tylF、tylJ以及tylD的表达;tylF、tylJ采用自身RBS序列,tylD自身的RBS位于tylHII内,其序列经分析不符合最佳的RBS碱基排列,而tylHII的RBS序列满足理想RBS碱基排列的条件,因此将tylHII的RBS序列与tylD的CDS序列衔接,调转插入整合型质粒中。采用上述构建策略,最终得到一株弗氏链霉菌工程菌株,其发酵效价较出发菌株提高了28.1%,经荧光定量PCR检测,该菌株发酵过程中tylF、tylJ、tylD表达量较出发菌株有明显提高,可望作为优良生产菌种用于泰乐菌素的发酵生产。
