乳糖酶凝胶微球的制备及在模拟胃液中的稳定性
2019-08-12陈丽叶宋洪波安凤平王艺伟
陈丽叶 宋洪波 安凤平* 王艺伟 黄 群 滕 慧
(1福建农林大学食品科学学院 福州 350002
2福建省产品质量检验研究院 福州 350002)
乳糖不耐症(lactose intolerance,LI)是世界性问题,影响着世界三分之二的人口,其中亚洲患病率高达95%,尤其是青少年[1]。随着人类的生长发育,会出现体内乳糖酶活性不断减弱的现象[2]。乳糖不耐症还会引起一系列的健康问题,包括肠胃不适、腹胀、腹泻、腹绞痛、恶心、呕吐等不良症状[3]。针对这一人群可在食用乳制品前服用含乳糖酶胶囊、乳糖酶片等促进乳糖在胃、肠道内水解来弥补乳糖不耐症所带来的问题。然而,乳糖酶很容易受到胃液的影响而失活,在肠道难以很好地发挥作用。
凝胶微球因对活性成分的包埋、保护作用而被广泛应用在食品、医药和个人护理用品等行业,主要制备方法有注射凝胶法、复凝聚法和热力学不相容法等[4-5]。李妍昕等[6]以海藻酸钠和壳聚糖作为载体,制备乳糖酶肠溶微胶囊具有很好的过胃保护作用,酶存活率达81.9%。Briones等[7]以壳聚糖和卡拉胶作为载体材料,研究葡萄糖氧化酶控释传递,在胃蛋白酶溶液环境中可以保留酶活性66.4%。然而,壳聚糖需要在酸性条件下才能完全溶解,在制备过程中造成活性成分的损失;而且随着壳聚糖浓度的增加,会明显增大硬化剂黏度,降低对活性成分的包埋率[8-9]。
本研究以海藻酸钠和κ-卡拉胶为包埋剂,氯化钙和ε-聚赖氨酸为硬化剂,以离子交联法与复凝聚法相结合制备载乳糖酶凝胶微球,使乳糖酶在胃液中少被破坏,为进一步研究其在肠环境中的释放以及针对乳糖不耐症人群的食品开发奠定基础。
1 材料与方法
1.1 材料与试剂
乳糖酶(β-半乳糖苷酶),食品级,广西南宁庞博生物工程有限公司;ε-聚赖氨酸,食品级,郑州拜纳生物工程股份有限公司;κ-卡拉胶 (纯度≥99.5%)、海藻酸钠(纯度≥99.5%)、邻硝基苯酚-β-D-半乳糖苷(ONPG)(超纯级)、考马斯亮蓝(G-250)(超纯级),北京索莱宝科技有限公司;其它试剂均为分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
Sartorius普及型pH计,合肥桥斯仪器设备有限公司;UV-1100紫外-可见分光光度计,上海美谱达仪器有限公司;Sartorius BSA124S电子天平,赛多利斯科学仪器(北京)有限公司;5 mL注射器(配针规格:0.7 mm×31 mm TWLB),湖南平安医械科技有限公司;RH digital磁力搅拌器,德国IKA公司;KQ5200DE数控超声波清洗器,昆山市超声仪器有限公司;NSKY200B恒温振荡器,上海苏坤实业有限公司;Allegra X-30R冷冻离心机,美国贝克曼库尔特有限公司;SHZ-III循环水真空泵,上海亚荣生化仪器厂;HH-4数显恒温水浴锅,国华电器有限公司。
1.3 方法
1.3.1 复配胶液的制备 称取一定量的κ-卡拉胶、海藻酸钠(精确到0.001 g)分散到蒸馏水中,80℃水浴30 min,使其完全溶解;室温下采用磁力搅拌器以1 000 r/min搅拌30 min使之混合均匀;超声脱气15 min,制得复配胶液;将质量分数为4%乳糖酶液按复配胶液∶酶液体积比为3∶1制得载酶复配胶液,备用。
1.3.2 乳糖酶胶球的制备 采用注射凝胶法(injection/gelation methods)制备凝胶微球[10-11]。 使用注射器取5 mL上述载酶复配胶液,保持注射器下端边缘与硬化剂溶液液面间的距离为15 cm,以每2s 1滴的速度滴入10 mL硬化剂(氯化钙-ε-聚赖氨酸)溶液中,持续搅拌 30 min,真空抽滤后,用蒸馏水清洗微球3遍,洗去表面的硬化剂,真空抽滤。将微球依次倒入一定浓度的κ-卡拉胶胶液和ε-聚赖氨酸溶液中,分别浸泡15 min,涂液后用蒸馏水冲洗3遍,真空抽滤10 min,制得乳糖酶凝胶微球。
1.3.3 乳糖酶包埋率的测定 参照文献[7]、[12]方法,将0.1 g凝胶微球浸泡在20 mL蒸馏水中,37℃处理12 h,然后将其研磨碎;将溶液加热到40℃,水浴保持3 h,使乳糖酶完全从聚合物网络中释放出来;用高速离心机以10 000 r/min室温(20℃)离心10 min。取上清液,按照考马斯亮蓝法(Bradford method)[13]测定蛋白质含量。以牛血清蛋白为标准蛋白,通过试验得到标准曲线:y1=7.7481x1+0.0379【式中y1和x1分别代表波长595 nm处的吸光度值和牛血清蛋白质量浓度(mg/mL)】,相关系数R2=0.9924,线性范围为0~0.1 mg/mL。所有试验均重复3遍。乳糖酶包埋率计算公式:

式中:EE——包埋率,%;C0——理论蛋白质含量,即直接测定载乳糖酶胶液的蛋白质含量,mg;Cr——实际蛋白质含量,即载酶凝胶微球中蛋白质含量—未载酶凝胶微球中蛋白质含量,mg。
1.3.4 乳糖酶存活率的测定
1)将0.1 g凝胶微球转移到20 mL人工模拟胃液[14](pH3 盐酸缓冲液)中,37℃处理 2 h,过滤后清洗3次;2)转移到20 mL蒸馏水中,37℃处理12 h;3)使用研钵将其研磨碎,将溶液加热到40℃水浴保持3 h,使乳糖酶完全从聚合物网络中释放出来;4)使用高速离心机以10 000 r/min室温(20℃)离心10 min。取上清液,按Talbert的方法[15]测定酶活性OD1,U/g;另取相同质量的微球直接置于蒸馏水中,同步骤 2)~4)处理后,取上清液,测定乳糖酶活性OD2,U/g,其结果作为初始酶活性100%。参照文献[16]方法,通过试验得到邻硝基苯酚(ONP)标准曲线:y2=4.6943x2+0.0033【式中 y2和x2分别代表波长420 nm处吸光度值和ONP浓度(mmol/L)】,相关系数 R2=0.9999,线性范围 0~0.15 mmol/L。所有试验均重复3遍。乳糖酶存活率计算公式:

1.3.5 单因素试验 采用复配胶的比例为海藻酸钠∶卡拉胶=8∶2[17]、0.2% ε-聚赖氨酸和 0.15 mol/L CaCl2的混合溶液为硬化剂,以1.5% κ-卡拉胶溶液和0.2% ε-聚赖氨酸依次涂液2次为 “基本操作”,分别考察 1.0%,1.5%,2.0%,2.5%,3.0%复配胶总质量分数对乳糖酶包埋率和存活率的影响。采用2.5%复配胶,其余条件与“基本操作”中相同,分别考察 0%,0.1%,0.2%,0.5%,0.8%和 1.0%ε-聚赖氨酸对乳糖酶包埋率和存活率的影响。采用0.8% ε-聚赖氨酸、2.5%复配胶,其余条件与“基本操作”中相同,分别考察 0.05,0.1,0.15,0.2,0.3 mol/L和0.4 mol/L CaCl2对制备载酶凝胶微球效果的影响。采用0.8% ε-聚赖氨酸、2.5%复配胶,其余条件与“基本操作”中相同,分别考察0.1%,0.5%,1%,1.5%,2.0%和 2.5% κ-卡拉胶涂液对制备载酶凝胶微球的影响。
1.3.6 Box-Benhnken中心组合试验设计 为了评估各项因素对胶球保护乳糖酶性能的效果,在单因素试验的基础上,采用三因素三水平的响应面试验设计,以乳糖酶存活率为响应值,各因素及水平设计见表1。

表1 因素与水平Table1 Factors and levels
1.3.7 数据处理 单因素方差分析采用SPSS19.0软件,单因素各处理间的差异分析比较采用Duncan新复极差法,绘图使用Origin9.0软件,响应面的方差分析采用Design-Expert 8.0.6软件。
2 结果与分析
2.1 单因素试验
2.1.1 复配胶总质量分数对乳糖酶包埋率和存活率的影响 由图1可知,在复配胶总质量分数为1.0%~2.5%范围,随着复配胶总质量分数的增加,乳糖酶包埋率和存活率均呈明显增加;继续增加复配胶总质量分数,包埋率下降,而乳糖酶存活率变化不大。这是因为复配胶总质量分数对凝胶微球的成型影响很大,复配胶浓度较低时,凝胶微球中分子之间间距比较大,所形成的凝胶微球较为松弛,机械强度较差,在洗球过程中容易造成乳糖酶的流失,使得包埋率较低[17]。随着复配胶总质量分数的增加,形成的凝胶微球变得结实,能较好地保护乳糖酶,使人工模拟胃液处理过的凝胶微球中乳糖酶存活率增大;之后随着复配胶总质量分数的继续增加(至3.0%),保护作用达到极限,然而胶液黏度过大,造成下滴速度慢,所形成的凝胶微球变小,造成包埋率的略微减小[18],乳糖酶存活率也有所减小。最终选择复配胶总质量分数范围2.0%~3.0%。
2.1.2 ε-聚赖氨酸质量分数对乳糖酶包埋率和存活率的影响 由图2可知,随着ε-聚赖氨酸质量分数的增加,乳糖酶包埋率和存活率均呈上升的趋势。在ε-聚赖氨酸质量分数大于0.2%时,包埋率基本不变;在ε-聚赖氨酸质量分数大于0.8%时,乳糖酶存活率基本不变。这是因为ε-聚赖氨酸的用量影响乳糖酶凝胶微球的形态及机械强度。ε-聚赖氨酸是一种天然的阳离子聚合物,能与阴离子线性多糖海藻酸钠和卡拉胶发生很强作用,在凝胶微球表面形成一层膜,从而提高了其包埋效率,同时这层膜也保护了包埋的乳糖酶免受酸的破坏,使乳糖酶存活率增加[19]。当ε-聚赖氨酸浓度达到一定值时,与阴离子多糖电荷中和,使两者间相互作用达到饱和[20]。当ε-聚赖氨酸浓度增大到一定值后,乳糖酶包埋率和存活率变化不大。在后续的工艺优化中,选择ε-聚赖氨酸质量分数范围为0.2%~0.8%。
2.1.3 CaCl2浓度对乳糖酶包埋率和存活率的影响 由图3可知,一方面,CaCl2浓度在0.05~0.3 mol/L范围对乳糖酶存活率的影响不大,继续增大CaCl2浓度,乳糖酶存活率下降,这是因为高浓度的CaCl2与海藻酸钠和卡拉胶快速交联,使凝胶微球表面变脆、易破裂,导致人工模拟胃液渗入,破坏乳糖酶活性[21-22]。另一方面,随着CaCl2浓度的增大,包埋率显著提高;当CaCl2浓度达到0.15 mol/L时包埋率达到最大值;进一步增大CaCl2浓度,包埋率呈下降的趋势。这是因为增大CaCl2浓度,使聚合物的骨架缝隙增多,有利于包埋乳糖酶;CaCl2浓度过大时,由于钙离子与阴离子多糖快速交联,仅在凝胶微球表面形成质地坚硬、脆的表层,阻止了钙离子进一步向内部扩散,使凝胶微球内部结构不均匀,从而无法充分包埋乳糖酶,使包埋率下降[23]。由于CaCl2浓度对乳糖酶存活率影响较小,且当CaCl2浓度为0.15 mol/L时包埋率很大,因此后续的工艺优化中固定CaCl2浓度为0.15 mol/L。

图1 复配胶总质量分数对乳糖酶包埋率和存活率的影响Fig.1 Effect of complex gel mass fraction on the entrapment efficiency and survival rate for lactase

图3 CaCl2浓度对乳糖酶包埋率和存活率的影响Fig.3 Effect of CaCl2concentration on the entrapment efficiency and survival rate for lactase
2.1.4 κ-卡拉胶涂液质量分数对乳糖酶包埋率和存活率的影响 由图4可知,在0%~0.5%涂液质量分数范围,包埋率随涂液质量分数的增大而增大;继续增大涂液质量分数至2.0%时,包埋率变化不大;当涂液质量分数大于2.0%时,包埋率明显下降。这是因为当涂液质量分数大于2.0%时,许多凝胶微球粘在一起且球的表面不能形成均匀的膜,在后续清洗过程中,凝胶微球分离,表面进一步被破坏,导致包埋率显著下降。另外,随着涂液浓度的增大,乳糖酶存活率提高,当涂液质量分数为1.5%时乳糖酶存活率达到最大值,继续增大涂液质量分数,乳糖酶存活率下降。这是因为κ-卡拉胶浓度较低时,所形成的涂液膜厚度小,保护乳糖酶活性能力较差;而κ-卡拉胶浓度过大时,由于其胶液呈弱碱性,对乳糖酶活性造成一定的影响,从而使乳糖酶存活率降低[22]。涂液除了具有保护酶活之外,还起到一定的缓释作用[24]。经综合考虑,选1.0%~2.0%κ-卡拉胶溶液为后续工艺的涂液质量分数范围。

图2 ε-聚赖氨酸质量分数对乳糖酶包埋率和存活率的影响Fig.2 Effect of ε-polylysine mass fraction on the entrapment efficiency and survival rate for lactase

图4 κ-卡拉胶涂液质量分数对乳糖酶包埋率和存活率的影响Fig.4 Effect of κ-carrageenan coating mass fraction on the entrapment efficiency and survival rate for lactase
2.2 响应面试验结果
2.2.1 响应面试验设计及结果 本优化的目是获得凝胶微球经模拟胃液处理后乳糖酶存活率最高的工艺条件。从单因素试验结果可知,因素A(复配胶总质量分数)和B(ε-聚赖氨酸质量分数)对乳糖酶存活率和包埋率的影响趋势类似,因素C(κ-卡拉胶涂液质量分数)在1.0%~2.0%范围对包埋率影响不大且可保持高的包埋率。以乳糖酶存活率为考察指标。采用Box-Behnken设计方法优化载乳糖酶凝胶微球的制备条件,试验设计方案及结果见表2。

表2 Box-Behnken试验设计及结果Table2 Box-Behnken experimental design and results
2.2.2 二次回归模型的建立及分析 利用Design-Expert 8.0.6对表2的结果进行统计分析,建立载乳糖酶凝胶微球的乳糖酶存活率与3个变量的二次多项回归模型:
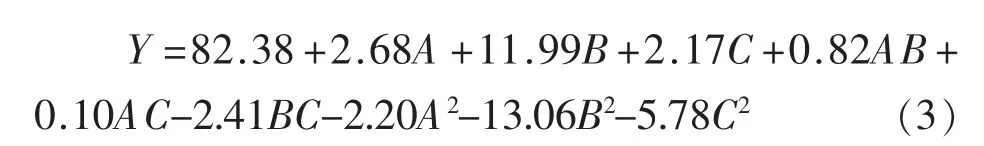
对回归模型进行方差分析,结果见表3。

表3 回归模型方差分析表Table3 Variance analysis for the fitted regression model
由表3可知,模型P值<0.0001,表明该模型差异极显著;失拟项P值为0.0884,大于0.05,表明失拟项不显著。模型的决定系数R2=0.9961,说明模型响应值变化的99.61%来源于所选变量,试验所产生的误差较小;模型的噪音比为42.367,大于4,表明此回归模型与试验数据拟合程度和可信度较高。该模型可用来预测载乳糖酶凝胶微球经过人工模拟胃液处理后乳糖酶存活率的变化情况。
由方差分析结果可知,各因素对乳糖酶存活率的影响顺序为:B(ε-聚赖氨酸质量分数)>C(κ-卡拉胶涂液质量分数)>A (复配胶总质量分数);各因素的一次项和二次项均对乳糖酶存活率的影响极显著,ε-聚赖氨酸质量分数和κ-卡拉胶涂液质量分数的交互作用对乳糖酶存活率的影响显著。各因素对响应值的影响不是简单的线性关系,可利用该回归方程确定最佳工艺条件。
2.2.3 各因素交互作用对乳糖酶存活率的响应面分析 图5是为κ-卡拉胶涂液质量分数固定为1.5%时,复配胶总质量分数和ε-聚赖氨酸质量分数对乳糖酶存活率影响的响应面图和等高线图。由图5可得,乳糖酶存活率随着ε-聚赖氨酸质量分数的增加而提高,当ε-聚赖氨酸质量分数增加到一定值后,乳糖酶存活率微有下降;在低ε-聚赖氨酸质量分数区,增大复配胶总质量分数对乳糖酶存活率的增大作用不显著,当ε-聚赖氨酸质量分数大于0.5%时,增大复配胶总质量分数对提高乳糖酶存活率作用较为显著。
图6是在ε-聚赖氨酸质量分数固定为0.5%时,κ-卡拉胶涂液质量分数和复配胶总质量分数对乳糖酶存活率影响的响应面图和等高线图。随着κ-卡拉胶涂液质量分数的增大,乳糖酶存活率提高,当κ-卡拉胶涂液质量分数达到一定区域时,乳糖酶存活率变化平缓,随后降低;在低质量分数κ-卡拉胶涂液区,乳糖酶存活率随着复配胶总质量分数的增加而增加,在高质量分数κ-卡拉胶涂液区,乳糖酶存活率也呈增大趋势,变化较缓慢。
图7是复配胶总质量分数固定为2.5%时,κ-卡拉胶涂液质量分数和ε-聚赖氨酸质量分数对乳糖酶存活率影响的响应面图和等高线图。ε-聚赖氨酸质量分数和κ-卡拉胶涂液质量分数具有较明显的交互作用。在低ε-聚赖氨酸浓度区,随着κ-卡拉胶涂液质量分数的增大,乳糖酶存活率提高;在高质量分数ε-聚赖氨酸区,随着κ-卡拉胶涂液质量分数的增大,乳糖酶存活率提高较缓慢。在低或高质量分数卡拉胶涂液区,随着ε-聚赖氨酸质量分数的增加,乳糖酶存活率先提高后逐渐降低;在中等质量分数κ-卡拉胶涂液区,乳糖酶存活率随着ε-聚赖氨酸浓度的升高先迅速增大后趋于平缓。

图5 因素A和B交互作用对胶球中乳糖酶存活率影响的响应面图和等高线图Fig.5 Respones surfaces and contour plots of the interactive effects of factor A and B on the lactase survival rate in gel beads
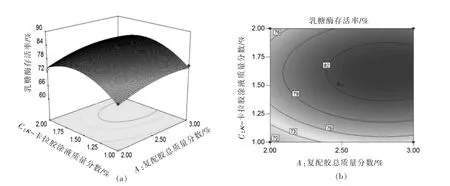
图6 因素A和C交互作用对胶球中乳糖酶存活率影响的响应面图和等高线图Fig.6 Respones surfaces and contour plots of the interactive effects of factor A and C on the lactase survival rate in gel beads

图7 因素B和C交互作用对胶球中乳糖酶存活率影响的响应面图和等高线图Fig.7 Respones surfaces and contour plots of the interactive effects of factor B and C on the lactase survival rate in gel beads
2.2.4 验证试验 以乳糖酶存活率最高为优化目标,利用Design-Expert 8.0.6软件对回归模型(3)进行求解,得到优化的制备工艺为:复配胶总质量分数2.85%、ε-聚赖氨酸质量分数0.64%、κ-卡拉胶涂液质量分数1.57%,在此条件下乳糖酶存活率理论预测值为86.32%。为了方便操作,将最佳工艺修订为复配胶总质量分数2.8%、ε-聚赖氨酸质量分数0.6%、κ-卡拉胶涂液质量分数1.5%,3次重复试验所得乳糖酶存活率平均值为(85.48±0.54)%,与理论预测值相差0.84%。在优化条件下制备的载酶微球的乳糖酶包埋率为(90.61±2.58)%,说明优化的条件合理、可靠。
2.3 在体外模拟胃液中的稳定性评价
在正常情况下人胃的pH 1.0~4.0,空腹时胃腔环境的pH1.0-1.8,而饭后其pH一般为3.0~4.0[25-26]。依照类似文献研究载益生菌凝胶微球在模拟胃液中2h内的益生菌存活率变化来设计试验[27-28]。按照1.3.4节方法,采用优化工艺制备的乳糖酶凝胶微球,在pH值分别为1.2,2.0,3.0和4.0的模拟胃液中处理2 h,乳糖酶存活率的变化情况如图8所示。随着处理时间的延长,乳糖酶活性降低;当pH值越小,乳糖酶失活越快,至2 h时乳糖酶存活率分别为 11.18%,48.27%,85.48%和94.59%,表明在空腹情况下乳糖酶存活率很低,乳糖酶存活率达 (85.48%±0.54)%,包埋率为(90.61±2.58)%。

图8 优化后的凝胶微球在模拟胃液中的稳定性Fig.8 Stability of gel beads in simulated gastric environment after the process optimization
3)乳糖酶凝胶微球在体外模拟胃液中的存活率试验表明,在空腹条件下仅能保留10%~50%的乳糖酶活性;而在饭后胃环境中,乳糖酶存活率达85%以上,具有良好的过胃保护作用。
3 结论
采用钙离子与海藻酸钠和κ-卡拉胶的离子交联以及ε-聚赖氨酸的复凝聚作用形成凝胶微球,再利用κ-卡拉胶涂液和ε-聚赖氨酸涂液的复凝聚作用形成表层坚韧的壁膜,不仅有效包裹乳糖酶溶胶,而且能阻挡氢离子向凝胶微球内部扩散,减缓胃酸对乳糖酶的破坏,从而为研究凝胶微球在肠环境中释放,发挥乳糖酶的生物学功能提供依据。
1)通过响应面分析法建立复配胶 (m海藻酸钠∶m卡拉胶=8∶2)总质量分数、ε-聚赖氨酸质量分数和κ-卡拉胶涂液质量分数对制备凝胶微球中乳糖酶存活率关系的数学模型,相关系数R2=0.9961,失拟项不显著,该模型能很好地预测乳糖酶存活率与各因素的关系。
2)ε-聚赖氨酸质量分数对载酶凝胶微球的乳糖酶存活率的影响最大,其次为κ-卡拉胶涂液质量分数的影响,复配胶总质量分数的影响最小。这3个因素的一次项和二次项均对乳糖酶存活率的影响极显著,ε-聚赖氨酸质量分数和κ-卡拉胶涂液质量分数的交互作用对乳糖酶存活率的影响显著。优化的乳糖酶凝胶微球的最佳制备工艺为:复配胶总质量分数2.8%、ε-聚赖氨酸质量分数0.6%、κ-卡拉胶涂液质量分数1.5%,在此条件下在肠道难以充分发挥作用;而在饭后pH3~4时还能保持85%以上的乳糖酶活性,为在肠道中发挥作用奠定基础。
