金银花黄酮对过氧化氢诱导RAW264.7巨噬细胞损伤的保护作用
2019-08-12张冰洁韦倩倩樊金玲马丽苹关宁宁朱文学
罗 磊 张冰洁 韦倩倩 樊金玲 马丽苹 关宁宁 朱文学
(河南科技大学食品与生物工程学院 河南省农产品干燥装备工程技术研究中心 河南洛阳 471023)
机体在生理代谢过程中会产生自由基,当自由基产生过多或清除过慢时,机体处于氧化应激状态,自由基作用于大分子物质,生成大量有害物质,影响细胞正常生理功能[1]。此外,研究表明,自由基与多种疾病的发生与发展密切相关,如心脑血管疾病、糖尿病、肝病、炎症、癌症、衰老等[2-4]。植物黄酮广泛分布于自然界,具有抗氧化、抗癌、调节心血管系统、抗炎免疫及抗衰老等功效,被认为是具有巨大开发前景的天然抗氧化剂[5]。
金银花(Lonicera japonica Thunb.)为食药兼用植物,具有清热解毒,保肝利胆,抗菌消炎等功效[6-7],近几年报道金银花提取液具有清除自由基及抗氧化的作用[8]。目前,金银花中的黄酮类化合物已成为研究热点,国内外学者在金银花黄酮的抗氧化及抗炎功效方面进行了大量的研究。刘昌平[9]通过猪油体系和亚油酸体系进行检测,表明金银花黄酮具有显著的抗氧化活性。沈玲玲等[10]研究证明金银花黄酮对·OH自由基具有明显的清除作用,清除率高达92.22%。Ok-Hwa等[11]也证实金银花中的木犀草素能够抑制促炎细胞介质的释放,从而起到抗炎作用。刘豪等[12]研究表明,金银花黄酮乙醇提取物清除·OH和DPPH·能力较强,其清除自由基的能力与绿原酸、黄酮和多酚的含量具有一定的相关性。目前大部分研究报道集中于对金银花黄酮体外清除自由基方面的评价,而金银花黄酮对细胞及机体影响的研究较少。本研究通过过氧化氢诱导RAW264.7细胞损伤,建立细胞氧化损伤模型,测定细胞及细胞培养液中TAOC、SOD、MDA、GSH、GSH-Px、LDH 及 CAT 水平,探讨金银花黄酮对过氧化氢诱导的细胞损伤的保护机制,为揭示金银花黄酮的抗氧化作用机理提供科学依据。
1 材料与方法
1.1 材料与试剂
金银花黄酮由本实验室工作人员以金银花为原料,采用超声辅助乙醇提取,经D101大孔吸附树脂纯化所得。
小鼠单核巨噬细胞RAW264.7,南京科佰生物科技有限公司;RPMI-1640培养基,美国Hyclone公司;胎牛血清、胰酶、双抗(青霉素-链霉素),美国Gibco公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT),美国 Sigma 公司;T-AOC、SOD、MDA、GSH、GSH-Px、LDH 及 CAT 测定试剂盒,南京建成生物工程研究所;其余试剂均为分析纯级。
1.2 仪器与设备
CKX41倒置显微镜,日本OLYMPUS公司;680全自动酶标仪,美国Bio-Rad公司;UV2400紫外-可见分光光度计,上海舜宇恒平科学仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器,上海申安医疗器械厂;E191IR型CO2细胞培养箱,美国金西盟公司;微型旋涡混合仪,上海沪西分析仪器厂有限公司;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;TGL-20M高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;HL-2D型恒流泵,上海圣科仪器设备有限公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司。
1.3 方法
1.3.1 金银花黄酮的提取 准确称取过80目筛的金银花粉末50 g,用体积分数60%的乙醇按料液比 1∶50(g/mL)的比例混合均匀,于超声功率200 W,提取温度50℃的条件下超声提取35 min,抽滤,50℃下减压浓缩至无醇味,真空冷冻干燥成粉,备用。
1.3.2 金银花黄酮的纯化 预处理D101树脂,将1.3.1节中所得金银花叶黄酮配成3.0 mg/mL的上样液,调节其pH值至2.46,以1.50 mL/min的流速上树脂柱纯化,先用2.0 BV蒸馏水以1.50 mL/min的流速洗脱以除杂,再用体积分数为95%的乙醇溶液(pH11.0)以3.0 mL/min的流速洗脱,收集乙醇洗脱液,旋蒸,冻干后于4℃保存,备用。
1.3.3 RAW264.7细胞培养[13]将RAW264.7细胞接种于含10%胎牛血清和1%双抗的RPMI-1640培养基中,置于37℃、5%CO2的培养箱中培养。细胞铺满培养瓶底70%~80%时传代,取对数生长期细胞做后续试验。
1.3.4 过氧化氢诱导RAW264.7细胞氧化损伤模型的建立 取对数生长期的RAW264.7细胞接种于96孔板中,每孔200 L,细胞密度2.0×105个/mL。在37℃、5%CO2条件下培养24 h至细胞贴壁,弃上清,加入用RPMI-1640培养基配制的不同浓度的H2O2溶液,每个浓度设置6个复孔。继续培养24 h后,弃上清,用PBS洗涤2次,每孔分别加入200 L培养基及10 L质量浓度为5 mg/mL的MTT,放入培养箱4 h后停止培养,弃上清,每孔加入150 L DMSO,轻微振荡10 min使紫色结晶溶解,放入酶标仪中于波长490 nm处测定吸光度。计算细胞存活率。

式中:A0——空白组的平均吸光度;A1——特定浓度样品液组的平均吸光度。
1.3.5 金银花黄酮剂量的筛选 细胞培养过程同1.3.4节,仅将加入的RPMI-1640培养基配制的H2O2溶液换成同种培养基配制的不同浓度的金银花黄酮溶液,并计算细胞存活率。
1.3.6 细胞及细胞培养液中T-AOC、SOD、MDA、GSH、GSH-Px、LDH及CAT水平的测定 将细胞密度为2.0×105个/mL的RAW264.7细胞接种于6孔板中,每孔 2.0 mL,在 37℃、5%CO2培养箱中培养24 h至细胞贴壁,吸弃上清液。在空白组和模型组加入2.0 mL培养基;在试验组分别加入2.0 mL不同质量浓度的金银花黄酮培养液;在对照组加入2.0 mL 250 g/mL VC培养液,置于培养箱中培养24 h,吸弃上清液,每孔加入750 mol/L H2O2溶液2.0 mL,置于培养箱中孵育4 h后将细胞和细胞培养液分离。将细胞培养液离心(4℃,1 500 r/min,5 min)后取上清液待测;细胞用PBS清洗 2 次后离心(4 ℃,1 000 r/min,10 min),保留细胞团块,加入0.5 mL PBS,冰水浴条件下超声破碎(300 W,3~5 s/次,间隔 30 s,重复 3 次),待测。参照相应试剂盒方法测定细胞及细胞培养液中T-AOC、SOD、MDA、GSH、GSH-Px、LDH 及 CAT水平。
1.4 数据处理
用DPS 7.5软件进行统计分析,测定数据以平均值±标准差表示。采用单因素方差分析并用LSD法进行多重比较,不同小写字母表示组间比较差异显著(P<0.05)。
2 结果与分析
2.1 过氧化氢浓度
由图1可知,不同浓度的过氧化氢对RAW264.7细胞的生长均有一定抑制作用,且细胞存活率随过氧化氢浓度的升高而降低。与空白组相比,不同浓度的H2O2均显著抑制RAW264.7细胞的存活(P<0.05),用750 mol/L过氧化氢处理时,RAW264.7细胞的存活率达到51.57%。过氧化氢浓度太低时对细胞造成的损伤不明显,而过氧化氢浓度过高会造成细胞死亡过量。建模时选取过氧化氢浓度为750 mol/L。
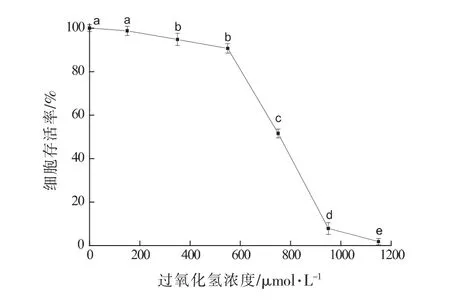
图1 不同浓度H2O2对RAW264.7细胞增殖的影响Fig.1 Effects of different concentrations of H2O2 on proliferation of RAW264.7 cells
2.2 金银花黄酮浓度的筛选
由图2可知,与空白组相比,质量浓度在0~250 mg/mL范围的金银花黄酮均可以促进RAW264.7细胞的增殖。当金银花黄酮质量浓度小于62.5 mg/mL时,促增殖作用不显著(P>0.05);当其质量浓度为62.5,125,250 mg/mL时,促增殖作用显著(P<0.05);当金银花叶黄酮质量浓度大于250 mg/mL时显著抑制细胞增殖(P<0.05)。选择金银花叶黄酮质量浓度62.5,125,250 mg/mL作为推荐剂量进行后续试验。
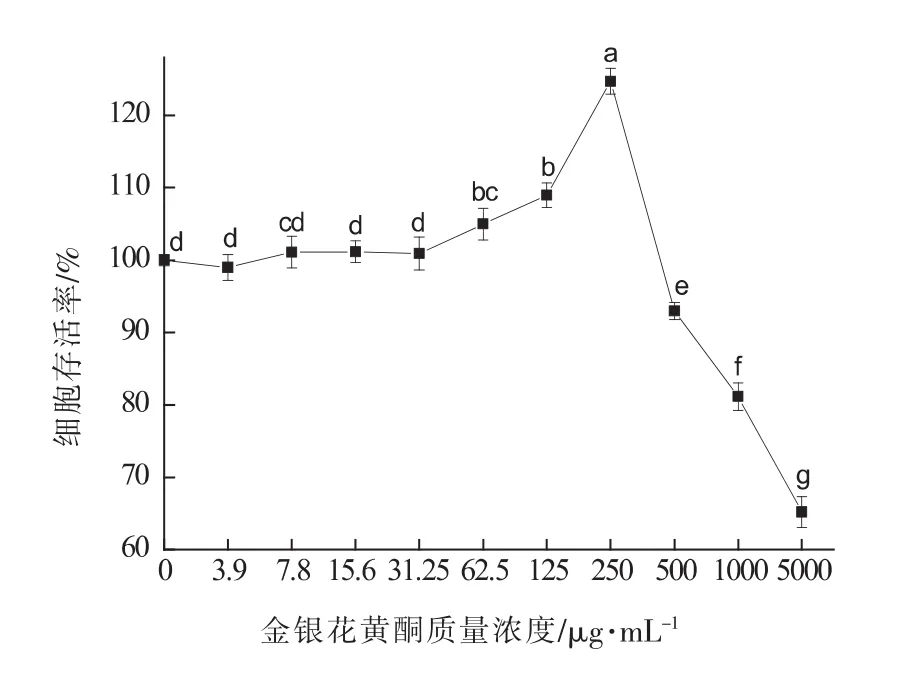
图2 不同浓度金银花黄酮对RAW264.7细胞增殖的影响Fig.2 Effects of different concentrations of honeysuckle flavonoids on proliferation of RAW264.7 cells
2.3 RAW264.7细胞及细胞培养液中T-AOC活性
机体防御体系中总抗氧化能力(T-AOC)的作用主要是维持内环境活性氧的动态平衡,清除过多的活性氧,使机体处于相对稳定的状态[14]。如图3所示,与空白组相比,模型组细胞及细胞培养液中T-AOC活性均显著降低(P<0.05)。添加金银花黄酮可以提高细胞及细胞培养液中T-AOC活性(P<0.05)。除金银花黄酮高剂量组在细胞培养液中的T-AOC活性接近VC对照组(P>0.05)外,其它剂量组在细胞及细胞培养液中的T-AOC活性均低于VC对照组,差异显著(P<0.05)。

图3 RAW264.7细胞(a)及细胞培养液(b)中T-AOC活性Fig.3 T-AOC activities in RAW264.7 cells (a) and cell culture medium (b)
2.4 RAW264.7细胞及细胞培养液中SOD活性
SOD几乎存在于所有生物细胞中,能够催化超氧化物通过歧化反应转化为氧气和过氧化氢,是一种重要的抗氧化剂[15]。如图4所示,与空白组相比,模型组细胞和细胞培养液中的SOD活性均显著下降(P<0.05),而添加金银花黄酮能有效升高细胞及细胞培养液中SOD活性,并呈剂量依赖性(P<0.05)。除金银花黄酮高剂量组在细胞中的SOD活性接近VC对照组(P>0.05)外,其它剂量组在细胞及细胞培养液中的GSH含量均低于VC对照组,差异显著(P<0.05)。
2.5 RAW264.7细胞及细胞培养液中MDA含量
MDA是膜脂过氧化最重要的产物之一,其含量的高、低间接反映膜系统受损程度[16]。如图5所示,与空白组相比,模型组细胞和细胞培养液中的MDA含量均显著上升(P<0.05)。金银花黄酮低、中、高剂量组均显著抑制由H2O2引起的细胞和细胞培养液中MDA含量的增加,并呈剂量依赖性(P<0.05)。VC对照组的MDA含量低于金银花黄酮各剂量组,且有显著差异(P<0.05)。
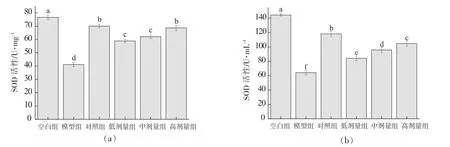
图4 RAW264.7细胞(a)及细胞培养液(b)中SOD活性Fig.4 SOD activities in RAW264.7 cells (a) and cell culture medium (b)
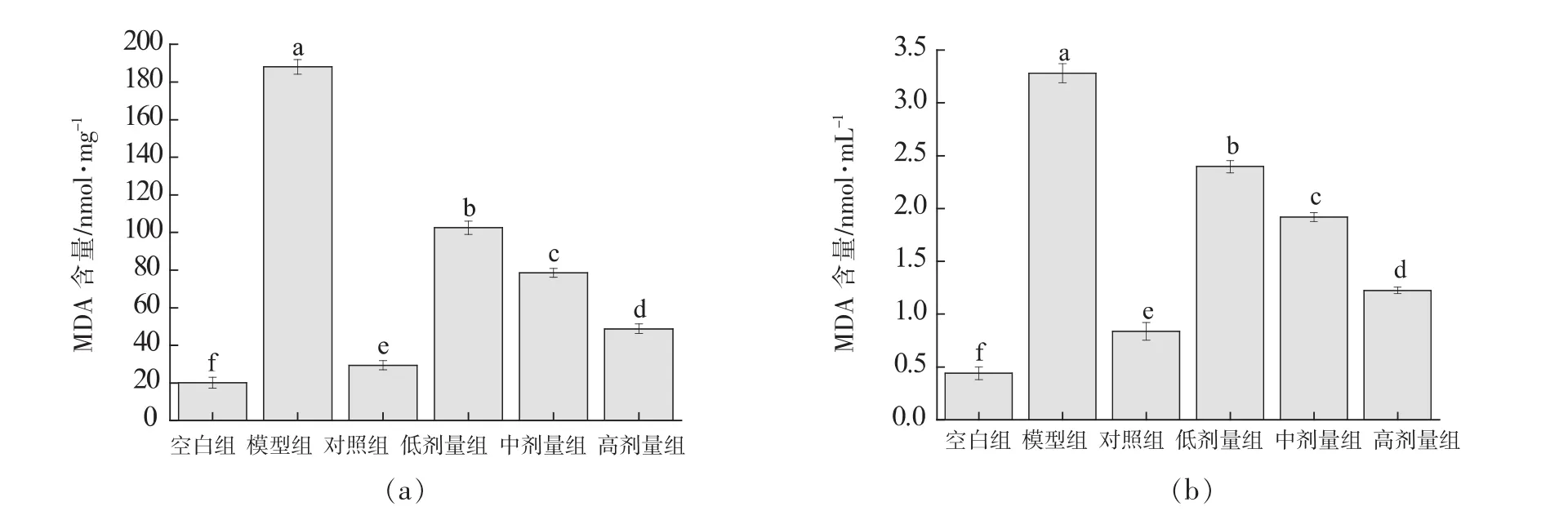
图5 RAW264.7细胞(A)及细胞培养液(B)中MDA含量Fig.5 MDA content in RAW264.7 cells (A) and cell culture medium (B)
2.6 RAW264.7细胞及细胞培养液中GSH含量
GSH可以帮助机体保持正常的免疫功能,且具有抗氧化和整合解毒功效,在机体解毒代谢过程中具有重要作用[17]。如图6所示,与空白组相比,模型组细胞和细胞培养液中的GSH含量明显降低(P<0.05),而金银花黄酮低、中、高剂量组抑制了细胞及细胞培养液中GSH含量的下降,并呈现剂量依赖性(P<0.05)。除金银花黄酮高剂量组在细胞液中的GSH含量接近VC对照组(P>0.05)外,其它剂量组在细胞及细胞培养液中的GSH含量均低于VC对照组,差异显著(P<0.05)。VC对照组与空白组无显著差异(P>0.05)。

图6 RAW264.7细胞(a)及细胞培养液(b)中GSH含量Fig.6 GSH content in RAW264.7 cells (a) and cell culture medium (b)
2.7 RAW264.7细胞及细胞培养液中GSH-Px活性
GSH-Px是机体内广泛存在的一种过氧化物分解酶,它可以保护机体免受脂质过氧化物的损伤[18]。如图7所示,与空白组相比,模型组细胞和细胞培养液中的GSH含量明显降低(P<0.05),金银花黄酮各剂量组显著抑制了细胞及细胞培养液中GSH-Px活性的降低(P<0.05)。对于细胞,金银花黄酮低、中、高剂量组之间存在明显的剂量依懒性(P<0.05)。VC对照组在细胞及细胞培养液中的GSH-Px活性显著高于金银花黄酮各剂量组,且具有显著差异(P<0.05)。
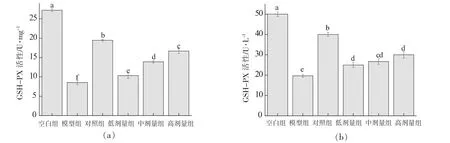
图7 RAW264.7细胞(a)及细胞培养液(b)中GSH-Px活性Fig.7 GSH-Px activities in RAW264.7 cells (a) and cell culture medium (b)
2.8 RAW264.7细胞及细胞培养液中LDH活性
LDH存在于细胞内,能催化丙酮酸生成乳酸,当细胞受损时LDH将大量释放,导致细胞外LDH水平的显著升高,因此LDH活性可以反映细胞受氧化损伤程度[19]。如图8所示,与空白组相比,模型组细胞中的LDH活性显著降低(P<0.05),而细胞培养液中的LDH活性显著升高(P<0.05),表明H2O2使细胞膜受损导致LDH外漏。与模型组相比,金银花黄酮各剂量组显著升高了细胞中LDH活性,降低了细胞培养液中LDH活性(P<0.05),并呈剂量依赖性,表明金银花黄酮可以预防或减缓细胞膜受损程度,阻止细胞内LDH外漏。金银花黄酮中、高剂量组在细胞中的LDH活性接近VC 对照组,无显著差异(P>0.05);金银花黄酮高剂量组在细胞培养液中的LDH活性显著高于VC对照组(P<0.05)。
2.9 RAW264.7细胞及细胞培养液中CAT活性
CAT普遍存在于生物机体内,它可以催化H2O2分解为H2O与O2,保护机体免受有害物质损伤[20]。如图9所示,与空白组相比,模型组细胞和细胞培养液中的CAT活性明显降低 (P<0.05),金银花黄酮各剂量组显著提高了细胞及细胞培养液中CAT活性,并呈剂量依赖性(P<0.05)。金银花黄酮高剂量组在细胞及细胞液中的CAT活性均接近 VC 对照组(P>0.05)。
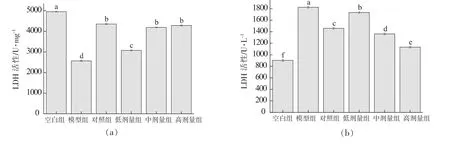
图8 RAW264.7细胞(a)及细胞培养液(b)中LDH活性Fig.8 LDH activities in RAW264.7 cells (a) and cell culture medium (b)
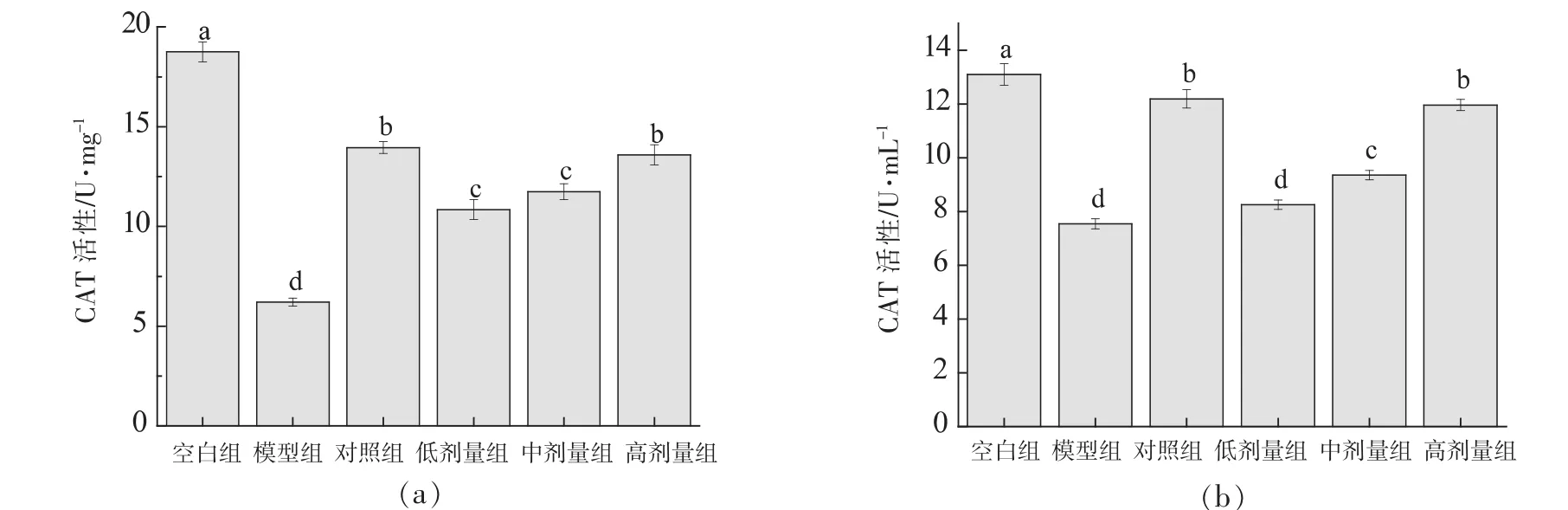
图9 RAW264.7细胞(a)及细胞培养液(b)中CAT活性Fig.9 CAT activities in RAW264.7 cells (a) and cell culture medium (b)
3 讨论与结论
本研究通过过氧化氢处理RAW264.7细胞来制备氧化应激损伤模型,探讨金银花黄酮对细胞氧化损伤的保护作用。研究结果表明,经750 mol/L过氧化氢处理的RAW264.7细胞存活率显著下降,在质量浓度0~250 mg/mL范围的金银花黄酮均可以促进RAW264.7细胞的增殖,其中质量浓度在62.5~250 mg/mL范围时,促增殖作用显著。
通过测定细胞和细胞培养液中总抗氧化能力(T-AOC)、 超氧化物歧化 酶 (SOD)、 丙 二醛(MDA)、谷胱苷肽(GSH)、谷胱苷肽过氧化物酶(GSH-Px)、 乳酸脱氢酶 (LDH) 及过氧化氢酶(CAT)的水平来反映金银花黄酮对过氧化氢诱导损伤的RAW264.7细胞的保护程度。研究发现处理RAW264.7细胞后,细胞与细胞培养液中MDA含量显著升高,T-AOC 水平、SOD、GSH-Px、CAT活性及GSH含量均显著降低;细胞中LDH活性下降,细胞培养液中LDH活性升高,这表明过氧化氢对RAW264.7巨噬细胞具有明显的毒性作用,会使细胞膜结构受损,细胞内各种酶活性下降。而不同剂量金银花黄酮修复损伤细胞时,上述指标较模型组均获得不同程度的改善。金银花黄酮一方面通过提高细胞和细胞培养液中GSH含量及SOD、GSH-Px、CAT活性,清除有毒有害物质和自由基,缓解细胞所受到的损伤;另一方面通过减少MDA含量来降低脂质过氧化物含量,减缓细胞膜系统受氧自由基攻击后的损伤,从而间接增强机体抵抗自由基攻击的能力[21],保持生物膜的结构完整和膜表面蛋白质的功能,减轻LDH向细胞外扩散的程度。
综上所述,金银花黄酮可以显著缓解过氧化氢损伤导致的RAW264.7巨噬细胞活力下降,其保护作用可能与增强细胞内抗氧化酶活性,清除氧自由基及有害物质,维持细胞膜系统稳定性有关。
