几种酯类溶剂对SO的吸收机理*2
2019-07-31盛清涛王玉高牛艳霞
马 婷 申 峻 盛清涛 王玉高 刘 刚 牛艳霞
0 引 言
SO2对于人类和自然环境的危害一直备受各界人士关注,科研工作者也一直致力于探索有效脱除二氧化硫的方法,无论是工业上应用最多的碱式水溶液脱硫方法(石 灰 石-石 灰 法[1-3]、双 碱 法[4-7]和 氨法[8-10]等),还是应用受限制的海水脱硫方法[11],以及一直处在实验室研究阶段的离子液体脱硫方法[12-13],亦或是 微 生 物 法[14-18],都 在 研 究 最 具 工 业应用价值的SO2脱除方法。
目前,研究有机溶剂脱除SO2的方法众多,加拿大的Cansolv可再生胺法脱硫技术[19]是工业用有机溶剂脱除烟气中SO2较早的工艺;周长城等[20]研究了乙二胺/磷酸溶液在填料塔中脱除SO2的气液平衡模型。胡显平[21]在文献[20]的基础上研究了SO2连续吸收、解吸的机理,为工业实践提供了一定的理论参考。前人的研究结果发现,胺法的解吸效果并不理想,原因主要是吸收SO2时生成了热稳定盐,这类盐不容易热分解,影响了胺液的再生。魏雄辉等[22-29]研究了低浓度SO2在乙二醇、聚乙二醇及其水溶液体系中的溶解度及吸收机理,发现乙二醇体系对SO2具有良好的吸收和解吸能力,但尚未见于工业应用。众所周知,SO2在溶剂中的溶解度数据非常重要,是判别溶剂有效吸收SO2的重要手段。然而,无论采用静态法还是动态法,测定SO2在溶剂中的溶解度均比较耗时。事实上,在工业生产中溶液是不断循环的,对气体的吸收是达不到平衡状态的,而当气体穿透溶液时,即气相中SO2的浓度大于零时,溶液中含有的SO2的浓度数据更接近真实状态。
基于前人的研究,发现醇类有机溶剂对于SO2的吸收具有潜在工业应用价值,但其他类的有机溶剂如酯类和醚类等是否对SO2具有较好的吸收能力鲜有研究。因此,本实验选择了四种酯类溶剂对吸收SO2的情况进行了研究,探索出一种测定SO2气体穿透溶剂时溶解度(穿透溶解度)的方法。此外,对几种溶剂吸收SO2能力进行了评价,对其吸收机理进行了分析。
1 实验部分
1.1 试剂和仪器
实验所用试剂:磷酸三乙酯(TEP)、碳酸丙烯酯(PC)、乙酸乙酯(EAC)、乙酸丁酯(BA)、乙二醇(EG),这些溶剂均为AR级,均购于天津科密欧化学试剂公司;标准SO2+N2混合气体,其中SO2浓度为0.125mol/L,购于北京环宇京辉京城气体科技有限公司。
实验所用仪器:IRAFFINITY-1型傅立叶红外光谱仪(日本岛津),UV-1800紫外可见分光光度计(日本岛津),400MHz窄腔液体核磁共振波谱仪(瑞士Bruker)。四种酯类溶剂的基本物理性质见表1。

表1 四种酯类溶剂的基本物理性质Table 1 Basic physical properties of four kinds of ester solvents
1.2 吸收能力评价方法
本实验采用鼓泡法在常压下对有机溶剂吸收二氧化硫的穿透溶解度进行测定,旨在对溶剂的吸收能力进行评价。其简易操作流程如图1所示。
操作方法为:在开启实验装置之前,先将一定量的有机溶剂(吸收剂)、指示剂吸收液和NaOH溶液分别装入图1中的3,5,6容器中。然后打开并调节恒温水溶4的温度至实验温度,并恒温半小时后,开启气体钢瓶1,并观察指示剂吸收瓶5的变化。当指示剂颜色变为无色时,立即停止实验,并取出有机溶剂吸收瓶3,用于溶剂中SO2浓度的测定。重复上述操作可得到不同温度下的SO2浓度,将这些点绘制成随温度变化的曲线,用于多种溶剂对SO2吸收能力的比较。实验中,指示剂吸收瓶5中的指示剂是由极低浓度的碘液加淀粉指示剂而成的淡蓝色溶液,由于指示剂溶液中的碘浓度极低,因此,当SO2穿透有机溶剂时,指示剂立即变为无色,此时对应的有机溶剂中吸收的SO2浓度即为穿透溶解度。有机溶剂中SO2浓度用碘量法[30]测定。

图1 实验装置Fig.1 Schematic diagram of experimental setup
1.3 光谱测定条件
紫外-可见吸收光谱测试条件:温度为15℃~30℃,波长范围为190nm~700nm,吸光度范围为-4~4。
红外光谱测试条件:扫描次数为36次;分辨率为4.0;扫描范围为400cm-1~4 000cm-1,测试样品采用薄膜法。液体1H-NMR测试条件为:磁场强度为7.4×106A/m;频率范围为6MHz~440 MHz;时间分辨率为12.5ns。其中乙酸乙酯和碳酸丙烯酯溶于氘代氯仿,磷酸三乙酯和乙酸丁酯溶于氘代水。
2 结果与讨论
2.1 吸收能力评价结果
在常压下,温度范围为30℃~70℃,测定有机溶剂对SO2的吸收能力,结果如图2所示。

图2 有机溶剂吸收二氧化硫的能力Fig.2 Capability of organic solvents to absorb sulfur dioxide
由图2可知,几种溶剂都对SO2有一定的吸收,显然,酯类溶剂对SO2的吸收能力均高于乙二醇。酯类溶剂相较于醇类溶剂能更有效地用于烟气中SO2的脱除。总体上,磷酸三乙酯对SO2的吸收能力最好,其次是乙酸乙酯,再次是碳酸丙烯酯,乙酸丁酯对SO2的吸收能力较差。四种酯类溶剂对SO2的吸收能力有较大差异,表明SO2与酯类溶剂之间存在不同的相互作用,应通过光谱表征进一步研究酯类溶剂与SO2的作用机理。由图2还可以看出,随着温度的升高,有机溶剂对于SO2的吸收能力逐渐下降,因此,应在低温时吸收SO2,使溶剂的吸收能力最大化;而高温时SO2更易从溶液中解吸,使溶剂可以循环利用。
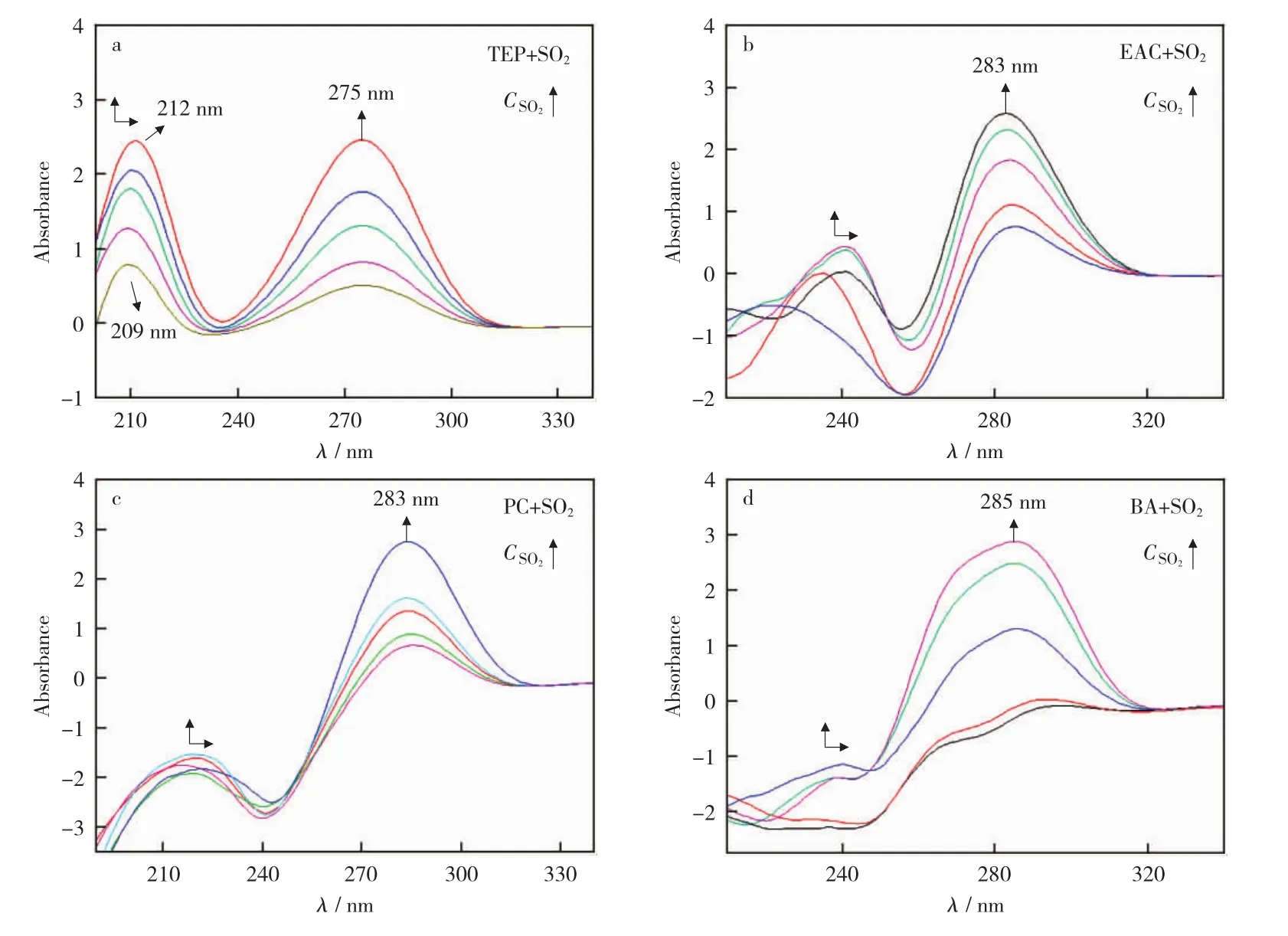
图3 四种溶剂吸收SO2的紫外-可见光谱Fig.3 UV-visible spectra of SO2absorbed by four kinds of solvents
2.2 光谱分析
2.2.1 紫外-可见光谱分析
图3所示为四种酯类溶剂吸收SO2的紫外-可见吸收光谱(酯类溶剂作为参比溶液)。SO2分子是π43结构,有两个电子跃迁带,即200nm~230nm处的π→π*跃迁和280nm~310nm处的n→π*跃迁[31]。由图3可知,四种酯类溶剂都出现了两个特征吸收带,随着溶剂中SO2浓度的增加,200nm~230nm处的紫外最大吸收峰增强且发生明显红移。推测原因可能为,溶剂中的双键与SO2分子的π键发生共轭作用,π→π*跃迁能量降低,吸收峰红移,并且吸收强度增加。另外,280nm~310nm处的吸收峰逐渐增强,峰的位置没有发生移动,这是因为溶剂对SO2分子中的非键电子(n电子)影响较小,所以只是强度发生改变[32]。
2.2.2 红外光谱分析
图4所示为四种酯类溶剂吸收SO2前后的红外光谱。由图4a可知,975cm-1和820cm-1处的振动峰分别归属为磷酸三乙酯分子结构中磷氧单键(P—O—)的反对称伸缩振动峰和对称伸缩振动峰,1 031cm-1处为—C—O的伸缩振动峰,吸收SO2后,这三个波数没有发生变化,说明该位点没有与SO2发生作用;1 267cm-1处的振动峰为磷酸三乙酯分子结构中磷氧双键(— P O)的振动,吸收SO2后,该位置的振动峰发生了较小的蓝移,说明SO2在该位点与磷酸三乙酯发生了弱的相互作用,其原因可能为,— P O中的O原子吸引SO2中S原子上的孤对电子,发生p-π共轭,其结果使得电子的活动范围增大,易被激发,故在图3a中观察到了π→π*跃迁吸收带向长波长方向移动,同时,p-π共轭也使得— P O附近的电子云密度增加,双键键长缩短,从而使得该处的红外伸缩振动所需的能量增大,表现为该吸收峰蓝移。
由图4b可知,1 771cm-1处的振动峰为乙酸乙酯分子中碳氧双键(— C O)的伸缩振动吸收峰,通入SO2后,该位置的吸收峰蓝移,说明乙酸乙酯与SO2在该位点发生作用。原因可能为,— C O中的O原子吸引SO2中S原子上的孤对电子,发生p-π共轭,使得— C O附近的电子云密度增加,双键性增强,键长缩短,则该吸收振动峰蓝移;1 250cm-1和1 063cm-1处的振动峰分别归属为乙酸乙酯分子中碳氧单键(C—O—C)的反对称伸缩振动峰和对峰伸缩振动峰,通入SO2后,C—O—C对应的两个振动吸收峰均蓝移,这可能是由于— C O与SO2形成的大π键对于C—O—C的诱导作用,使得其周围的电子云密度增加,吸收峰蓝移。
由图4c可知,1 049cm-1,1 182cm-1和1 790 cm-1处的振动峰分别归属于碳酸丙烯酯分子中的碳氧单键(C—O—C)的对称伸缩振动峰和反对称伸缩振动峰以及碳氧双键(— C O)的伸缩振动峰,通入SO2之后,吸收峰发生的变化与乙酸乙酯类似。
由图 4d 可 知,1 243cm-1,1 055cm-1和1 766cm-1处的振动峰分别归属为乙酸丁酯分子中的碳氧单键(C—O—C)的反对称伸缩振动峰和对称伸缩振动峰以及碳氧双键(— C O)的伸缩振动峰,吸收SO2后,这些吸收峰的位置都没有发生变化,但在1 313cm-1和1 104cm-1处出现了两个新的振动吸收峰,根据文献[33-34],这两个新的吸收峰应该分别归属于SO2分子中的S—O键的反对称伸缩振动和对称伸缩振动。由于图4的实验条件与测试条件相同,但在图4a~图4c中均未发现这两个新峰,因此,推测可能除了乙酸丁酯与SO2存在弱的相互作用外,大部分被吸收的SO2分子以游离态形式存在。综上所述,磷酸三乙酯、乙酸乙酯和碳酸丙烯酯与SO2的作用或吸收SO2的能力主要归因于 P O和 C O双键与SO2形成了共轭作用,即形成电荷转移作用,而与乙酸丁酯吸收SO2的能力主要在于SO2分子在乙酸丁酯中的物理溶解。
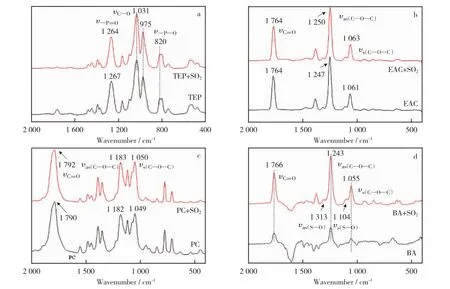
图4 四种溶剂吸收SO2前后的红外光谱Fig.4 Infrared spectra of four solvents before and after SO2absorption
2.2.3 核磁共振氢谱分析
图5所示为四种酯类溶剂吸收SO2前后的1HNMR谱。根据文献[35-37],由图5a和图5b可知,TEP分子中有两类不同环境的氢,与吸收前相比,所有TEP分子中的H质子化学位移向低场移动,这意味着SO2分子与TEP分子间存在相互作用。由红外分析结果可知,磷氧双键上的O原子与SO2中的S原子发生共轭作用。该作用使得TEP分子中的电子云向O原子偏移,从而诱导甲基(—CH3)及亚甲基(—CH2—)附近电子云密度降低,导致化学位移向低场移动。

图5 四种溶剂吸收SO2前后的1 H-NMR谱Fig.5 1 H-NMR of four solvents before and after SO2absorption
由图5c和图5d可知,EAC分子中有三种不同环境的氢,吸收SO2后,三种不同环境氢的化学位移都移向低场。原因是羰基双键上的氧原子与SO2中的S原子发生共轭作用,使得分子中羰基所连的甲基(—CH3)的H被裸露,导致化学位移增大,诱导作用使得C—O单键所连的甲基和亚甲基的电子云密度降低,使其向低场移动。
由图5e和图5f可知,PC分子中有四种不同环境的氢,通入SO2后,PC分子中氢的化学位移都移向低场。原因是碳氧双键上的氧原子与SO2中的硫原子相互作用,使得PC分子的碳氧双键附近电子云密度增大,由于碳氧单键中氧的电负性大于碳,则电子云向氧原子偏移,则使得分子中的H质子附近的电子云密度降低,化学位移向低场移动。
由图5g和图5h可知,BA分子中含有两类(—CH3和—CH2—)五种不同环境的氢,加入SO2之后,化学位移都向低场移动,原因与乙酸乙酯及碳酸丙烯酯一致。但也观察到其吸收SO2前后化学位移值变化较大,则说明乙酸丁酯与SO2之间存在相互作用,这由图3也可以看出,它们之间的相互作用使得紫外谱中的π→π*吸收带的强度明显减弱,同时,n→π*吸收带的峰形也发生了改变。但从相应的红外谱中并未观察到吸收峰的改变,其原因可能为,尽管乙酸丁酯与SO2之间存在相互作用,由于乙酸丁酯中存在较长的侧链,使得对SO2的吸收产生了空间位阻效应,故乙酸丁酯吸收SO2的量并不大,这与穿透溶解度的结果是一致的。因此,少量的乙酸丁酯与SO2的作用产物并没有在红外谱中体现出来,但看到了SO2的特征吸收峰,这再次证明乙酸丁酯对SO2的吸收主要是靠SO2的物理溶解。
3 结 论
1)在四种酯类溶剂中,磷酸三乙酯吸收SO2的能力最强,乙酸丁酯对SO2的吸收较差,随着温度的升高,有机溶剂对SO2的吸收能力逐渐下降,则应在低温时用溶剂吸收SO2,高温时从溶液中解吸SO2。
2)通过紫外-可见吸收光谱、红外光谱、核磁共振氢谱表征分析,发现酯类溶剂与SO2分子之间存在相互作用,作用位点为— P O或者— C O中的O原子吸引SO2中S原子上的孤对电子,发生p-π共轭。
3)对于乙酸丁酯而言,由于其较长的丁基侧链的空间位阻效应使得SO2的吸收量较低,SO2在乙酸丁酯中主要是以游离状态存在,即乙酸丁酯对SO2的吸收主要靠的是SO2物理溶解。
