HMGA2基因调控Notch信号通路对高糖诱导的肾小管上皮细胞凋亡的影响*
2019-07-30方晓琳杨海波张一诺孙广平
方晓琳, 杨海波, 李 宪, 胡 涛, 张一诺, 孙广平
(吉化集团公司总医院 1内分泌科, 2血液中毒科, 吉林 吉林 132021)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见、最严重的慢性并发症之一,是引起慢性肾功能衰竭的主要原因,随着人们生活方式、生活水平等的改变,全球糖尿病的患病率快速升高,严重威胁人类健康[1]。大量研究表明,DN的早期主要特征是肾小管上皮细胞凋亡[2];高糖可抑制肾小管上皮细胞增殖,并诱导凋亡[3]。因此,深入探究引起肾小管上皮细胞凋亡机制具有重要意义。高迁移率族蛋白A2(high mobility group protein A2,HMGA2)是HMGA家族的一个成员,其基因是近些年的受到关注的癌基因之一,其异常表达与多种肿瘤发生发展密切相关[4-5]。HMGA2在DN的研究较少。有研究表明,HMGA2的单核苷酸多态性与糖尿病有关[6];微小RNA-23b(microRNA-23b, miR-23b)可通过靶向抑制HMGA2减弱DN的上皮-间充质转化(epithelial-me-senchymal transition,EMT)[7]。Notch信号通路是一条重要的信号途径,近些年研究发现,该信号途径与多种肾脏疾病密切相关[8]。因此,本研究通过RNA干扰(RNA interfering, RNAi)技术抑制肾小管上皮细胞HMGA2表达,观察HMGA2表达对肾小管上皮细胞凋亡的影响,并进一步探究对Notch信号的调控。
材 料 和 方 法
1 试剂和仪器
人近端肾小管上皮细胞系HK-2购自中国科学院上海细胞库。DMEM/F12培养基、胰酶和胎牛血清(fetal bovine serum,FBS)均购自Gibco;D-葡萄糖和DAPT购自Sigma;抗HMGA2、Notch1、Hes1、Bcl-2和Bax抗体均购自Abcam;活性氧簇(reactive oxygen species,ROS)测定试剂盒购自南京建成;细胞凋亡率试剂盒购自江苏凯基。流式细胞仪购自BD。
2 方法
2.1细胞培养 HK-2细胞用含10% FBS及青链霉素的低糖DMEM/F12培养基,在37 ℃、5% CO2培养箱中静置培养,24 h后,待细胞充分贴壁,每隔1 d换液1次,约3~5 d细胞长满瓶底时进行传代,细胞传代采用胰酶-EDTA消化法。实验为生长至对数期的细胞。
2.2基因转染和细胞干预 将生长至对数期的HK-2细胞以2×108/L浓度接种于6孔板,每孔加2 mL细胞悬液,培养过夜。参照LipofectamineTM2000说明将设计合成的HMGA2特异性siRNA(si-HMGA2)序列及阴性对照组siRNA(negative control siRNA, NC)序列转染细胞,同时设置空白组,转染后将6孔板放入培养箱,37 ℃、5% CO2培养5 h,换为完全培养基继续培养24 h,同步24 h后加30 mmol/L D-葡萄糖刺激细胞48 h。
胰酶消化生长至80%融合的HK-2细胞,调整细胞浓度,接种于6孔板,待细胞长至70%~80%融合时进行干预试验。D-葡萄糖刺激浓度选择:采用5、10、20 和30 mmol/L的D-葡萄糖刺激HK-2细胞2 h,通过Western blot检测HMGA2蛋白的表达;然后用30 mmol/L的D-葡萄糖刺激HK-2细胞0 min、10 min、60 min和120 min,通过Western blot检测HMGA2蛋白的表达。
转染细胞分组:含10% FBS的低糖DMEM/F12完全培养基常规培养HK-2细胞,细胞达80%贴壁时,不含血清培养基同步细胞24 h,将细胞随机分为4个处理组,即正常葡萄糖(normal glucose, NG)组(5 mmol/L葡萄糖)、高糖(high glucose HG)组(30 mmol/L葡萄糖)、HG+si-HMGA2组(转染si-HMGA2+30 mmol/L葡萄糖)和HG+NC组(转染阴性对照siRNA+30 mmol/L葡萄糖),处理48 h,收集细胞用于后续研究。
2.3Western blot实验 收集干预后的细胞,加裂解液在冰上反应30 min,刮取细胞,离心,上清液即为提取的总蛋白。BCA法定量蛋白。取50 μg总蛋白,加5×加样缓冲液,在100 ℃煮沸变性5 min,离心后上样,经10% SDS-PAGE,电泳后电转PVDF膜,5% BSA在37 ℃条件下封闭1 h,加 I 抗(HMGA2、Notch1、Hes1、Bcl-2和Bax抗体,稀释比例均为1∶500),4 ℃孵育过夜,TBST洗涤,加HRP标记的 II 抗(稀释比例1:2 000),室温孵育2 h,TBST洗膜,ECL显色剂滴加至PVDF膜,在凝胶成像仪内显影。通过Quantity One计算各个条带灰度值。以GAPDH为内参照,以目的蛋白与GAPDH灰度值比值代表各个目的蛋白的相对表达量。实验重复3次。
2.4流式细胞术检测细胞凋亡率 收集干预后的细胞,加胰酶-EDTA消化细胞,镜下观察细胞变圆、飘起后,加含血清的完全培养基终止消化,离心,弃上清,预冷PBS洗涤细胞,离心,结合缓冲液重悬细胞,取100 μL细胞悬液,加5 μL Annexin V-FITC及5 μL PI,混匀,室温避光反应15~20 min,流式细胞仪检测。实验重复3次。HK-2细胞用HG、HG+DAPT(DAPT为Notch信号抑制剂,10 μmol/L)及HG+si-HMGA2+DAPT处理,48 h后通过Annexin V-FITC/ PI双染法检测细胞凋亡率。实验重复3次。
2.5ROS含量的检测 取按照2.2方法干预后的细胞,采用DCFH-DA活性氧检测方法检测各组细胞ROS含量。操作参照ROS检测试剂盒说明,使用多功能酶标仪检测。实验重复3次。
3 统计学方法
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,多组差异比较采用单因素方差分析并用SNK-q检验进行各组均数间的两两比较,以P<0.05为差异有统计学意义。
结 果
1 D-葡萄糖对HK-2细胞HMGA2表达的影响
不同浓度的D-葡萄糖处理HK-2细胞,HMGA2蛋白表达随D-葡萄糖浓度增加而增加,10、20 和30 mmol/L的D-葡萄糖处理组的HMGA2蛋白表达均明显高于5 mmol/L D-葡萄糖对照组(P<0.05),见图1A。30 mmol/L的D-葡萄糖处理HK-2细胞10 min、60 min和120 min,HMGA2蛋白表达随时间增加而增加,且与0 min对照组比较差异均具有统计学意义(P<0.05),见图1B。

Figure 1.The effect of D-glucose on the expression of HMGA2 in the HK-2 cells. A: the results of Western blot for determining the relative protein expression of HMGA2 in the HK-2 cells treated with D-glucose at different concentrations; B: the results of Western blot for determining the relative protein expression of HMGA2 in the HK-2 cells treated with D-glucose at different time points. Mean±SD.n=3.*P<0.05vs5 mmol/L D-glucose group;#P<0.05vs0 min group.
图1 D-葡萄糖对HK-2细胞HMGA2表达的影响
2 si-HMGA2转染HK-2细胞的效果
HG组HMGA2蛋白表达明显高于NG组,而HG+si-HMGA2组HMGA2蛋白表达明显低于HG组(P<0.05),HG+NC组和HG组间HMGA2蛋白表达差异无统计学显著性(P>0.05),见图2。这提示抑制HMGA2表达的模型建立成功。
3 si-HMGA2降低高糖诱导的HK-2细胞凋亡
通过流式细胞术检测si-HMGA2对高糖诱导的HK-2细胞凋亡的影响,结果显示,HG组细胞凋亡率明显高于NG组,而HG+si-HMGA2组细胞凋亡率明显低于HG组(P<0.05),HG+NC组和HG组间细胞凋亡率差异无统计学意义(P>0.05),见图3。

Figure 2.The protein expression of HMGA2 after si-HMGA2 was transfected into the HK-2 cells. Mean±SD.n=3.*P<0.05vsNG group;#P<0.05vsHG group.
图2 Western blot检测si-HMGA2转染HK-2细胞后HMGA2蛋白的表达
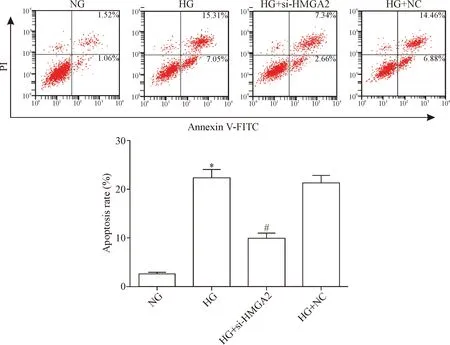
Figure 3.Flow cytometry was used to analyze the effect of si-HMGA2 on apoptosis of HK-2 cells induced by high glucose (HG). Mean±SD.n=3.*P<0.05vsNG group;#P<0.05vsHG group.
图3 流式细胞术检测si-HMGA2对高糖诱导的HK-2细胞凋亡的影响
4 si-HMGA2降低高糖诱导的HK-2细胞ROS水平
ROS含量的的检测结果显示,HG组的ROS含量明显高于NG组,HG+si-HMGA2组的ROS含量明显低于HG组(P<0.05),HG+NC组和HG组间的ROS含量差异无统计学显著性(P>0.05),见图4。
5 si-HMGA2下调高糖诱导的HK-2细胞Notch信号通路
Western blot检测si-HMGA2对高糖诱导的HK-2细胞Notch信号通路Notch1和Hes1及下游凋亡相关的Bcl-2和Bax的蛋白表达,结果显示,与NG组比较,HG组的Notch1和Hes1表达明显升高,而Bcl-2/Bax的表达明显降低(P<0.05);与HG组比较,HG+si-HMGA2组的Notch1和Hes1表达明显降低,而Bcl-2/Bax的表达明显升高(P<0.05)。HG+NC组和HG组检测 Notch1、Hes1和Bcl-2/Bax蛋白表达的差异无统计学显著性(P>0.05),见图5。
6 si-HMGA2降低高糖诱导的HK-2细胞凋亡
流式细胞术检测si-HMGA2对高糖诱导的HK-2细胞Notch信号通路的调控作用,结果显示,HG+DAPT组的细胞凋亡率明显低于HG组,而HG+si-HMGA2+DAPT组的细胞凋亡率明显低于HG+DAPT组(P<0.05),见图6。

Figure 4.The effect of si-HMGA2 on ROS content in the HK-2 cells induced by high glucose (HG). Mean±SD.n=3.*P<0.05vsNG group;#P<0.05vsHG group.
图4 si-HMGA2对高糖诱导的HK-2细胞ROS含量的影响
讨 论
近些年越来越多的研究表明,肾小管间质损伤是DN病理改变的主要特征,尤其是小管上皮细胞凋亡和损伤已引起广泛关注[9]。有研究发现,白藜芦醇可能通过抑制活性氧的生成和上调Nrf-2表达保护高糖诱导的HK-2细胞凋亡[10];高糖培养的HK-2细胞miRNA-503上调表达,可通过抑制靶蛋白Bcl-2,活化线粒体凋亡途径,激活caspase酶,诱导HK-2细胞凋亡[11],以上研究提示抑制高糖诱导的肾小管上皮损伤可对DN损伤起拮抗作用。 作为一个结构转录因子,HMGA2可对包括细胞增殖和凋亡相关基因在内的大量基因转录和活化进行调节[12]。在正常组织中HMGA2不表达或低表达,而在多种恶性肿瘤中HMGA2明显上调表达[13-14]。

Figure 5.The effect of si-HMGA2 on Notch signaling pathway in the HK-2 cells induced by high glucose (HG). Mean±SD.n=3.*P<0.05vsNG group;#P<0.05vsHG group.
图5 si-HMGA2对高糖诱导的HK-2细胞Notch信号通路的影响
目前对HMGA2的研究多集于肿瘤方法,在DN中研究较少。本研究首先检测不同浓度D-葡萄糖处理HK-2细胞及D-葡萄糖处理HK-2细胞不同时间HMGA2表达变化,发现D-葡萄糖可呈现剂量及时间依赖性上调HMGA2表达,提示HMGA2可能是引起DN的一个因素。有研究发现,RNA干扰抑制HMGA2表达可减弱AGEs诱导的肾小管上皮细胞EMT[15];miR-23b可通过靶向抑制HMGA2减弱DN的EMT[7]。本研究试图证实HMGA2对高糖诱导的HK-2细胞凋亡影响。RNAi是由双链RNA所引起的序列特异性基因沉默,是一项高效、高特异性的基因封闭技术,目前已在基因功能研究、基因治疗等方面有广泛应用[16-17]。本研究结果显示,通过RNAi技术抑制HMGA2基因表达可减弱高糖诱导的肾小管上皮细胞凋亡, 提示通过抑制HMGA2基因表达可对DN损伤起拮抗作用。
为了研究HMGA2基因对肾小管上皮细胞凋亡机制,我们进一步观察沉默HMGA2基因对细胞氧化应激的影响。研究表明,高血糖所引起的高滤过,可导致肾小管上皮细胞糖负荷增加、回吸收增加,引起肾小管氧耗增加,导致肾小管发生缺氧,最终引起肾脏氧化应激[18-19]。研究表明,高糖环境下,QDPR基因高表达能降低NRK-52E细胞氧化应激,沉默QDPR基因能增加NRK-52E细胞氧化应激[20];ROS可参与诱导肾小管上皮细胞凋亡[21]。本研究结果显示,抑制HMGA2基因表达可降低高糖诱导的肾小管上皮细胞ROS含量,提示降低ROS水平可能是HMGA2抑制肾小管上皮细胞凋亡的机制之一。

Figure 6.The effects of si-HMGA2 on apoptosis of HK-2 cells induced by high glucose (HG). The results of flow cytometry analysis were showed. Mean±SD.n=3.*P<0.05vsHG group;#P<0.05vsHG+DAPT group.
图6 流式细胞术检测si-HMGA2对高糖诱导的HK-2细胞凋亡的影响
Notch信号通路是一条在进化上相对保守的信号途径,在脊椎动物及非脊椎动物中广泛存在,参与多种基因的发生发展[22]。近些年来肾脏病领域研究证实,Notch信号通路与DN和肾小球硬化等多种肾脏疾病有关[23-24]。高糖可以上调系膜细胞Notch信号通路相关分子的表达,Notch信号通路的活化可以上调TGF-β和FN,可能导致肾脏纤维化和DN的发生[25]。TGF-β1在DN高表达,高糖能抑制HK-2的存活,促进凋亡,沉默TGF-β1能减弱高糖诱导HK-2活力抑制及凋亡诱导作用,可能与Notch信号通路调控有关[26]。Bcl-2和Bax是Bcl-2家族的抑凋亡蛋白和促凋亡蛋白,Bcl-2/Bax比例可衡量细胞是否凋亡,其比例升高时细胞凋亡率降低[27]。本研究结果显示,抑制HMGA2基因表达可下调Notch信号通路Notch1和Hes1表达,上调Bcl-2表达和下调Bax表达,提示下调HMGA2基因表达可能通过抑制Notch信号通路降低高糖诱导的肾小管上皮细胞凋亡。进一步研究HMGA2基因对Notch信号通路调控,发现Notch信号通路抑制剂DAPT可降低高糖诱导的肾小管上皮细胞凋亡,而下调HMGA2和DAPT同时处理细胞后,凋亡率明显低于单独用DAPT处理组,说明下调HMGA2基因表达是通过抑制Notch信号通路降低高糖诱导的肾小管上皮细胞凋亡。
综上所述,下调HMGA2基因表达可通过调控Notch信号通路而降低细胞内ROS产生并抑制肾小管上皮细胞凋亡。本研究可能为HMGA2在DN研究提供了一定的理论依据,提示HMGA2可能是DN治疗的一个有效靶点,但还需更深入研究。
