沉默生物钟基因Timeless对卵巢癌SKOV3细胞凋亡和侵袭能力的影响*
2019-07-30粟连秀陈静平杨达平钟再婵黄丽芳宋建华韦翠容
粟连秀, 陈静平, 杨达平, 钟再婵, 黄丽芳, 宋建华, 韦翠容
(广西医科大学第八附属医院 1病理科, 2妇科, 广西 贵港 537100)
卵巢癌是继子宫内膜癌及宫颈癌发生率居第3的妇科恶性肿瘤,其死亡率居妇科恶性肿瘤之首[1]。治疗过程中肿瘤的复发和转移是卵巢癌相关性死亡的最主要原因[2]。因此,探寻卵巢癌的特异性治疗靶点具有十分重要的意义。生物钟基因Timeless(以下简称TIM)位于人类第12号染色体上,长约43 kb,编码产物为TIM蛋白,它可以与另一生物钟基因Per形成异二聚体,行使其调节生物节律的功能,是维持内源性生物钟运作的核心元件[3-4]。近年来研究表明,包括TIM在内的多种生物钟基因广泛参与恶性肿瘤的发生与发展,如乳腺癌[5]、肺癌[6]和肝癌[7]等。但TIM与卵巢癌的相关研究尚未见报道。本研究采用小干扰RNA(small interfering RNA, siRNA)技术沉默人卵巢癌SKOV3细胞中TIM表达,并分析TIM表达下调对卵巢癌SKOV3细胞凋亡和侵袭能力的影响,初步探讨TIM在卵巢癌治疗中的靶点作用,以期为卵巢癌的临床治疗提供理论依据。
材 料 和 方 法
1 实验材料
卵巢癌SKOV3细胞购于美国模式培养物集存库(American Type Culture Collection,ATCC)。LipofectamineTM2000购自Invitrogen;TIMsiRNA、siRNA对照、鼠抗人TIM单克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人Bax多克隆抗体、兔抗人基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)多克隆抗体和兔抗人MMP-9多克隆抗体均购自Santa Cruz;DMEM培养基和胎牛血清购自Gibco;凋亡检测试剂盒购自BD。
2 方法
2.1免疫组化染色 选取50例卵巢癌组织样本及50例正常卵巢组织样本。采用免疫组化染色检测卵巢癌组织及正常卵巢组织中TIM蛋白的表达。抗原修复采用煮沸修复法,免疫组化染色采用EnVision二步法。
2.2细胞培养 卵巢癌SKOV3细胞培养于含1%青霉素和链霉素及10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2培养箱中培养,每天换液1次。收集对数生长期细胞。
2.3转染及分组 待细胞生长至85%~90%汇合时,收集细胞,调节细胞浓度至2×109/L,将细胞接种于6孔培养板,每孔1 mL。细胞接种后24 h,将细胞分为3组,即空白对照(blank control)组、siRNA对照(siRNA control)组和TIMsiRNA组,siRNA对照组和TIMsiRNA组分别转染siRNA对照和TIMsiRNA,空白对照组未转染。转染操作参照LipofectamineTM2000说明书。转染之后,将细胞置于37 ℃、5% CO2培养,6 h后取出换液,之后继续培养48 h。
2.4Western blot检测蛋白表达 转染后48 h收集各组细胞,加入细胞蛋白裂解液提取总蛋白,定量蛋白浓度,行10% SDS-PAGE,转至PVDF膜,5%封闭液4 ℃封闭2 h,加入 I 抗(TIM、Bcl-2、Bax、caspase-3、caspase-9、MMP-2、MMP-9和β-actin,均1∶100),4 ℃摇床孵育过夜,加入 II 抗(1∶1 000)室温孵育2 h,ECL反应1~3 min,暗室曝光,显影、定影处理,Image-Pro Plus软件分析数据。
2.5流式细胞术检测细胞凋亡 转染后48 h收集各组细胞,预冷PBS缓冲液漂洗,调整细胞浓度至1×106个,离心、弃上清,加入500 μL结合缓冲液重悬细胞,依次加入Annexin V-FITC和propidium iodide各5 μL,室温避光孵育15 min,上流式细胞仪检测细胞凋亡。
2.6Transwell小室实验检测细胞侵袭能力 于小室上室铺上50 μL Matrigel(F12K培养基1∶3稀释),收集转染48 h后细胞,并将100 μL单细胞悬液加入上室,下室加入500 μL含20%FBS的F12K完全培养基,将细胞置于37 ℃、5% CO2培养48 h。弃上室液体,用棉签擦拭聚碳酸酯膜上层的细胞及Matrigel,用4%多聚甲醛固定滤膜下层,HE染色,倒置显微镜下观察,取5个视野,200倍镜下计数穿膜细胞。
3 统计学分析
采用SPSS 20.0分析。计量资料以均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(one-way ANOVA),两两比较采用Bonferroni校正的t检验;计数资料用例数(百分比)[n(%)]表示,组间比较采用2检验。以P<0.05为差异具有统计学意义。
结 果
1 免疫组织化学染色观察
TIM在正常卵巢组织中呈阴性表达,而在卵巢癌组织中呈阳性表达,表现为棕黄色着色,主要分布在细胞质及细胞周围,见图1。50例卵巢癌组织中TIM阳性表达率为84.0%(42/50),50例正常卵巢组织中TIM阳性表达率为10.0%(5/50),卵巢癌组织中TIM阳性表达率显著高于正常卵巢组织(P<0.01)。
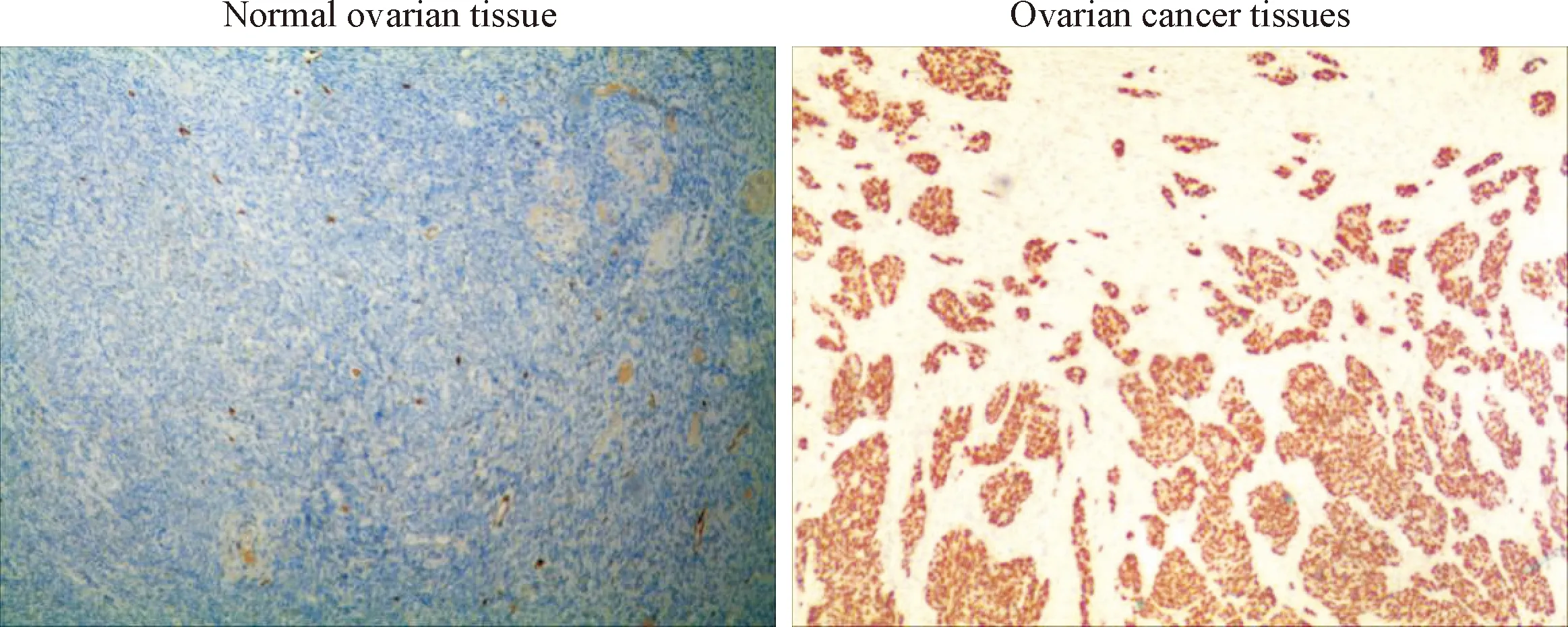
Figure 1.Immunohistochemical detection of TIM expression in normal ovarian and ovarian cancer tissues (×100).
图1 正常卵巢和卵巢癌组织中TIM表达的免疫组化检测结果
2 TIM表达与卵巢癌临床病理特征的关系
TIM蛋白表达与卵巢癌分化程度、浸润深度、淋巴结转移及TNM分期有关(P<0.05),而与年龄和病理类型无关(P>0.05),见表1。
表1 TIM表达与卵巢癌临床病理特征的关系
Table 1.The relationship between TIM expression and clinicopathologic features of ovarian cancer [n(%)]
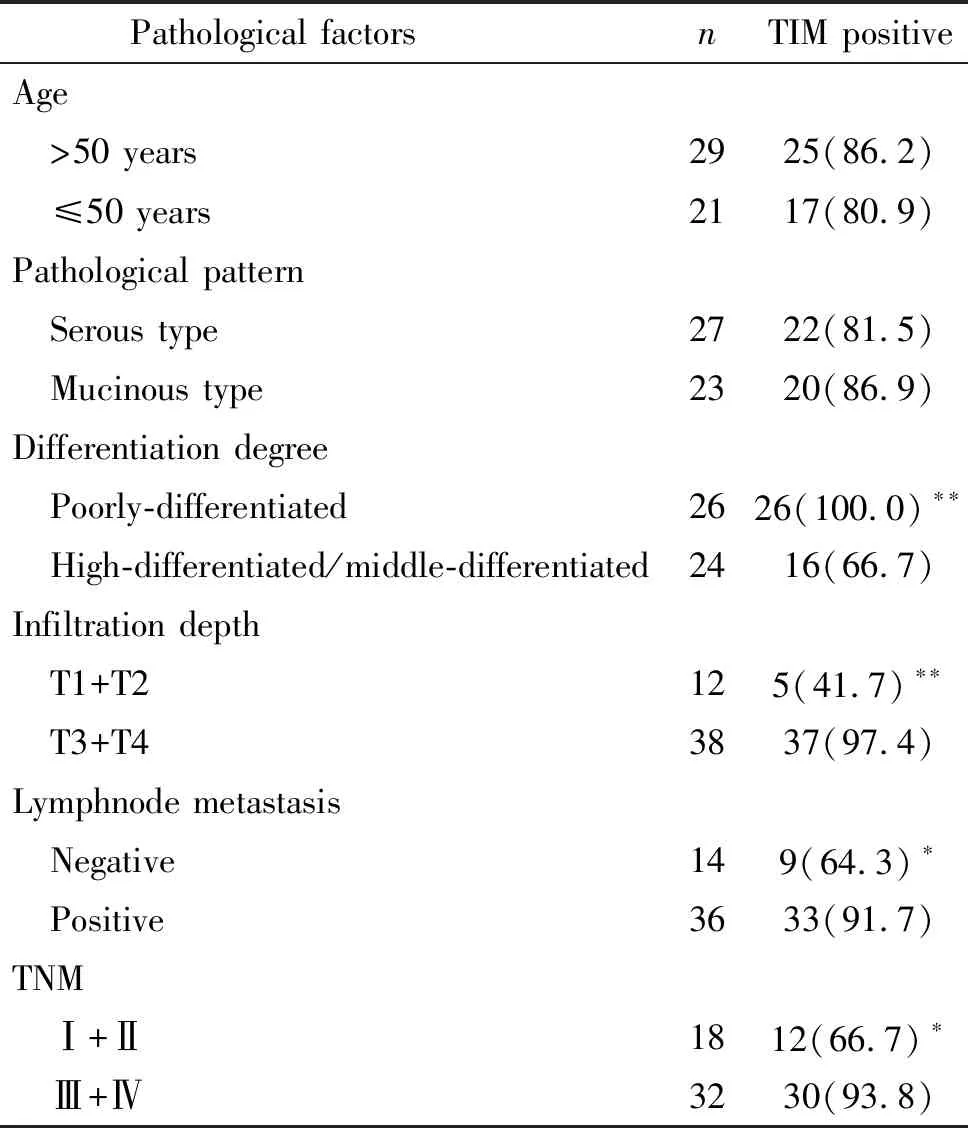
Pathological factors nTIM positiveAge >50 years2925(86.2) ≤50 years2117(80.9)Pathological pattern Serous type2722(81.5) Mucinous type2320(86.9)Differentiation degree Poorly-differentiated2626(100.0)∗∗ High-differentiated/middle-differentiated2416(66.7)Infiltration depth T1+T2125(41.7)∗∗ T3+T43837(97.4)Lymphnode metastasis Negative149(64.3)∗ Positive3633(91.7)TNM Ⅰ+Ⅱ1812(66.7)∗ Ⅲ+Ⅳ3230(93.8)
*P<0.05,**P<0.01vsother groups.
3 各组卵巢癌SKOV3细胞中TIM蛋白的表达
TIMsiRNA组中TIM的蛋白表达显著低于空白对照组和siRNA对照组(P<0.01);空白对照组和siRNA对照组之间TIM蛋白表达水平的差异无统计学显著性(P>0.05),见图2。
4 沉默TIM基因的表达对卵巢癌SKOV3细胞凋亡的影响
TIMsiRNA组细胞凋亡率显著高于空白对照组和siRNA对照组(P<0.01);空白对照组和siRNA对照组之间细胞凋亡率的差异无统计学显著性(P>0.05),见图3。
5 沉默TIM基因的表达对卵巢癌SKOV3细胞中Bcl-2和Bax蛋白表达的影响
TIMsiRNA组中Bcl-2蛋白表达显著低于空白对照组和siRNA对照组(P<0.01),而Bax蛋白表达显著高于空白对照组和siRNA对照组(P<0.01);空白对照组和siRNA对照组之间Bcl-2和Bax蛋白表达水平的差异无统计学显著性(P>0.05),见图4。
6 沉默TIM基因的表达对卵巢癌SKOV3细胞侵袭能力的影响
TIMsiRNA组的细胞穿膜数显著低于空白对照组和siRNA对照组(P<0.01);空白对照组和siRNA对照组之间细胞穿膜数的差异无统计学显著性(P>0.05),见图5。

Figure 2.Western blot was used to detected the TIM protein expression in blank control group, siRNA control group and TIM siRNA group. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图2 空白对照组、siRNA对照组和TIM siRNA组中TIM蛋白表达的Western blot检测结果

Figure 3.The apoptotic rate in blank control group, siRNA control group and TIM siRNA group was analyzed by flow cytometry. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图3 空白对照组、siRNA对照组和TIM siRNA组细胞凋亡率的流式细胞术检测结果
7 沉默TIM基因的表达对卵巢癌SKOV3细胞中MMP-2和MMP-9蛋白表达的影响
TIM siRNA组MMP-2和MMP-9蛋白表达显著低于空白对照组和siRNA对照组(P<0.01);空白对照组和siRNA对照组之间MMP-2和MMP-9蛋白表达水平的差异无统计学显著性,见图6。

Figure 4.The protein expression of Bcl-2 and Bax in blank control group, siRNA control group andTIMsiRNA group determined by Western blot. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图4 空白对照组、siRNA对照组和TIMsiRNA组中Bcl-2和Bax蛋白表达的Western blot检测结果
Figure 5.The invasion ability in blank control group, siRNA control group andTIMsiRNA group was detected by Transwell chamber test. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图5 空白对照组、siRNA对照组和TIMsiRNA组细胞侵袭能力的Transwell小室实验检测结果
8 沉默TIM对卵巢癌SKOV3细胞中caspase-3和caspase-9蛋白表达的影响
TIMsiRNA组中caspase-3和caspase-9蛋白表达显著高于空白对照组和siRNA对照组(P<0.01),见图7。

Figure 6.The protein expression of MMP-2 and MMP-9 in blank control group, siRNA control group andTIMsiRNA group was determined by Western blot. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图6 空白对照组、siRNA对照组和TIMsiRNA组中MMP-2和MMP9蛋白表达的Western blot检测结果

Figure 7.The protein expression of caspase-3 and caspase-9 in blank control group, siRNA control group andTIMsiRNA group determined by Western blot. Mean±SD.n=3.**P<0.01vsblank control group and siRNA control group.
图7 空白对照组、siRNA对照组和TIMsiRNA组中caspase-3和caspase-9蛋白表达的Western blot检测结果
讨 论
卵巢癌发病隐匿,缺乏早期的典型症状,故早期诊断困难,大多数患者确诊时已为晚期,并出现广泛的腹腔转移,根治手术难以实施。同时,由于化疗耐药等原因,卵巢癌5年生存率较低。当前,卵巢癌的临床诊疗存在“2个70%”:超过70%的卵巢癌患者确诊时已为晚期,约70%的卵巢癌患者在治疗后2年内复发[8]。因此,迫切需要明确卵巢癌的发病机制,提高其临床诊疗水平。
生物钟节律是指生物体对其所生存的周期性环境作出的一系列适应性反应。生物钟作为一种内源性定时体系,它可使机体行为和生理呈现近似24 h的节律,并以此调节血压、睡眠、激素分泌和免疫活动等生理过程。当机体受到外界环境影响时,如应激、辐射和药物等,可引起DNA损伤而使生物钟节律重新设置[9]。生物钟紊乱会增加包括恶性肿瘤在内的多种疾病的发生风险[10]。生物钟基因是产生和维持生物昼夜节律的分子基础,而TIM则是生物钟基因家族的重要成员之一[11]。Chi等[12]研究表明,过表达TIM有助于提高恶性肿瘤的存活及增殖,提示TIM表达上调对于促进肿瘤的发生发展具有重要作用。为了初步阐明Timeless在卵巢癌中的作用及机制,我们将TIM的特异性siRNA转染至卵巢癌SKOV3细胞,结果发现TIMsiRNA能显著下调卵巢癌SKOV3细胞中TIM蛋白表达,该结果为进一步研究TIM在卵巢癌中的功能奠定了基础。
凋亡抵抗是多种恶性肿瘤共有的特性,也是导致放化疗效果不佳的主要因素。Elgohary等[13]研究显示,TIM表达下调可显著诱导肝癌细胞凋亡,提示TIM对肝癌细胞凋亡具有调控作用。本研究中,为探讨TIM对卵巢癌SKOV3细胞凋亡的调控作用,我们分析了沉默TIM后卵巢癌SKOV3细胞凋亡率的变化。结果发现,转染TIMsiRNA可显著诱导卵巢癌SKOV3细胞凋亡。进一步分析凋亡相关蛋白Bcl-2和Bax表达变化发现,转染TIMsiRNA能显著降低Bcl-2的蛋白表达,并提高Bax、caspase-3和caspase-9蛋白表达。上述结果提示,沉默TIM可诱导卵巢癌SKOV3细胞凋亡,表现为抑凋亡蛋白Bcl-2表达下调,同时促凋亡蛋白Bax表达上调,其机制可能与caspase-3/caspase-9介导的凋亡信号通路启动有关。远处侵袭是肿瘤细胞最典型的生物学特征之一,在该过程中,基质金属蛋白酶(matrix metalloproteinase,MMP)参与其中,并发挥侵袭诱导作用。Reszka等[14]研究表明,在乳腺癌组织中,Per、Cry及Clock等大多数生物钟基因均呈现低表达,但TIM在其中却呈高表达,且在侵袭性乳腺癌中其表达上调更为显著,提示TIM可能具有介导肿瘤细胞远处侵袭的作用。本研究结果显示,转染TIMsiRNA可显著抑制卵巢癌SKOV3细胞侵袭水平,同时可显著降低MMP-2和MMP-9蛋白表达水平。上述结果提示,沉默TIM可降低卵巢癌SKOV3细胞侵袭能力,且机制可能与下调MMP-2和MMP-9表达有关。
综上所述,利用siRNA 沉默卵巢癌SKOV3细胞中TIM表达,可促进细胞凋亡,抑制细胞侵袭。
