TAK1通过调控p38 MAPK信号通路影响肾小管上皮细胞纤维化*
2019-07-30丁文飞刘海芸秦建华高利超欧三桃吴蔚桦
丁文飞, 宋 磊, 刘海芸, 秦建华, 曹 灵, 高利超, 欧三桃, 吴蔚桦△
(1西南医科大学附属医院肾病内科, 四川 泸州 646000; 江西省人民医院 2肾病内科, 3检验科, 江西 南昌 330006)
肾组织纤维化是常见慢性肾脏疾病发生的基础,其主要以肾小管间质纤维化和肾小球硬化为主要特征[1]。肾小管上皮细胞损伤是肾纤维化发生的基础,转化生长因子β1(transforming growth factor-β1, TGF-β1)具有促进肾小管上皮细胞分泌纤维化因子的作用[2],是肾组织纤维化发生的关键诱导因子之一。转化生长因子β激活激酶1(TGF-β activated kinase 1,TAK1)是一种典型的苏氨酸/丝氨酸蛋白激酶,经TGF-β的刺激而激活,参与胰岛素敏感、糖脂代谢和中枢神经系统发育等生理过程[3-4]。TAK1参与炎症、免疫反应和纤维化等相关疾病的发生,TAK1还可以通过调控细胞内多种信号的转导和基因的转录表达发挥多种生物学作用[5]。目前的研究显示,TAK1在肾组织纤维化发生时表达上调,并能够促进p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)信号通路的激活[6-7]。为了探讨TAK1在肾小管上皮细胞纤维化过程中的作用,本研究用TGF-β1刺激肾小管上皮HK-2细胞模拟构建肾小管上皮细胞纤维化模型,检测肾小管上皮细胞纤维化因子的表达情况,为明确肾组织纤维化发生机制提供依据。
材 料 和 方 法
1 材料
肾小管上皮细胞HK-2购自中国上海中科院细胞库。细胞培养液用含10%胎牛血清的DMEM/F12,细胞密度为90%时,用0.25%的胰蛋白酶消化传代,细胞在37 ℃、饱和湿度、5% CO2条件下培养。反转录试剂盒购自Promega;ECL显色试剂盒购自Perkin-Elmer Life Sciences;抗TAK1抗体和抗磷酸化TAK1Ser412(p-TAK1Ser412)抗体购自Jackson;I型胶原检测试剂盒和III型胶原检测试剂盒购自上海玉博生物科技有限公司 ;抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体和抗结缔组织生长因子(connective tissue growth factor,CTGF)抗体和抗p38 MAPK抗体购自PeproTech;抗磷酸化p38 MAPK(p-p38 MAPKThr 180/Tyr 182)抗体购自Santa Cruz;TGF-β1购自R&D Systems。
2 方法
2.1实验分组 HK-2细胞用含终浓度为10 μg/L和0 μg/L TGF-β1的细胞培养液培养24 h,记为TGF-β1处理组和对照(control)组,以real-time PCR和Western blot方法检测细胞中TAK1表达的变化。
2.2Real-time PCR检测TGF-β1诱导的HK-2细胞TAK1 mRNA的表达 收集HK-2细胞,在细胞中添加TRIzol裂解液,提取细胞中总RNA。以总RNA作为模板,合成cDNA,体系包括 0.5 μL AMV reverse transcriptase、0.5 μL random primer、1 μL dNTP mixture、2 μL sample RNA、2 μL RT buffer和0.5 μL RNase inhibitor,添加RNase free H2O至3.5 μL,按照42 ℃ 60 min,95 ℃ 5 min,5 ℃ 5 min进行逆转录。qPCR的反应体系为2.5 μL 10×PCR buffer、0.5 μL dNTP mixture、0.5 μL引物、0.5 μL Taq mix DNA polymerase、2.5 μL cDNA,添加RNase free H2O至25 μL。TAK1的上游引物序列为5’-ATTCCACAGATACAATGGCTC-3’,下游引序列为5’-TGTAGTAACAATGCGATTTGCC-3’;GAPDH的上游引物序列为5’-AGGGCATCTTGGGCTACAC-3’,下游引物的序列为5’-TGGTCCAGGGTTTCTTACTCC-3’; 由南京金斯瑞公司合成。扩增条件为94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 50 s,72 ℃ 5 min,共35个循环。内参照为GAPDH,根据反应的Ct值计算TAK1的表达水平。
2.3Western blot检测TGF-β1诱导的HK-2细胞TAK1蛋白的表达 将HK-2细胞收集以后,在细胞中添加PBS洗涤2次,加入含有PMSF的RIPA裂解溶液,反复吹打混合后,将细胞放在冰上混合孵育30 min。采用BCA法进行定量检测以后,将蛋白同1/5体积的loading buffer混合,100 ℃煮沸变性。将蛋白样品加入到上样孔中,每孔中添加30 μg蛋白样品,以120 V的电压电泳约2 h后,将凝胶从玻璃板中间取出。把PVDF膜放在甲醇中孵育10 s后转膜,转膜在4 ℃中进行。把PVDF膜放在新配置的5%牛血清白蛋白中,室温结合2 h。将抗TAK1和p-TAK1抗体按照1∶600稀释,将PVDF膜放在稀释的I抗反应液中,置于摇床上反应过夜。将 II 抗按照1∶2 000稀释后,将PVDF膜放置于其中,在室温中孵育2 h。以ECL法发光以后,扫描图像。用ImageJ分析条带的灰度值。GAPDH为内参照。
2.4慢病毒感染 HK-2细胞按照每孔加入5×104个细胞接种到6孔板中,放在培养箱中孵育培养,细胞融合度为40%左右时,按照MOI=20添加慢病毒载体,同时添加适量的polybrene(终浓度为5 mg/L),混合培养12 h以后,把旧培养液吸除,添加新鲜的细胞培养液,继续培养72 h,观察荧光表达情况,用1 mg/L的嘌呤霉素筛选稳定感染的细胞系。把稳定感染阴性对照慢病毒(sh-NC)和TAK1 shRNA慢病毒(sh-TAK1)的HK-2细胞用含终浓度为10 μg/L TGF-β1的细胞培养液培养,分别记为TGF-β1+sh-NC组和TGF-β1+sh-TAK1组。以real-time PCR和Western blot方法检测TGF-β1、TGF-β1+sh-NC和TGF-β1+sh-TAK1各组HK-2细胞培养24 h后TAK1表达水平的变化。同时,采用Western blot方法检测HK-2细胞中α-SMA、CTGF、p-p38MAPKThr 180/Tyr 182和p38 MAPK的蛋白水平。阴性对照慢病毒和TAK1 shRNA慢病毒由上海翊圣生物科技有限公司构建。
2.5细胞分泌I型胶原和III型胶原水平的检测 取各组HK-2细胞,培养24 h以后按照ELISA法检测培养液上清中I型胶原和III型胶原含量,步骤同试剂盒说明书。
2.6p38 MAPK通路激动剂anisomycin对下调TAK1的肾小管上皮细胞纤维化的影响 取稳定感染TAK1 shRNA的HK-2细胞,以含有p38 MAPK通路激动剂anisomycin (10 μmol/L)和TGF-β1 (10 μg/L)的细胞培养液培养,记为TGF-β1+sh-TAK1+anisomycin组,培养24 h后,ELISA法检测培养液上清中I型胶原和III型胶原含量,Western blot方法检测各组细胞中α-SMA、CTGF、p-p38 MAPKThr 180/Tyr 182和p38 MAPK蛋白的水平。
3 统计学处理
采用SPSS 21.0软件分析实验数据。所有实验重复3次,数据按照均数±标准差(mean±SD)表示,两组数据间比较用t检验,多组差异比较用单因素方差分析,各组均数间的两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 TGF-β1促进HK-2细胞中TAK1表达
与对照组相比,HK-2细胞经过TGF-β1处理以后,细胞中TAK1的mRNA和蛋白表达水平及p-TAK1Ser412的蛋白水平均升高(P<0.05),见图1。

Figure 1.TGF-β1 induced TAK1 expression at mRNA and protein levels in the renal tubular epithelial HK-2 cells. A: the mRNA levels of TAK1 were determined by real-time PCR; B:the protein levels of TAK1 and p-TAK1Ser412were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图1 TGF-β1诱导肾小管上皮细胞TAK1表达
2 TAK1 shRNA对TGF-β1诱导的HK-2细胞纤维化相关蛋白表达的影响
在HK-2细胞中感染TAK1 shRNA慢病毒后,经TGF-β1诱导处理,细胞中的p-TAK1Ser412蛋白、TAK1蛋白和mRNA均降低(P<0.05)。TAK1 shRNA能够下调TGF-β1刺激下HK-2细胞中TAK1的mRNA和蛋白水平。HK-2细胞经过TGF-β1诱导处理以后,细胞分泌的I型胶原和III型胶原水平均升高,细胞中α-SMA和CTGF表达水平升高(P<0.05);下调TAK1可以明显降低TGF-β1诱导处理的HK-2细胞分泌I型胶原和III型胶原,抑制TGF-β1诱导的HK-2细胞中α-SMA和CTGF蛋白表达和p38 MAPK磷酸化,见图2、图3A和表1。
3 p38 MAPK激活剂anisomycin对肾小管上皮HK-2细胞胶原合成及α-SMA和CTGF蛋白表达的作用
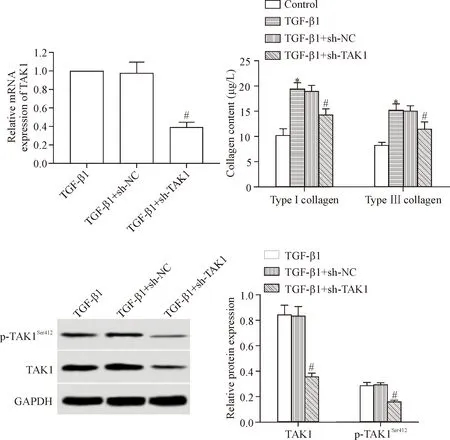
Figure 2.The effects ofTAK1knock-down by shRNA on the collagen secretion and phosphorylated TAK1 expresion in renal tubular epithelial HK-2 cells with TGF-β1 stimulation. Mean±SD.n=3.#P<0.05vsTGF-β1 group;*P<0.05vscontrol group.
图2 TAK1 shRNA对TGF-β1刺激下肾小管上皮HK-2细胞分泌胶原和TAK1磷酸化的影响

Figure 3.A: the effects ofTAK1knock-down by shRNA on the phosphorylation of p38 MAPK and the protein expression of α-SMA and CTGF in the renal tubular epithelial HK-2 cells with TGF-β1 stimulation. B: the effects of p38 MAPK activation on the protein expression of α-SMA and CTGF in the renal tubular epithelial HK-2 cells withTAK1knock-down.
图3 肾小管上皮HK-2细胞的p38 MAPK磷酸化及α-SMA和CTGF蛋白的表达
以p38 MAPK激活剂anisomycin处理敲减TAK1表达的肾小管上皮HK-2细胞,细胞中的p-p38 MAPK、 α-SMA和CTGF蛋白表达水平升高(P<0.05),见图3B和表2;细胞分泌的I型胶原、III型胶原增多(P<0.05),见图4。
表1 敲减TAK1表达对TGF-β1诱导的肾小管上皮HK-2细胞中α-SMA、CTGF和磷酸化p38 MAPK蛋白水平的影响
Table 1.The effect ofTAK1knock-down by shRNA on the phosphorylation of p38 MAPK and the protein expression of α-SMA and CTGF in the renal tubular epithelial HK-2 cells with TGF-β1 stimulation (Mean±SD.n=3)

Groupα-SMACTGFp-p38 MAPKThr 180/Tyr 182p38 MAPKControl0.21±0.030.29±0.040.23±0.040.59±0.05TGF-β10.51±0.06∗0.56±0.05∗0.45±0.06∗0.61±0.08TGF-β1+sh-NC0.47±0.050.57±0.070.44±0.080.60±0.04TGF-β1+sh-TAK10.38±0.03#0.42±0.06#0.31±0.03#0.59±0.07
*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.

Figure 4.The effects of p38 MAPK activation on the collagen type I and collagen type III synthesis in the renal tubular epithelial HK-2 cells withTAK1knock-down. Mean±SD.n=3.#P<0.05vsTGF-β1+sh-TAK1 group.
图4 激活p38 MAPK对敲减TAK1的肾小管上皮细胞I型胶原和III型胶原水平的影响
讨 论
肾组织纤维化是诱导终末期肾病发生的重要原因之一,肾组织纤维化发生时,肾小管上皮细胞功能异常,肾小管上皮细胞分泌的α-SMA和CTGF等纤维化因子及I型胶原和III型胶原等细胞外基质水平升高,导致肾脏中纤维化组织大量增生,破坏肾小管正常结构[8]。目前对于肾小管组织纤维化的发生机制研究尚不透彻,其中TGF-β1是肾组织纤维化发生的细胞因子之一,其在肾组织纤维化发生时含量升高,是一种纤维化促进因子[9-10]。本实验结果显示,TGF-β1处理后的肾小管上皮细胞分泌的I型胶原和III型胶原含量增多,细胞中α-SMA和CTGF蛋白水平升高,构建了TGF-β1诱导的肾小管上皮细胞纤维化模型。
TAK1最早是在人MAPK通路研究中发现的苏氨酸/丝氨酸蛋白激酶,其属于MAP3K蛋白家族成员,因其可以被TGF-β1等细胞因子激活而得名,TAK1蛋白由606个氨基酸构成,其羧基端是一个调节结构域,氨基端是一个激酶活性区域,此外,TAK1还含有一个ATP结合位点,能够调控TAK1酶活性[11-12]。TAK1与机体炎症和应激等有关,在人体不同组织中的表达水平不同,TAK1与人体正常胚胎发育和神经系统修复等有关[13-14]。近年来的研究表明,TAK1在肾组织纤维化中表达上调,福辛普利在减轻肾间质纤维化大鼠纤维化程度的同时可以下调TAK1的表达水平,TAK1可能在肾组织纤维化中发挥促进作用[7, 15-16]。本实验研究表明,TGF-β1处理后的肾小管上皮HK-2细胞中TAK1表达水平升高,并且敲减TAK1的表达可以抑制TGF-β1诱导的肾小管上皮HK-2细胞纤维化因子表达和合成,这证实了TAK1在肾小管上皮HK-2细胞纤维化中的作用。
表2 激活p38 MAPK对敲减TAK1的肾小管上皮HK-2 细胞中α-SMA和CTGF蛋白水平影响
Table 2.The effect of p38 MAPK activition on the protein levels of α-SMA and CTGF in the renal tubular epithelial HK-2 cells after knock-down ofTAK1expression (Mean±SD.n=3)

Groupα-SMACTGFp-p38 MAPKThr 180/Tyr 182p38 MAPKTGF-β1+sh-TAK10.36±0.050.39±0.040.38±0.050.69±0.07TGF-β1+sh-TAK1+anisomycin0.75±0.09#0.68±0.05#0.52±0.06#0.70±0.08
#P<0.05vsTGF-β1+sh-TAK1 group.
目前对于TAK1生物学功能相关机制的研究表明,TAK1可以通过三级激酶激活下游p38 MAPK信号通路,基因敲除TAK1的小鼠中p38 MAPK信号被抑制,RNAi技术下调人视网膜色素上皮细胞中TAK1的表达可以抑制细胞中p38 MAPK的磷酸化[17-18]。p38 MAPK是MAPK信号通路中功能最为广泛的分支之一,其在人体组织中广泛存在,参与调控细胞生长、炎症反应和氧化应激等过程[19-21]。p38 MAPK与纤维化疾病的发生有关,其在肾组织纤维化中过度激活,具有促进肾组织纤维化的作用[22-23]。本实验表明,TGF-β1处理后的肾小管上皮HK-2细胞中p38 MAPK磷酸化水平升高,下调TAK1可以降低肾小管上皮HK-2细胞中p38 MAPK磷酸化水平,并且p38 MAPK激活剂可以逆转敲减TAK1表达对肾小管上皮HK-2细胞纤维化的抑制作用,敲减TAK1表达通过抑制p38 MAPK信号发挥抗肾小管上皮细胞纤维化的作用。
