色胺混合模式层析介质制备及配基密度影响研究*
2019-07-26李明昊栾浩飞韩得满
施 伟,李明昊,栾浩飞,韩得满
(台州学院 医药化工与材料工程学院,浙江 台州 318000)
0 引言
混合模式层析(mixed-mode chromatography,MMC),作为近年来日益受到关注的新型层析模式,拥有独特的多模式吸附原理,配基兼有多种功能基团,因而吸附容量高,选择性较好,并具有pH依赖性以及耐盐吸附等特色,可以避免对料液进行稀释及加盐处理[1-4]。如典型的混合模式配基,4-巯乙基吡啶(MEP)[5],2-巯基-1-甲基咪唑(MMI)[6]、2-巯基苯并咪唑(MBI)[7],5-氨基苯并咪唑(ABI)[8]等,在pH中性条件下,配基中的疏水基团可以通过疏水作用结合蛋白;当pH下降至配基的pKa以下时,配基与蛋白同时携带正电荷,两者通过静电排斥作用实现解吸。近年来的研究证明了混合模式层析拥有良好的蛋白分离应用潜力[1,2]。因此,对于混合模式层析的深入研究可以促进新配基的开发与分离过程的优化。配基密度是评价层析介质的重要指标,但对于混合模式配基密度的影响研究仍显不足,阻碍了混合模式层析的进一步发展。
配基密度对于层析介质吸附容量与吸附速率都有重要影响,许多研究者对其进行了相关研究[9-12]。如Fang Cheng等人[9]提出一种基于二乙烯砜的新型介质活化方法,通过控制反应时间,实现了MEP配基密度的可控制备,他们证实高的配基密度可以提升介质对抗体(IgG)的亲和力及动态吸附能力。Hong-Fei Tong等人[5]则利用分子模拟技术从分子层面研究了抗体,抗体片段与MEP配基网络之间的作用力,结果表明配基密度对吸附产生了显著的影响,高配基密度提供了更高的结合能,有利于蛋白吸附。还有Hui-Li Lu 等人[6]以 MMI为对象,制备了配基密度范围 50 μmol/g~110 μmol/g 的介质,结果显示了100 μmol/g的介质具有最高的吸附选择性,意味着配基密度存在一个最佳范围。对于其他模式的层析技术,如离子交换层析,反相层析等,也有相关研究[13-16]表明在一定范围内,更高的配基密度有利于吸附容量与吸附速率的提升。
本研究中,将选用新型混合模式配基色胺(Tryptamine)作为对象。色胺作为新近受到关注的一种配基,被发现在蛋白纯化中拥有较大的潜力,特别对于血清白蛋白有较好的效果[17]。但对于色胺配基密度的影响仍然缺乏系统的研究,使得在色胺介质制备过程中存在一定盲目性,阻碍了其研究和应用的进一步开展。为此,本研究通过控制介质制备过程中的偶联程度,制备一系列不同配基密度的混合模式介质(4FF-Try),以更加多样的实验手段,包括傅里叶红外光谱(FTIR),扫描电镜(SEM)和氮气吸附-脱附实验(BET),对介质进行了表征,研究了配基密度对于介质结构的影响,并使用牛血清白蛋白(BSA)作为模型蛋白,通过静态吸附与吸附动力学考察pH和盐对于不同配基密度介质吸附性能的影响,加深配基密度在层析介质吸附中的研究。
1 实验部分
1.1 实验试剂和仪器
色胺(Tryptamine):J&K 科技有限公司(中国);4%交联琼脂糖包埋石英砂(4 Fast Flow,4FF):博格隆(上海)生物技术有限公司;牛血清白蛋白(BSA,67 KDa):美国Sigma有限公司;其他为市售分析纯级别试剂。
傅里叶变换红外光谱测量(FTIR):Nicolet 5700(赛默飞世尔科技);紫外光谱测量:UV-2450(日本岛津公司);电镜扫描(SEM):日立S-4800场发射扫描电子显微镜;氮吸附-脱附等温线测量(BET):GEMINI-V。
1.2 介质制备及配基密度测定
色胺混合模式层析介质制备流程参考文献[17,18],并进行适当改进,原理如图1所示。4%交联琼脂糖介质 4FF清洗抽干,取 2 g,与 NaOH,烯丙基溴(Allyl Bromide,AB)及 20%二甲基亚砜(Dimethyl Sulphoxide,DMSO)混合,置于30℃,150 rpm条件下进行活化反应24 h。活化后介质清洗,以三倍活化密度N-溴代琥珀酰亚胺(N-bromosuccinimide,NBS)进行溴化。之后加入2 mL 1 mol/L碳酸盐缓冲液(pH11.5)及不同量(0.4,0.6,0.8及 1 g)的配基。150 rpm,30℃偶联反应 24 h。反应结束,介质进行充分清洗,存于20%乙醇(V/V)中备用。该介质命名为4FF-Try。
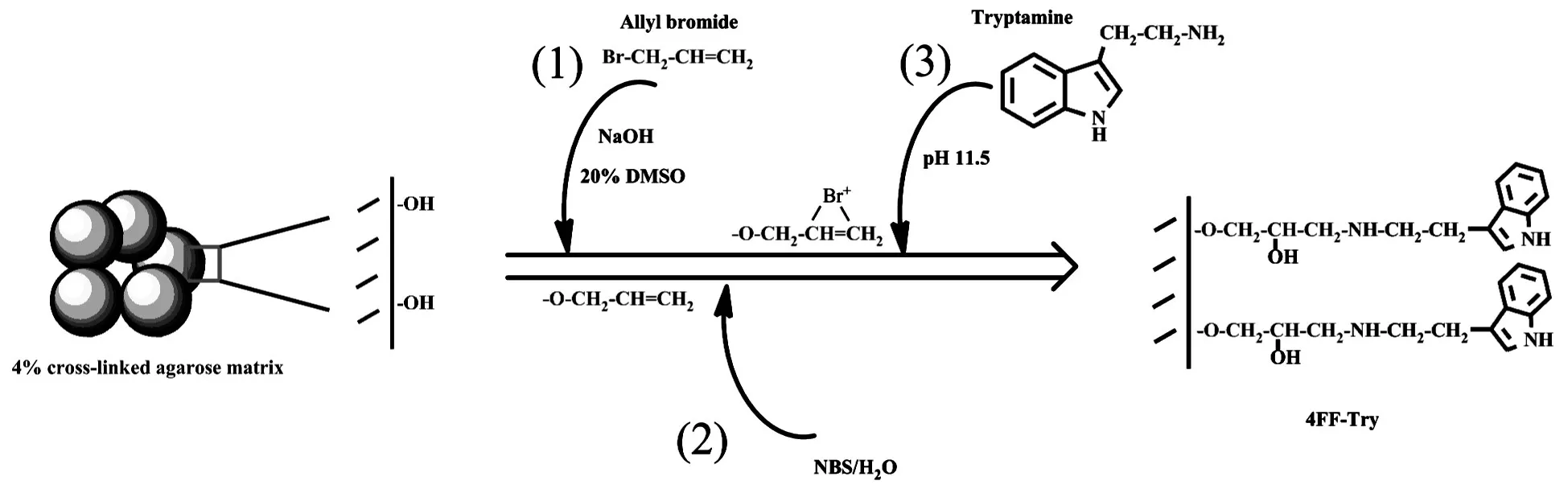
图1 4FF-Try介质制备原理图Fig.1 Preparation scheme for 4FF-Try resins
配基密度测定:4FF-Try用去离子水进行充分清洗,再用0.1 mol/L HCl和0.1 mol/L NaOH浸泡清洗3遍,最后清洗抽干后称取1 g介质,与5 mL 0.5 mol/L NaCl溶液混合,用0.1 mol/L HCl标准溶液进行滴定。计算配基偶联密度。
1.3 介质表征与浓度测定
对基质4FF和介质4FF-Try进行傅里叶红外光谱测定,检测偶联前后琼脂糖微球成分变化,证实制备成功与否。利用扫描电镜对介质进行观察,表征4FF-Try形态与表面结构。通过氮气吸附-脱附实验测定介质表面积,孔道体积以及孔道直径。蛋白浓度检测通过紫外光谱测定获得。
1.4 静态吸附平衡
静态吸附平衡实验参考文献[19]。配制pH范围为5.0~8.0的缓冲液:pH4.0和pH5.0为20 mmol/L乙酸钠缓冲液;pH6.0、pH7.0和pH8.0为20 mmol/L磷酸钠缓冲液。介质清洗抽干分别称取0.04 g放入若干2 mL离心管。BSA溶于不同pH的缓冲液中,配制浓度范围为0.25 mg/mL~4 mg/mL的蛋白溶液,各取1.8 mL与介质混合,并置于恒温混匀仪中,1000 rpm、25℃平衡吸附3 h。达到吸附平衡后,取上清,测定吸光度(280nm),计算蛋白浓度。计算依据物料平衡原理,公式如下:

式中:Q*为单位体积介质的吸附容量(mg/g介质),C0为蛋白初始浓度(mg/mL),C*为平衡时蛋白浓度(mg/mL),V 为蛋白溶液体积(mL),m 为介质质量(g),ρp为介质湿真密度(mg/mL)。
吸附等温线,采用Langmuir吸附平衡方程进行拟合,公式如下:

式中:Qm为饱和吸附容量(mg/g介质),Kd为解离常数(mg/mL),C*为吸附平衡时蛋白浓度(mg/mL)。
缓冲液加入不同浓度NaCl(0.2 mol/L,0.4 mol/L和0.8 mol/L),采用上述方法测定并拟合吸附等温线,考察盐对蛋白静态吸附的影响。
1.5 吸附动力学
介质清洗抽干分别称取0.04 g放入一系列2 mL离心管。将BSA溶于缓冲液中,配制浓度为4 mg/mL的蛋白溶液,取1.8 mL与介质混合,并置于恒温混匀仪中,1000 rpm,25℃进行吸附。每隔一定时间,过滤,终止吸附,测定蛋白溶液吸光度(280 nm),计算蛋白浓度。
2 结果与讨论
2.1 介质表征
如图2红外光谱图所示,4FF-Try上出现740 cm-1左右的特征峰,该峰由N-H振动产生,是由色胺引入介质中,而基质4FF上则无此峰存在,证明配基已被偶联在4FF基质上,新型混合模式介质4FFTry制备成功。改变配基加入量,制备4种不同配基密度的4FF-Try。配基密度随配基加入量变化如图3所示,获得配基密度分别为 40±3,62±3,79±4 及 110±5 μmol/g 介质。与报道的文献相比[17],在所制备的配基密度范围内,配基密度随着配基加入量的增加同样呈线性增加,但本研究中配基密度范围更大,具有更好的代表性。依次命名 4 种介质为 4FF-try(40),4FF-try(60),4FF-try(80)及 4FF-try(110)。
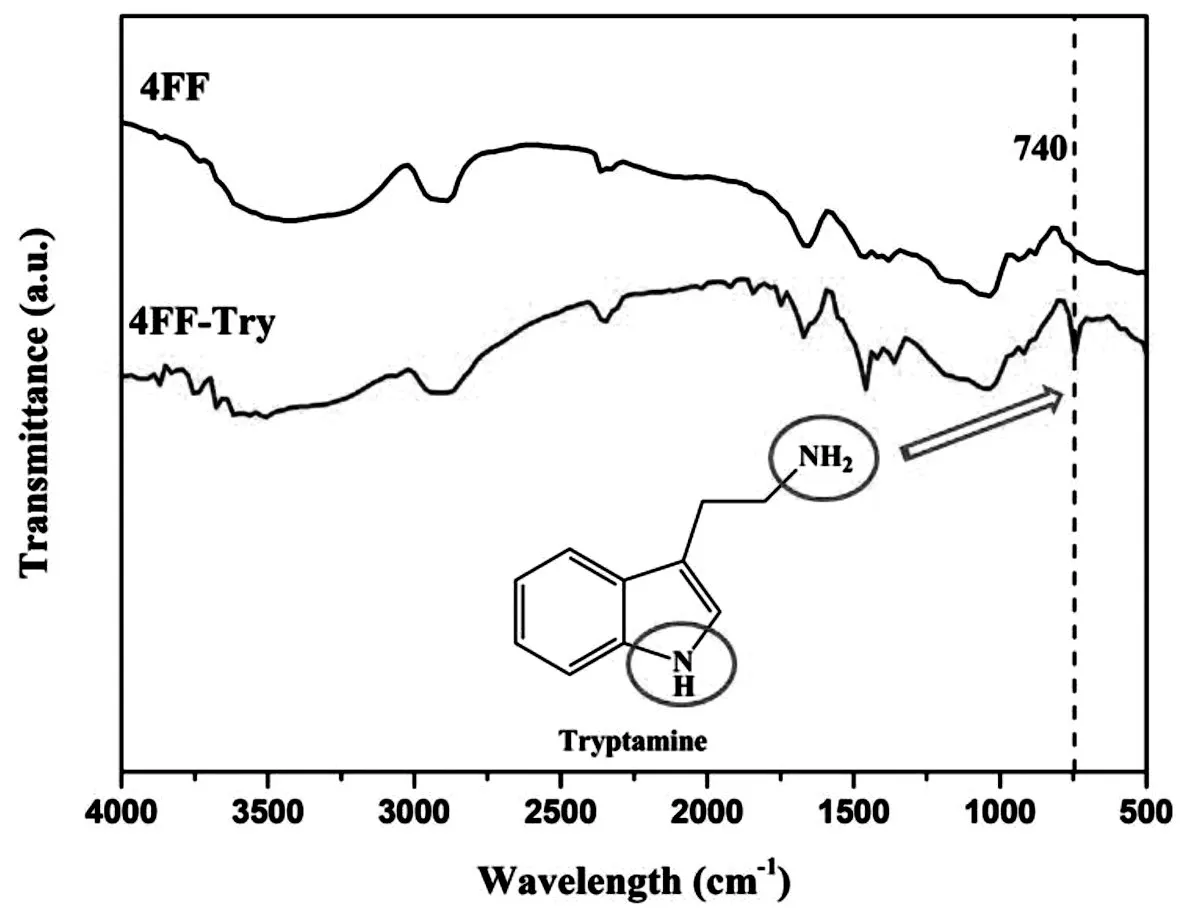
图2 4FF与4FF-Try红外光谱图Fig.2 FTIR of 4FF,4FF-Try

图3 色胺配基密度随色胺用量的变化Fig.3 Effects of ligand addition on ligand density
图4 为4种介质的电镜扫描图,如图所示,配基密度的不同并未对介质形态结构产生明显影响,4种介质表面皆光滑平整,孔道结构清晰。进一步通过氮气吸附-脱附实验对介质的表面积与孔道参数进行测定,结果如图5所示。4种介质在表面积,孔道体积与孔道直径方面表现相似,测定的范围分别为146.2 m2/g~161.9 m2/g,0.93 m3/g~1.11 m3/g及21.5 nm~26.0 nm,进一步表明配基密度对介质形态结构影响较小。

图 4 4FF-Try(40)(A),4FF-Try(60)(B),4FF-Try(80)(C)及 4FF-Try(110)(D)扫描电镜图Fig.4 SEM images(5μm) of 4FF-Try(40)(A),4FF-Try(60)(B),4FF-Try(80)(C)and 4FF-Try(110)(D)
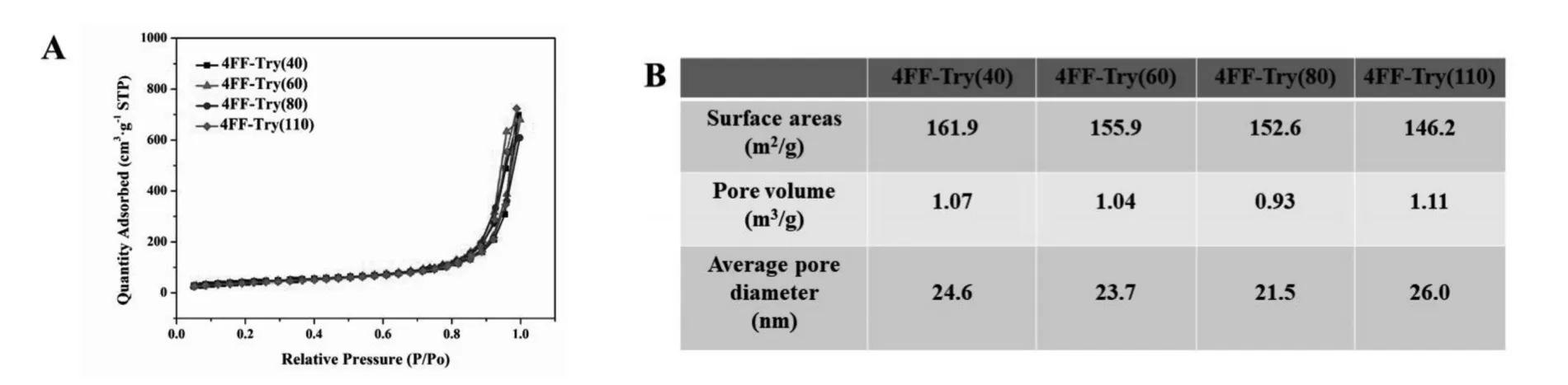
图 5 4FF-Try(40),4FF-Try(60),4FF-Try(80)及 4FF-Try(110)氮气吸附-脱附图(A)及相关参数(B)Fig.5 Nitrogen adsorption desorption isotherms(A) and relative parameters(B) of 4FF-Try(40),4FF-Try(60),4FF-Try(80) and 4FF-Try(110)
2.2 吸附等温曲线
以BSA作为模型蛋白,首先考察不同pH条件下4种不同配基密度介质的静态吸附性能,并以Langmuir拟合数据。从图6可见,pH对介质吸附BSA产生了显著影响,呈现典型的pH依赖性。pH 4.0条件下,因配基与BSA同时带有正电荷,产生静电斥力,4种介质的蛋白吸附量极小,无法进行拟合。pH5.0~8.0条件下,Langmuir拟合良好,可获得饱和吸附容量Qm及解离常数Kd。其中pH5.0位于BSA等电点附近,蛋白疏水区域大量暴露,产生疏水作用力,因此拥有更大的Qm及更小的Kd。但随着pH值增加,配基与蛋白间疏水作用力逐渐下降,致使吸附等温线变得平坦,难以在所处浓度范围达到“饱和平台期”,继续采用Qm对不同pH及不同配基密度介质的吸附容量进行比较并不合适。因此引入蛋白吸附密度(Qc)概念[20-22],即根据Langmuir拟合计算获得的特定蛋白平衡浓度下的介质吸附容量。在本研究中,选择4 mg/mL作为比较浓度,结果显示于表1。从表中数据可知,4个配基密度的介质在所测pH范围内的吸附密度Qc都呈现“U”型变化,即pH4.0吸附密度最小,pH5.0最大,之后随pH增加逐渐减小。横向比较吸附密度随配基密度变化情况,同样发现“U”型趋势。即配基密度在80 μmol/g以下时,随着配基密度增加,介质对BSA吸附能力逐渐增强。但当配基密度继续增大到110 μmol/g时,Qc反而减小。推测原因可能为过多的配基造成了空间位阻效应,使BSA的扩散与吸附变得困难。与文献相比,Wu等人[17]所制备的色胺介质(约150 μmol/g)对人血清白蛋白拥有141.33 mg/g的吸附容量。本研究则以80 μmol/g的配基密度实现了74.5 mg/g的吸附容量,两者单位配基密度所实现的吸附容量相近。解离常数Kd的变化也符合不同pH以及不同配基密度的变化趋势。即pH5.0时Kd最小,高于或低于此pH值,Kd发生增加,蛋白与介质之间的亲和力减少。另外,随着配基密度的增加,Kd逐渐减小,直至80 μmol/g,之后发生增加。说明过高的配基密度会减小蛋白与介质之间的亲和力。从目前所得数据可知,4FF-Try的最佳配基密度范围在60 μmol/g~80 μmol/g,介质制备可参考此范围。此外,使用最佳配基密度范围进行介质制备也减少了过高的配基加入量导致的成本升高。
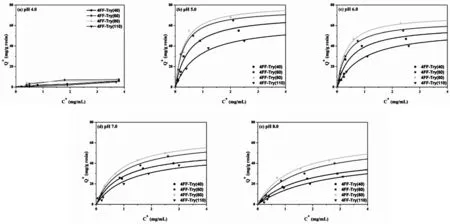
图 6 4FF-Try(40)(a),4FF-Try(60)(b),4FF-Try(80)(c)及 4FF-Try(110)(d)在不同 pH 下吸附等温线Fig.6 Adsorption isotherms of BSA on 4FF-Try(40)(a),4FF-Try(60)(b),4FF-Try(80)(c)and 4FF-Try(110)(d) at different pH values

表14 FF-Try(40),4FF-Try(60),4FF-Try(80)及4FF-Try(110)在4 mg/mL平衡浓度下的蛋白吸附密度Qc(pH4.0~8.0)Table.1 The QcSof of BSA on 4FF-Try(40),4FF-Try(60),4FF-Try(80) and 4FF-Try(110)at the equilibrium liquid-phase concentration of 4 mg/mL(pH 4.0~8.0).
耐盐性吸附是混合模式层析的一个优势,因此在本研究中也考察了盐的浓度对不同配基密度介质吸附的影响。本研究中选择中性盐NaCl进行添加,浓度设为0.2 mol/L,0.4 mol/L和0.8 mol/L。结果如图7和表2所示。从图7可见,不同盐浓度下的吸附等温数据仍能通过Langmuir进行良好的拟合,但其“饱和平台期”更加难以实现,因此仍然使用蛋白吸附密度Qc进行比较。从表2数据可知,4种配基密度的4FF-Try都保持了良好的耐盐吸附能力,即使盐浓度高达0.8 mol/L,仍然具有一定程度的Qc。值得注意的是,随着配基密度增加,介质对蛋白的Qc下降趋势减缓,意味着更高的配基密度范围对盐浓度的耐受能力更大。原因可能在于更高的配基密度提供了更多的蛋白结合位点。此外,与无盐条件吸附相比,加盐后4种介质的Kd急剧增加,可能是由于大量盐的存在屏蔽了配基与蛋白之间的氢键作用,使蛋白与介质间的亲和力下降,只能以较慢的速率进行吸附。

图 7 4FF-Try(40),4FF-Try(60),4FF-Try(80)及 4FF-Try(110)在不同盐浓度 0.2M(a),0.4M(b)及 0.8M(c)条件下吸附等温线Fig.7 Adsorption isotherms of BSA on 4FF-Try(40),4FF-Try(60),4FF-Try(80) and 4FF-Try(110) at different NaCl concentration (0.2 M(a),0.4 M(b)and 0.8 M(c))
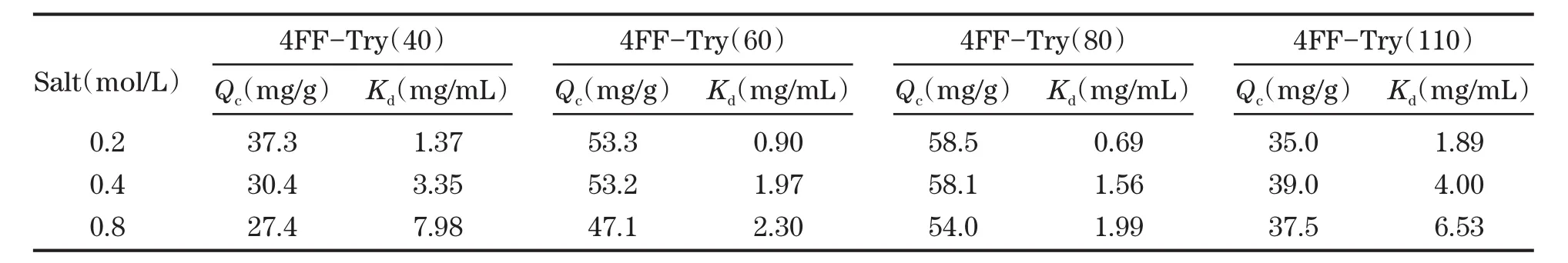
表 2 4FF-Try(40),4FF-Try(60),4FF-Try(80)及 4FF-Try(110)在 4mg/mL 平衡浓度下的蛋白吸附密度Qc(NaCl 0.2~0.8 mol/L)Table.2 The QcSof of BSA on 4FF-Try(40),4FF-Try(60),4FF-Try(80) and 4FF-Try(110)at the equilibrium liquid-phase concentration of 4 mg/mL(NaCl 0.2~0.8 mol/L)
2.3 吸附动力学
图8显示了不同配基密度的4FF-Try在pH 5.0及0 mol/L NaCl条件下的吸附动力学。从图中可知,4FFTry(40)达到吸附平衡的速率最快,在10 min左右,该介质的吸附即趋于平衡。随着配基密度的增加,吸附平衡达到时间发生延迟,大约增加到20 min左右。分析原因,可能是配基密度的增加,降低了蛋白在介质孔道中的扩散速率,因此介质制备时,最佳配基密度的选择应该充分考虑吸附速率与吸附容量之间的关系。

图 8 4FF-Try(40),4FF-Try(60),4FF-Try(80)及 4FF-Try(110)吸附动力学Fig.8 Adsorption kinetics curves of BSA on 4FF-Try(40),4FF-Try(60),4FF-Try(80) and 4FF-Try(110)
3 结论
本研究中以色胺为配基,制备了一系列不同配基密度的新型混合模式介质4FF-Try。通过FTIR,SEM及BET对所制备介质的成分与结构进行表征,证明4FF-Try制备成功,拥有良好的孔道结构,并且配基密度的高低并未对介质结构产生显著影响。静态吸附实验表明存在最佳配基密度范围,小于此密度,吸附性能随配基密度增加而增加;高于此密度则会由于空间位阻效应,产生吸附性能下降。4种介质保持了良好的耐盐吸附能力,耐盐能力随配基密度增加,有一定程度提升。吸附动力学实验进一步表明高配基密度有利于吸附容量提升但高于一定范围后会显著影响吸附速率。基于以上结果,本研究证明新型混合模式介质介质4FF-Try制备过程中存在一个最佳配基密度范围(60 μmol/g~80 μmol/g),在介质制备与分离过程优化中应予以充分考虑。通过本研究,对于新型混合模式介质——色胺介质的制备与性能有了进一步的了解,有助于于混合模式层析的进一步发展。
