PEP-1-SOD1对SAP大鼠细胞凋亡的影响*
2019-07-09田书芳
吕 飞 田书芳
湖北省十堰市人民医院消化内科1(442000) 中医科2
重度急性胰腺炎(severe acute pancreatitis, SAP)是以胰腺弥漫性出血和组织坏死为特征,由多种病因导致胰酶在胰腺内被激活后累及全身多个脏器的危重疾病,病死率一般>10%[1-2]。SAP的发病机制目前尚未完全明确,可能与氧化应激、内质网应激等多种因素有关。现有研究认为,在SAP的发生、发展过程中伴随大量炎性介质的释放,其炎症程度与腺泡细胞凋亡呈负相关。超氧化物歧化酶(SOD)是体内重要的氧自由基清除剂,清除自由基和调节细胞凋亡是SAP的有效治疗靶点之一。PEP-1-SOD1是一种利用基因工程技术合成的融合蛋白,具有高度的稳定性,能携带多种肽段和蛋白质以天然活性形式进入细胞,该过程无需任何化学共价结合或变性步骤,具有较好的安全性[3]。有研究证实PEP-1-SOD1可转导进入缺血/再灌注损伤后大鼠的大脑皮质并发挥保护神经元的作用[4],但对SAP的作用尚未见相关报道。本研究通过观察PEP-1-SOD1对SAP大鼠细胞凋亡的影响,旨在为探讨PEP-1-SOD1的作用机制提供参考。
材料与方法
一、实验动物、主要试剂
24只雄性Wistar大鼠购自北京联通利华生物技术有限公司[许可证编号:SCXK(京)2016-0001],体质量22~24 g,10周龄。血清淀粉酶和脂肪酶检测试剂盒均购自南京建成生物工程研究所,TUNEL细胞凋亡检测试剂盒购自上海罗氏制药有限公司,caspase-3单克隆抗体和内参β-actin抗体购自美国Santa Cruz公司(工作浓度1∶500),二抗购自美国Abcam公司(工作浓度1∶2 500)。Trizol试剂购自美国Invitrogen 公司,PCR试剂盒购自美国Life Technologies公司。牛磺胆酸钠购自北京奥博星生物技术责任有限公司。
二、研究方法
1. 动物分组、模型建立和处理:将所有大鼠随机分为对照组、SAP组和实验组,每组各8只。SAP动物模型的建立参照郭婉薇等[2]的方法。使用一次性静脉留置套管针对系膜缘的肠壁进行穿刺,逆行插入胆胰管,阻断胆总管后,匀速注射5%牛磺胆酸钠(1 mL/kg),注射速率为0.1 mL/min。注射完毕5 min后拔管,回纳十二指肠后关腹。实验组在造模前30 min腹部皮下注射8.0 mg/kg PEP-1-SOD1(美国BD公司)。SAP组大鼠注射同剂量的0.9% NaCl溶液。对照组常规进行饲养管理。
将所有大鼠麻醉后心脏采血,4 ℃ 3 000 r/min离心10 min,-20 ℃冻存备测。取血后处死大鼠,取病变较为一致的胰头部组织,置于4%甲醛溶液中固定,4 μm厚连续切片,行后续检测。
2. TUNEL法检测胰腺腺泡细胞凋亡:选择三组大鼠病理切片,二甲苯脱蜡后,加入TUNEL反应液与转化剂-POD,DAB显色,光学显微镜下观察并计数,计算凋亡指数。
3. 血清脂肪酶、淀粉酶的测定:术后24 h,采用全自动生化分析仪检测血清脂肪酶、淀粉酶水平。
4. 胰腺组织病理学评分:胰腺组织标本行HE染色,在光学显微镜下由病理科医师行双盲评分。0分:胰腺组织清晰,无炎症;2分:胰腺炎症区域所占比例≤5%;4分:6%~25%;6分:26%~50%;8分:51%~75%;10分:>75%。
5. 荧光定量PCR法检测caspase-3 mRNA表达:采用Trizol一步法提取胰腺组织总RNA,并反转录为cDNA,行荧光定量PCR。扩增引物由生工生物工程(上海)股份有限公司合成,上游:5’-CGG GTG TCA GGA ATC AAA TC-3’,下游:5’-TGG AAG GTC TCG CAA ATA CTG-3’,片段长度275 bp。反应条件:95 ℃ 5 min;95 ℃ 45 s,57 ℃ 45 s,72 ℃ 60 s,共30个循环;72 ℃终延伸10 min。采用2-ΔΔCt法检测caspase-3 mRNA表达水平。
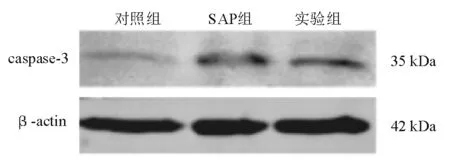
6. 蛋白质印迹法检测caspase-3蛋白表达:具体步骤按试剂盒说明书进行操作。以β-actin作为内参,蛋白表达量=各处理组蛋白条带的光密度值/内参蛋白条带的光密度值。
三、统计学分析
结 果
一、脂肪酶、淀粉酶水平比较
造模后24 h,SAP组和实验组大鼠血清脂肪酶、淀粉酶水平较对照组均显著升高(P<0.05),而实验组显著低于SAP组(P<0.05)(表1)。
二、组织病理学评分比较
实验组大鼠胰腺小叶间隙增宽,可见中性粒细胞和单核细胞浸润,但小叶结构相对完好;SAP组大鼠胰腺组织结构破坏明显,小叶排列紊乱,局部血管壁出血、坏死;对照组未见明显异常(图1)。
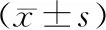
表1 三组大鼠血清脂肪酶、淀粉酶水平比较
*与对照组比较,P<0.05;#与SAP组比较,P<0.05

A:对照组;B:SAP组;C:实验组
造模后6 h、24 h,SAP组和实验组大鼠胰腺组织病理学评分均显著高于对照组(P<0.05),而实验组显著低于SAP组(P<0.05)(表2)。
三、细胞凋亡情况
造模后6 h、24 h,实验组和SAP组胰腺细胞凋亡指数均显著高于对照组(P<0.05),而实验组显著高于SAP组(P<0.05)(表3)。
四、caspase-3表达情况
造模后24 h,实验组和SAP组胰腺组织caspase-3 mRNA和蛋白表达均显著高于对照组(P<0.05),而实验组显著高于SAP组(P<0.05)(表4、图2)。
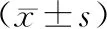
表2 三组大鼠胰腺组织病理学评分比较
*与对照组比较,P<0.05;#与SAP组比较,P<0.05
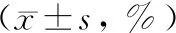
表3 三组大鼠胰腺细胞凋亡指数比较
*与对照组比较,P<0.05;#与SAP组比较,P<0.05
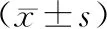
表4 三组大鼠胰腺组织caspase-3 mRNA和蛋白表达比较
*与对照组比较,P<0.05;#与SAP组比较,P<0.05
1 Da=0.992 1 u
SAP是常见急腹症之一,具体的发病机制尚不明确。相关研究认为,发生SAP时,在损伤因子作用下,单核细胞被激活并释放多种细胞因子,导致全身炎症反应综合征,严重情况下患者可出现多器官功能不全甚至死亡[5-6]。SAP的诊治已成为目前的研究热点。PEP-1是人工合成的细胞穿透肽,包含一个三肽SQP组成的连接序列、一个富含赖氨酸的亲水性序列(KKKRKV)和一个富含色氨酸的疏水性序列(KETWWETWWTEW)。PEP-1可介导细菌胞外酶、过氧化氢酶、绿色荧光蛋白、核糖体蛋白以天然活性形式转导进入离体或在体的细胞中,从而有效发挥生物学效应[7]。SOD1主要存在于真核细胞的胞质内,可有效清除氧自由基,使细胞免受氧化损伤。有研究表明PEP-1与SOD1融合后,可使后者的半衰期延长,稳定性提高[8]。本研究显示造模后24 h,SAP组和实验组大鼠血清脂肪酶、淀粉酶水平较对照组均显著升高(P<0.05),而实验组显著低于SAP组(P<0.05);造模后6 h、24 h,SAP组和实验组胰腺组织病理学评分均显著高于对照组(P<0.05),而实验组显著低于SAP组(P<0.05)。说明PEP-1-SOD1能缓解SAP病情,减轻大鼠胰腺组织的病理损害。
细胞凋亡是受众多凋亡相关基因调控的程序性细胞死亡,胰腺腺泡细胞凋亡可保护腺泡细胞损伤,并可减轻SAP病情[9]。腺泡细胞死亡是SAP炎症过程中的重要病理特征,腺泡细胞的坏死和凋亡共同存在于SAP的不同病理类型中[10]。本研究发现,造模后6 h、24 h,实验组胰腺细胞凋亡指数显著高于对照组和SAP组(P<0.05)。诱导胰腺腺泡细胞的凋亡可能在一定程度上减轻SAP的病情[11]。PEP-1-SOD1作为有机体重要的氧自由基清除剂,可促进细胞凋亡,从而有利于保护胰腺组织的功能。有研究[4]表明PEP-1-SOD1预处理可使SOD1活性维持在较高水平,从而提高清除氧自由基的能力,从另一方面反映了其对胰腺组织的保护效应。
现有研究表明,在SAP起病初期,如胰腺腺泡细胞出现大量坏死,可触发级联放大反应,从而导致严重的预后[12]。细胞内存在多条细胞凋亡信号通路,caspases是细胞凋亡过程的主要执行者,活化的caspase-3可经蛋白酶解过程激活后,最终引发细胞凋亡[13]。Caspase-3介导了急性胰腺炎腺泡细胞凋亡,caspase-3表达缺失可明显加重大鼠SAP病情[14]。本研究中,造模后24 h,SAP组大鼠胰腺组织caspase-3 mRNA和蛋白表达显著高于对照组,但显著低于实验组(P<0.05)。表明PEP-1-SOD1能调节caspase-3表达水平,从而影响胰腺细胞的凋亡。
总之,PEP-1-SOD1可通过调控SAP大鼠细胞凋亡相关基因caspase-3的表达,减轻胰腺组织病理损害,增加胰腺腺泡细胞凋亡,促进胰腺功能恢复正常。但具体的机制仍需进一步研究探讨。
