重视胃肠间质瘤的诊断和治疗*
2019-07-09汪明曹晖
汪 明 曹 晖
上海交通大学医学院附属仁济医院胃肠外科(200127)
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是一类起源于胃肠道间叶组织的实体肿瘤,是胃肠道最常见的间叶源性肿瘤,占所有胃肠道肿瘤的1%~2%。事实上,20世纪80年代之前诊断的胃肠道平滑肌瘤、平滑肌肉瘤、神经鞘膜瘤等多种肿瘤,按当前诊断标准绝大多数可诊断为GIST。1998年,日本学者Hirota等[1]报道了GIST中存在c-kit基因功能活化突变,揭示了GIST发病机制中最核心的分子改变,这一里程碑式的发现颠覆性地推进了GIST基础研究和临床诊疗的进程。在此基础上,小分子受体酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)甲磺酸伊马替尼(imatinib mesylate, IM)于2001年首次被尝试用于治疗1例传统治疗手段失败的晚期GIST患者并获得成功[2],由此开启了GIST诊治和研究的全新时代,IM靶向治疗GIST成为实体肿瘤靶向治疗时代最成功的范例。近30年来,GIST从易误诊到引起高度关注,其背景是医学科学的飞速发展。从事消化内、外科以及肿瘤专业的临床医师正确认识GIST并了解相关研究领域的新进展,有助于更好地开展精准医学的临床实践。
一、GIST的定义、流行病学和临床特征
根据最新中国GIST诊疗专家共识,GIST定义为:胃肠道最常见的间叶源性肿瘤,在生物学行为上可从良性至恶性,免疫组化检测通常表达CD117和DOG1,显示Cajal间质细胞分化,大多数病例具有c-kit基因或PDGFRA基因活化突变,少数病例涉及其他分子改变,包括SDH、BRAF、NF1、K/N-RAS、PIK3CA等基因突变等[3]。GIST的中位发病年龄约为60岁,男女发病无明显差异。国内外流行病学调查显示,GIST的年发病率介于(1.1~2.1)/10万[4-5]。值得注意的是,流行病学证据显示GIST发病率呈升高趋势,且存在被低估的可能。GIST可发生于胃肠道几乎任何部位,最常见的部位为胃(50%~60%),其次为小肠(30%~35%)、结直肠(5%)和食管(<1%)[6]。少部分腹部间质瘤起源于腹腔或腹膜后软组织,与胃肠道无关,但是其组织形态、免疫表型等与GIST相似,这一类间质瘤被称为胃肠道外间质瘤(extra-gastrointestinal stromal tumor, EGIST),以与起源于胃肠道的GIST区分。GIST的临床表现取决于肿瘤大小、部位及其生长方式,通常无特异性。肿瘤早期,尤其是直径<2 cm的肿瘤,可能没有任何症状,在体检或其他腹部手术时被发现。随着肿瘤体积的增长,患者可出现一些非特异性症状,以胃肠道出血最为常见。GIST转移灶可发生于肝脏以及腹膜表面,腹腔外转移极为罕见[7]。
二、GIST的病理诊断
GIST的病理诊断主要依靠光学显微镜下组织形态学观察结合特定免疫组化标志物检测。对于少数诊断不明确或有困难的病例,分子病理检测有助于明确诊断。另外,由于IM治疗效果与GIST基因型密切相关,分子病理检测被推荐用于拟行IM治疗的局部进展期或复发/转移性GIST以及术后拟行IM辅助治疗的中-高复发风险GIST。
1. GIST的组织学诊断:组织学上,根据肿瘤细胞形态可将GIST分为三大类:梭形细胞型(70%)、上皮样细胞型(20%)和梭形细胞-上皮样细胞混合型(10%)[8]。经靶向治疗后,GIST的组织形态学可发生明显改变,往往出现坏死和(或)囊性变,瘤细胞成分稀疏,间质伴有广泛胶原化。
免疫组化标志物检测对于确立GIST的病理诊断至关重要,推荐联合检测CD117、DOG1、CD34、SDHB(琥珀酸脱氢酶B亚基)和Ki-67五个标志物[3]。CD117蛋白由c-kit基因编码,约95%的GIST表达CD117,因此CD117曾被作为GIST病理诊断最重要的免疫组化标志物。近年新发现的标志物DOG1选择性表达于GIST细胞,诊断GIST的敏感性和特异性均优于CD117。无论是对c-kit基因突变还是PDGFRA基因突变的GIST,DOG1都是一个良好的标志物[9]。SDHB在大多数GIST中呈阳性表达,c-kit基因和PDGFRA基因野生型的GIST则近半数存在SDHB蛋白表达缺失,由于该蛋白表达反映了SDH复合物的功能,因此这一类野生型GIST被称为SDH功能缺陷型GIST[10],其生物学行为以及对靶向药物的反应明显不同于SDH功能无缺陷的GIST。Ki-67是基于免疫组化染色的增殖细胞标志物,有助于辨识细胞增殖活性。
2. GIST的分子病理诊断:c-kit或PDGFRA基因突变见于约90%的GIST,是GIST特征性的分子改变,对于诊断和药物治疗效果预测具有重要意义。GIST分子病理检测基因突变位点,至少应包括c-kit基因的第9、11、13、17外显子和PDGFRA基因的第12、18外显子。对于继发耐药者,应增加检测c-kit 基因的14、18外显子[3]。原发性c-kit基因突变表现为多种突变类型,其中缺失突变约占50%,特别是557-558缺失突变,肿瘤生物学行为较非缺失突变者更差,表现为自然预后差、IM治疗有效时间相对较短等。因此,GIST的分子病理诊断对评估肿瘤生物学行为和制订整体治疗策略有一定的指导意义[11]。
3. GIST的危险度分级:GIST的生物学行为多变,既可表现为几乎没有任何恶性潜能的微小病灶,也可表现为易发生肝脏或盆腔转移的巨大肿瘤,单纯的组织形态学观察不足以评估GIST的复发风险。为了准确评估GIST外科手术切除后的复发风险,相继有多个GIST复发危险度评估体系被提出并应用于临床实践,包括美国国立卫生研究院(National Institutes of Health, NIH)危险度分级标准(NIH标准)[8]、美军病理学研究所(Armed Forces Institute of Pathology, AFIP)标准(AFIP标准)[12]和改良NIH标准[13]。此外,近年还提出了一些较新的GIST危险度分级方法,如列线图法(nomogram)[14]和热图(Contour map)[15],但尚未被临床广泛接受。出于便捷性和操作简单性考虑,目前我国GIST诊疗专家共识仍主要推荐改良NIH标准(表1)[3]用于GIST的复发风险评估。
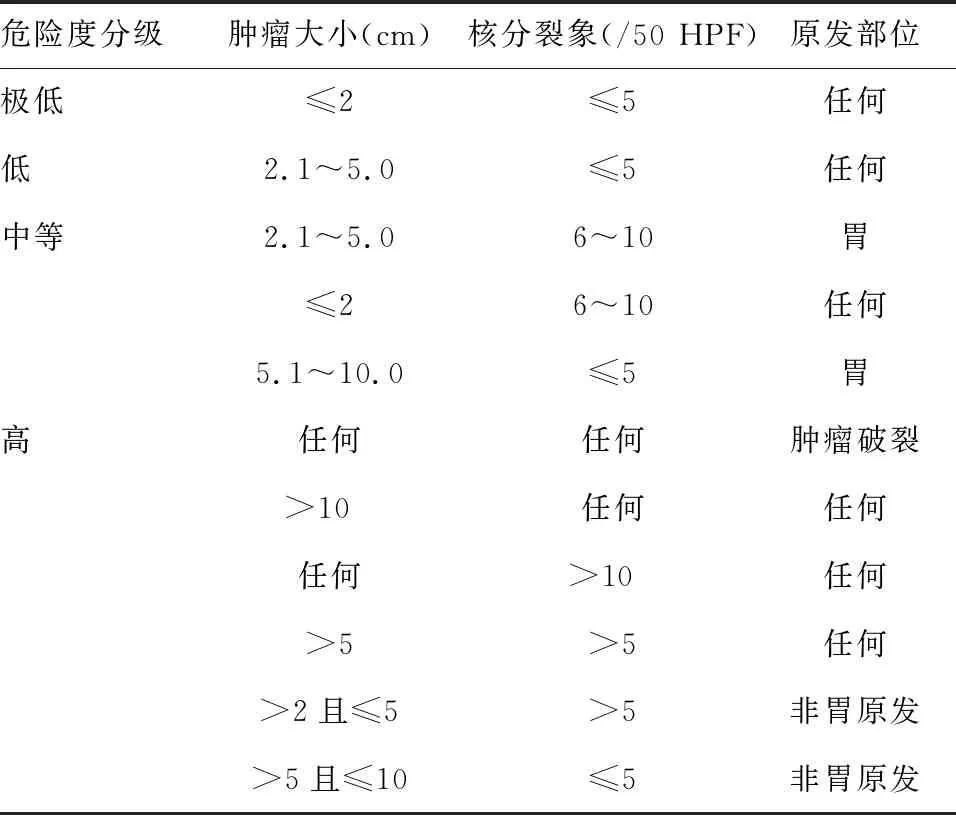
表1 GIST复发风险评估:改良NIH标准
三、GIST的内镜和影像学诊断
GIST的临床诊断主要依靠内镜,尤其是内镜超声(endoscopic ultrasonography, EUS)技术和放射影像学技术(包括CT、MRI和PET-CT)。
1. GIST的内镜诊断:在内镜下,大多数GIST与其他胃肠道黏膜下肿瘤(submucosal tumor, SMT)一样,表现为有光滑、完整、正常黏膜覆盖的隆起型病灶,部分病例可出现黏膜溃疡改变。普通内镜检查能初步评估病变大小、黏膜形态、活动度和硬度,但很难准确作出GIST的诊断,且由于GIST绝大多数起源于固有肌层,很难通过普通内镜下钳夹活检获得明确的病理诊断。EUS检查可提供黏膜下病变各种有价值的信息,如肿瘤大小、肿瘤壁层来源、回声、血供以及肿瘤边缘形态等。绝大多数情况下,GIST来源于超声图像中胃肠道管壁的第四层,即固有肌层,表现为边缘光滑、圆形的均匀低回声病变。国内外相关专家共识和指南均推荐根据GIST的EUS下表现确定其风险分级,进而指导小GIST(<2 cm)的治疗策略(手术或随访),不良因素为边界不规整、溃疡、强回声和异质性[3,16-17]。EUS引导下细针抽吸活检(EUS-guided fine-needle aspira-tion, EUS-FNA)是获得黏膜下病变组织最常用的方法,具有较高的敏感性和准确性,适用于需在术前取得明确病理证据的病例。
2. GIST的影像学诊断:增强CT检查为GIST首选的影像学检查方法。在肠道准备较好的情况下,增强CT可发现直径1 cm以上的GIST,明确其数量、位置、形态、大小、密度、强化水平、淋巴结以及远处转移信息;三维重建成像有助于多方位观察病变与邻近组织、脏器的毗邻关系,为术前评估病变恶性程度、分级、分期等提供详细信息[18]。MRI在GIST诊断中的地位与CT相似,有助于更早发现肝脏转移灶且无放射性。PET-CT系通过肿瘤糖代谢异常显示病变,在判断GIST复发、转移以及评估药物治疗效果方面有其独特的优势,尤其适用于靶向药物治疗初期需明确治疗反应的患者,但因价格昂贵,临床应用受限[17]。
四、GIST的外科治疗
外科手术切除是GIST惟一可能获得根治的手段,是GIST最主要、最有效的治疗选择,因此外科医师在GIST患者的全程化管理中起主导作用。2018年,中国医师协会外科医师分会胃肠道间质瘤诊疗专业委员会和中华医学会外科学分会胃肠外科学组组织我国外科学专家撰写了《胃肠间质瘤规范化外科治疗中国专家共识(2018版)》[19],对推动我国GIST的规范化外科治疗起到积极作用。
1. GIST的手术适应证和手术治疗原则:对于临床上考虑为GIST的患者,应先进行临床评估,判定肿瘤部位、大小、是否局限、有无转移,综合评判进而决定治疗方式。直径≤2 cm的胃GIST如有临床症状,可考虑手术切除;无症状的拟诊GIST者,如合并EUS下不良因素,应考虑切除,如无不良因素,可定期内镜或影像学随访,随访时间间隔通常为 6~12个月。直径>2 cm的胃GIST,如预期能实现R0切除且不需联合脏器切除,或严重影响脏器功能者,首选手术切除。其他部位的GIST由于进展风险高于胃GIST,原则上不论大小均应考虑手术治疗的可行性。可切除的局部晚期和孤立性复发或转移GIST在预期能达到R0切除且手术风险不大、不会严重影响相关脏器功能的前提下,可直接行手术切除,必要时可予IM术前治疗。不可切除的复发或转移性GIST原则上不主张手术治疗,在靶向药物对疾病总体控制良好的前提下对局部进展期病灶行手术切除的价值仍有争议。GIST引起完全性肠梗阻、消化道穿孔、保守治疗无效的消化道大出血以及肿瘤自发破裂引起腹腔大出血时,必须行急诊手术。
GIST手术治疗的基本原则包括通过外科手术完整切除肿瘤、术中避免肿瘤破裂、注意保护肿瘤假性包膜完整、保证切缘组织学阴性,故大多数胃GIST可行楔形切除术。由于GIST很少发生淋巴结转移,故一般情况下无需常规清扫淋巴结,但对于年轻胃GIST患者,如术中发现肿大的淋巴结,需考虑SDH功能缺陷型野生型GIST的可能,应切除病变淋巴结[20]。完整切除肿瘤的同时,应充分考虑保留胃肠道功能,如在切除贲门、幽门附近的肿瘤时应尽量保留贲门和幽门功能,必要时术前可先使用靶向药物实现肿瘤缩小,再进行手术。
2. GIST的腹腔镜手术:腹腔镜手术具有创伤小、术后恢复快等优势,但GIST 肿瘤质脆、易破溃的特点限制了腹腔镜手术的应用。随着技术的日益成熟,国内外陆续有腹腔镜手术成功用于治疗GIST的报道[21-24]。国内外相关共识指南对腹腔镜手术在GIST治疗中应用的推荐亦随之发生改变,由最初的“不推荐”,到曾经的“限定大小”,直至目前推荐“可在适宜解剖部位开展”[19]。肿瘤大小现已不再是限制腹腔镜手术开展的决定性因素,但临床医师在选择腹腔镜技术治疗GIST 时应严格掌握其适应证且操作应谨慎规范,肿瘤较大、操作难度较高或需行联合脏器切除者不推荐腹腔镜手术。腹腔镜手术治疗GIST同样遵循开腹手术的基本原则,术中应根据肿瘤部位、大小和生长方式决定具体术式(胃楔形切除、胃大部切除或全胃切除),对于特殊部位的胃GIST可采取腹腔镜与内镜双镜联合切除术或其他方式。手术中须遵循“非接触、少挤压”的原则,注意避免肿瘤破溃播散,导致腹腔种植或血行转移,必须使用“取物袋”,应避免为追求微创和切口小而分块切取肿瘤后取出,影响术后病理评估。
3. GIST的内镜治疗:GIST大多呈管腔内膨胀性生长且几乎不发生淋巴结转移,因此从理论上来说,对于部分小GIST,开展类似于其他SMT或胃肠道早癌的内镜下切除,如内镜黏膜切除术(EMR)、内镜黏膜下剥离术(ESD)等是可行的[25]。但内镜切除过程中存在瘤体破损后肿瘤细胞进入腹腔播散的风险,以及切除深度和范围无法确保术后无病灶残留的风险,因此对GIST的内镜治疗目前仍有较大争议,尤其体现在以外科医师为代表的“浆膜外科”(以开放或腹腔镜为平台经体腔和脏器浆膜面入路的传统外科)和以内镜医师为代表的“黏膜外科”(以内镜为平台从自然腔道黏膜面入路的内镜外科)之间理念和实践的碰撞[26]。
近年来内镜技术在我国发展迅速,尤其是某些著名大型内镜中心,其内镜治疗水平(无论是难度还是成功率)在国际上均居领先地位,并在国际学术期刊发表了不少关于GIST内镜治疗的回顾性研究成果。但在缺乏前瞻性设计的研究和大样本长期随访数据的前提下,GIST的内镜切除应慎之又慎,临床医师应严格掌握适应证且需规范操作,对于不合并EUS下不良因素的小GIST,可考虑在内镜治疗技术成熟的单位,由具有丰富经验的内镜医师实施内镜下切除[27]。
五、GIST的药物治疗
IM在晚期GIST的治疗中取得巨大成功,可显著延长患者生存期,这一成功迅速催生了其在局部进展期GIST的术前治疗和中高危复发风险GIST术后辅助治疗中的应用,成为恶性肿瘤靶向药物治疗的成功范例。IM治疗过程中出现耐药是临床上较为棘手的问题,继IM出现的TKI类药物舒尼替尼(sunitinib)和瑞戈非尼(regorafenib)在耐药进展后的晚期GIST病例中显示出一定疗效,分别确立了其二线和三线药物的地位。
1. 基因分型指导下的GIST靶向药物治疗:不同基因型的GIST对不同靶向药物治疗的反应不尽相同。c-kit基因11外显子突变所致相应编码结构域的改变对IM结合的影响很小,因此11外显子突变的GIST对常规剂量(400 mg/d)IM治疗反应最好。c-kit基因9外显子突变的GIST对IM的反应较11外显子突变者差,但研究证明通过加大IM治疗剂量至800 mg/d(国内推荐600 mg/d)可使这部分患者获益[28]。c-kit基因13、14、17、18外显子突变多为继发突变,对IM治疗不敏感,也是继发耐药产生的主要原因之一。其中13、14外显子突变对二线药物舒尼替尼更敏感,17、18外显子突变对三线药物瑞戈非尼更敏感[29-30]。PDGFRA基因 18外显子D842V突变属于原发耐药突变,对现有的一线至三线药物均不敏感[31],除此之外的PDGFRA基因突变对IM治疗均敏感。野生型GIST对靶向药物的反应尚不确定,相对较为明确的是野生型GIST中的部分亚型如SDH功能缺陷型GIST和神经纤维瘤1型(NF1)相关GIST对IM治疗不敏感。目前正在进行临床研究的一些新药如avapritinib(BLU-285)[32-33]和DCC-2618[33]在前期研究中显示出对各类原发和继发突变(包括PDGFRA基因D842V突变)有良好疗效,有望在上市后改变GIST靶向药物治疗规则。
2. 晚期GIST的药物治疗:晚期GIST指转移、复发或不可切除的GIST,B2222、S0033等临床试验结果确立了IM作为晚期GIST一线治疗药物的地位[34-35]。目前一般主张初始治疗剂量为400 mg/d,c-kit基因9外显子突变者则推荐高剂量(国外推荐800 mg/d,国内推荐600 mg/d)[3]。如IM治疗有效,应持续用药,直至疾病进展或出现不能耐受的毒性。如在IM治疗期间出现疾病进展,在除外患者依从性因素后,对局部进展期病例可考虑手术切除或介入治疗(如动脉栓塞或射频消融),对广泛进展病例可考虑换用二线药物舒尼替尼或增加IM剂量[36-38]。如二线药物治疗失败,可考虑换用三线药物瑞戈非尼治疗[3,19]。
3. GIST的术前治疗:IM用于GIST的术前治疗可实现有效缩小肿瘤体积、降低临床分期、缩小手术范围,从而减少医源性播散,最大限度地避免不必要的联合脏器切除,保留重要器官结构和功能,降低手术风险,提高患者术后生存质量。临床上对于符合下列情况的GIST患者应考虑术前治疗:①局限性GIST肿瘤体积巨大;②临界可切除或虽可切除但手术风险较大;③特殊部位的肿瘤(如食管胃连接部、十二指肠、低位直肠等);④预计需行联合脏器切除;⑤局部晚期和孤立性的复发或转移GIST。GIST的术前治疗不同于晚期GIST的药物治疗,密切随访和准确的治疗效果评估相当重要,否则可能错过最佳手术时机。应通过多学科协作讨论模式判断手术时机,达到最大治疗反应后(通常需时6~12个月)可进行手术[19]。
4. GIST的辅助治疗:IM术后辅助治疗可显著降低GIST术后复发风险。经来自美国的ACOSOG Z9001研究[39]和来自欧洲的SSGXVⅢ研究[40]探索,目前3年IM辅助治疗已被作为高复发风险GIST术后的标准治疗方案。中度复发风险GIST是否能从辅助治疗中获益尚有待探索,考虑到非胃来源的GIST复发风险高于胃来源的GIST,目前我国专家共识推荐对于中度复发风险的GIST,胃来源者应辅助治疗1年,非胃来源者应辅助治疗3年[3]。辅助治疗停药后,有一部分GIST患者会出现复发或转移,因此有必要强调停药后的密切随访。国外PERSIST-5单臂临床试验已证实5年辅助治疗有利于进一步延长GIST患者的无病生存时间[41]。国内外正在进行的关于延长辅助治疗时限的前瞻性随机对照临床研究有助于进一步解答3年辅助治疗是否足够的问题。
六、结语
作为一个在20世纪末才真正被正确认识的少见疾病,近年来GIST在学界受到的关注程度以及在实体肿瘤靶向治疗领域的示范作用超出了众人的预期。GIST领域的研究进展和治疗经验助推了精准医学发展的步伐,同时精准医学理念的普及也带动了GIST个体化诊疗的深入。当代医学已进入规范化、个体化和分子水平精准诊疗的新时代,临床医师尤其是从事胃肠肿瘤专业的医师应重视和规范GIST的诊断和治疗,并将从GIST诊疗中获得的经验运用到精准医学的临床实践中去。
