1例家族性腺瘤性息肉病家系的遗传学分析*
2019-07-09张金坤周春晓
黄 超 闵 寒 张金坤 杨 柳 周春晓 凌 鑫 余 强&
南京医科大学生殖医学国家重点实验室苏州分中心1(215002)南京医科大学附属苏州医院中心实验室2 南京医科大学附属苏州医院消化内科3苏州市肿瘤诊疗中心消化内科4 苏州市吴江区第一人民医院消化内科5
家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)是一种常染色体显性遗传病,由Bussey[1]首次发现并进行描述,其主要特征为患者结直肠存在大量腺瘤性息肉。FAP的全球发病率为1/7 000~1/10 000,具有遗传性,息肉多于青少年时期出现,少数在幼儿时期开始生长,婴儿时期未见息肉生长[2-3]。根据患病年龄以及结直肠内的息肉数目,FAP可分为经典型家族性腺瘤性息肉病(classical familial adenomatous polyposis, CFAP)和衰减型家族性腺瘤性息肉病(attenuated familial adenomatous polyposis, AFAP),CFAP通常发病较早,息肉数目一般大于100枚;AFAP通常发病较晚,息肉数目少于100枚[4-5]。
随着基因测序技术的不断发展,FAP的发病机制越发明确,可能主要涉及腺瘤性结肠息肉病(adenomatous polyposis coli, APC)基因突变。据HGMD数据库统计,目前已发现1 400余种APC基因突变,且突变位点与表型轻重具有相关性[6]。此外,结直肠腺瘤息肉若不加以干预,则其恶变导致结直肠癌的概率接近100%[7]。因此,有长期便血、腹痛等FAP症状的患者应及早接受结肠镜检查,有助于预防结直肠癌的发生,显著改善患者的预后和生活质量[8]。本研究通过采用新一代测序(NGS)技术对1例FAP家系进行检测分析,旨在探讨其发病原因和机制。
对象与方法
一、研究对象
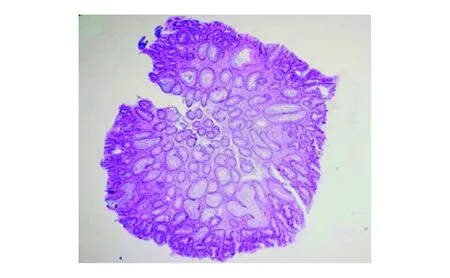
先证者沈某,女,23岁,因反复便血至南京医科大学附属苏州医院就诊并接受结肠镜检查,询问家族史并确认家系图(图1)。先证者(Ⅲ7)父(Ⅱ3)母(Ⅱ4)非近亲婚配,先证者与其母亲、舅舅(Ⅱ5,结直肠癌已故)、表兄(Ⅲ8)均有不同程度的结直肠息肉表型,初步诊断为FAP,考虑行全结肠切除回肠直肠吻合术,术后样本送病理切片检查。
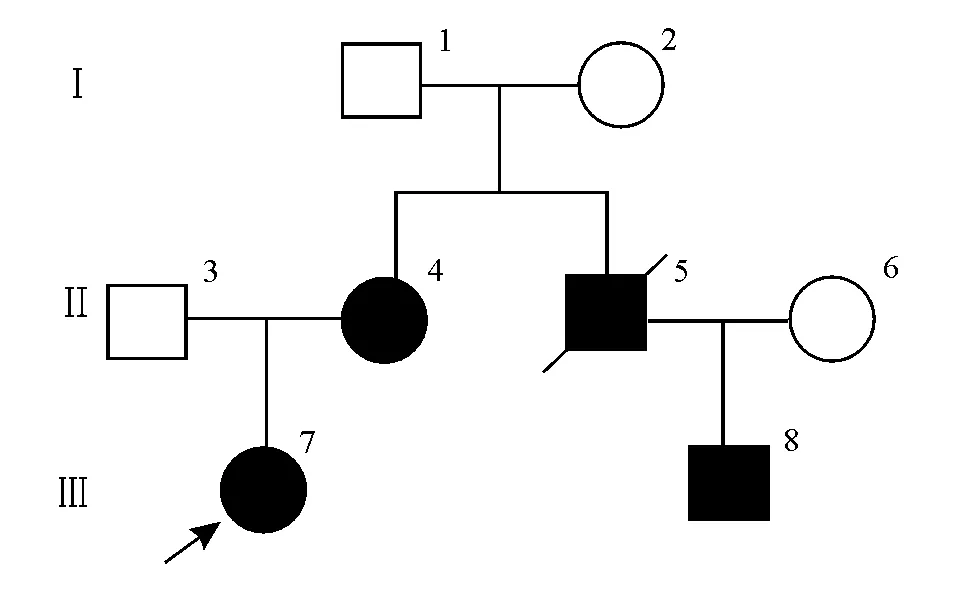
图1 本例FAP患者家系图
二、样本采集
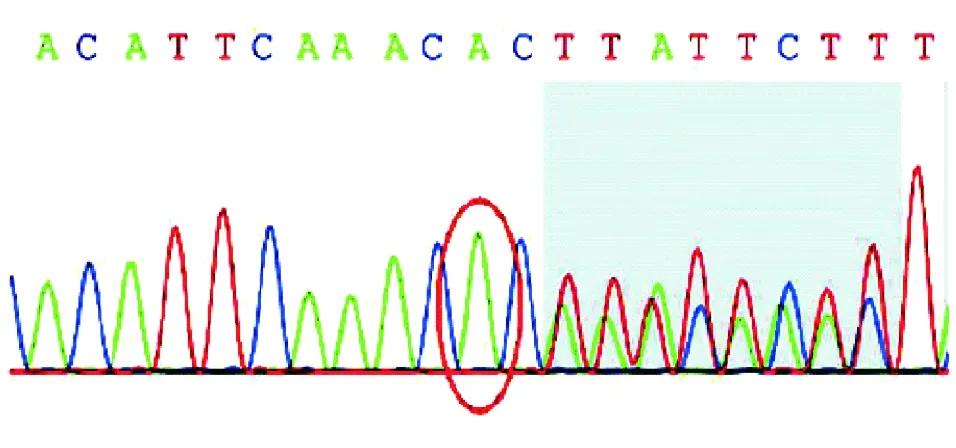
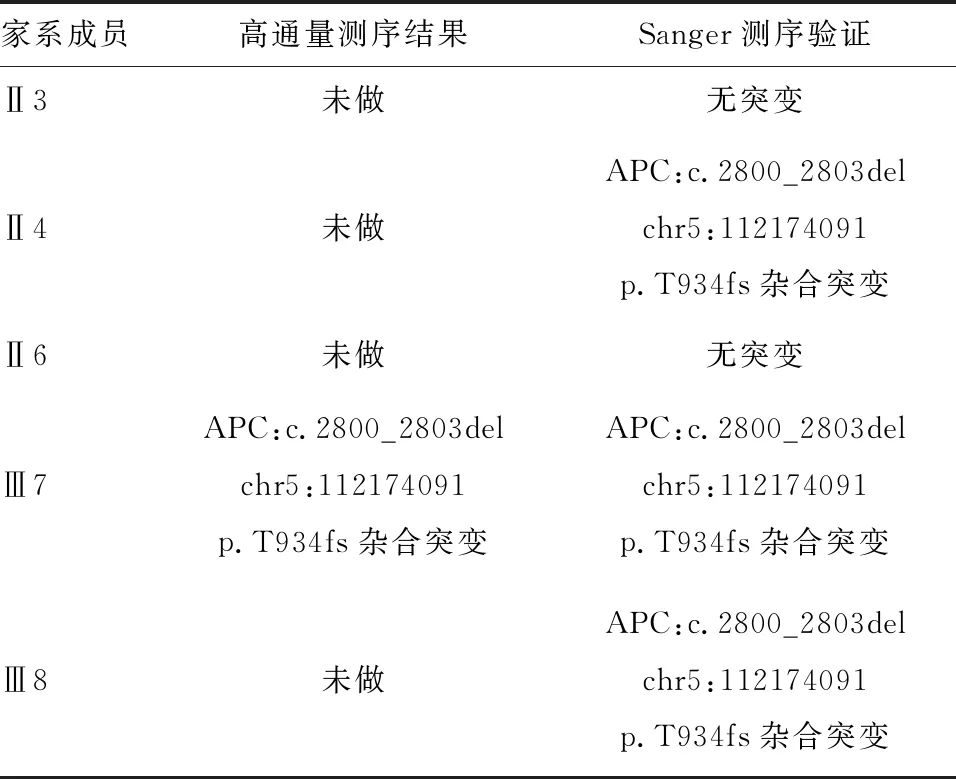
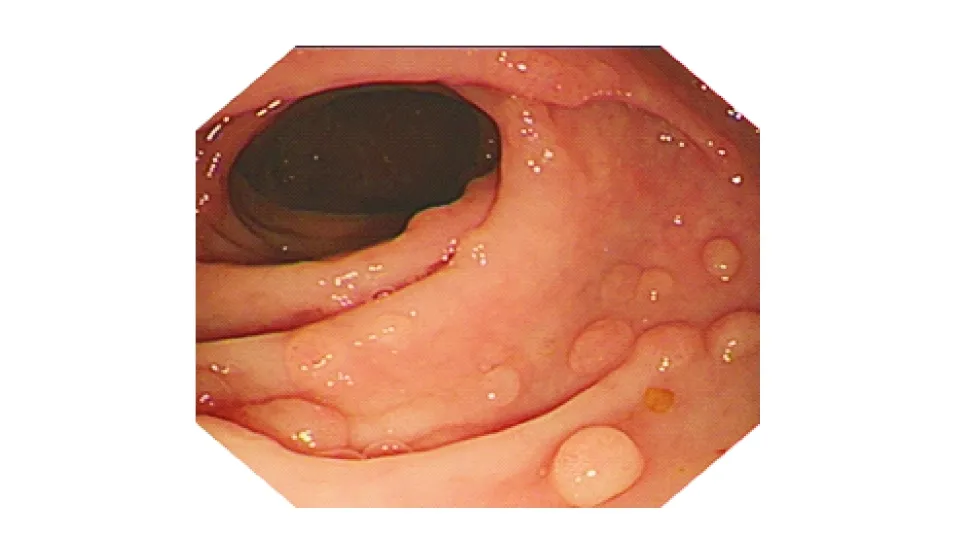
经先证者及其家系成员同意并签署知情同意书后,所有研究对象于清晨就餐后抽取静脉外周血5 mL,EDTA-K2抗凝。EDTA-K2抗凝管混匀后吸取200 μL外周血,利用QIAamp®DNA Blood Mini Kit(250)(德国QIAGEN公司)提取外周血白细胞基因组DNA,Nanodrop2000c分光光度计检测样本DNA浓度和纯度,确保DNA质量在合格范围内(1.8 委托北京金准基因科技有限责任公司进行全外显子测序。将每个样本1.5 μg基因组DNA随机打断为大小为150~250 bp的片段,然后采用KAPA末端修复酶进行DNA修复,经磁珠纯化后,DNA 3’端添加腺嘌呤碱基,将接头连接至DNA片段,行文库模板扩增。DNA文库构建后采用SeqCap法与探针杂交,经扩增后富集至磁珠上纯化并洗脱,最后行Qubit定量。取捕获后的DNA样本行Illumina HiSeq2500高通量测序。数据经Illumina测序控制软件(SCS)评估合格后,读取数据并行生物信息学分析。经BWA-0.7.12软件比对至人类基因组参考序列(GRCh37)上,工具包去除重复序列,使用基因组分析工具包检测单核苷酸变异和插入缺失变异,以ANNOVAR软件对变异位点进行注释,筛选致病突变。对可疑致病突变行Sanger测序验证、家系共分离检测。 先证者接受结肠镜检查以观察整个结直肠,结果示全结肠多发大小不等的息肉共百余枚(图2),以圈套电凝切除后送病理检查,提示腺瘤性息肉为管状腺瘤,同时伴有低级别上皮内瘤变,未发生恶变(图3)。 图2 先证者结肠镜检查结果 对先证者结直肠疾病panel基因各外显子进行测序,其中目标区覆盖度99.9%,目标区平均深度112.11,目标区平均深度>20×比例99.2%,经分析后未发现明确与疾病相关的大片段拷贝数变异致病的情况。APC基因第15号外显子区域发现一处杂合突变,即c.2800_2803delACTT(p.T934fs),HGMD数据库检索此突变位点为已报道的致病突变,为移码突变,对蛋白功能的影响较大。 为进一步验证高通量测序结果,设计正向引物:5’-ACG CGG AAT TGG TCT AGG C-3’;反向引物:5’-GGT CGG CTG GGT ATT GAC C-3’,对先证者及其家系成员行Sanger测序验证。结果显示有结直肠息肉表型的家系成员APC基因确实存在杂合缺失突变c.2800_2803delACTT(p.T934fs),无结直肠息肉表型的成员则无此突变,与高通量测序结果一致(图4)。且先证者APC基因的杂合突变来自于其母,其表兄存在相同的突变位点,其父和舅母此位点无突变(表1)。 FAP是一种极易导致结直肠恶性肿瘤的疾病,目前其公认的致病基因为APC基因。APC基因编码一种作为Wnt信号通路拮抗剂的肿瘤抑制蛋白,可参与细胞迁移、黏附、转录激活、细胞凋亡等过程[9]。APC基因定位于染色体5q21~22,全长108 kb,共含15个外显子,编码2 843个氨基酸残基,其中15号外显子是该基因编码区最大的外显子,全长6 577 bp,亦是人类基因组中最大的外显子区域,突变也多发生于15号外显子[10-11]。APC基因突变类型以无义突变和移码突变为主(>95%),突变可导致终止密码子提前出现从而形成截断蛋白,破坏蛋白功能和结构的完整性[12]。CFAP患者中APC基因突变检出率为80%~93%,无义突变、缺失、插入或可变剪接较为多见,大片段缺失和重复较为少见[13];与FAP相关的突变通常聚集于突变簇区域(MCR),突变热点集中于密码子213(3%)、密码子1061(7%)、密码子1068(2%)、密码子1309(11%)[14-16]。 图3 先证者腺瘤切除后病理检查结果(HE染色,×40) 图4 FAP家系Sanger测序验证结果 家系成员高通量测序结果Sanger测序验证Ⅱ3未做无突变Ⅱ4未做APC:c.2800_2803del chr5:112174091 p.T934fs杂合突变Ⅱ6未做无突变Ⅲ7APC:c.2800_2803del chr5:112174091p.T934fs杂合突变APC:c.2800_2803del chr5:112174091p.T934fs杂合突变Ⅲ8未做APC:c.2800_2803del chr5:112174091 p.T934fs杂合突变 本研究采用NGS技术检测1例FAP家系发现,APC基因存在杂合缺失突变c.2800_2803delACTT(p.T934fs),该突变可造成15号外显子5’端区域4个碱基的缺失,导致发生移码突变,形成结构异常的功能蛋白。APC蛋白包含多个功能结构区域,包括N-末端的七价重复区(密码子6~57)、犰狳重复区(密码子453~767)、3个15-氨基酸重复区(密码子1020~1169)、7个20-氨基酸重复区(密码子 1262~2033)、SAMP重复区、两个核定位信号区(密码子1767~1772和密码子2048~2053)、碱性区(密码子2200~2400)、EB1区(密码子2560~2843)和DLG区域[17-20]。本研究中家系APC基因突变位点导致EB1蛋白功能区域发生变化并可能累及DLG区域。EB1区是EB1与MDia形成复合物的区域,有利于微管稳定性并促进细胞迁移;DLG区域可阻断G0/G1期至S期的细胞周期,抑制细胞增殖过程,故DLG区域在控制细胞周期信号和细胞增殖中起有重要作用。由此可见,该家系中所涉及的APC基因突变位点与细胞增殖过程密切相关,该突变引起的APC蛋白变化会影响β-catenin的降解功能,使其在细胞质内过多堆积,并转移至核内与TCF/LEF转录因子结合,从而激活Wnt通路下游靶基因,促进信号转导、细胞分裂增殖从而造成较为严重的FAP临床症状,家族成员中结直肠腺瘤发生癌变的概率也会增大。 目前临床主要根据腺瘤病理检查结果和内镜下结直肠息肉数目来诊断FAP,但某些消化道息肉疾病如Peutz-Jegher综合征、Lynch综合征、MYH相关性息肉病、遗传性非息肉性结肠直肠癌、幼年性息肉综合征等[21]与FAP难以区别,给临床诊断带来了一定的困难,因此依靠基因测序技术进行分子诊断,可辅助临床及早准确地进行诊断和治疗。 基于Illumina平台的NGS方法是一种与经典的Sanger链终止法截然不同的测序方法。其以高通量并行的模式,实现了边合成边测序的测序技术,当DNA链复制时即可追踪标记寡核苷酸的添加。因此,NGS可产生大量DNA序列数据,与Sanger测序相比,NGS技术的数据更丰富、更完整,且Sanger测序需设计特定引物,材料重复利用率低,测序模板质量要求高,极大增加了成本[22]。基于毛细管电泳的Sanger测序已用于人类基因组计划,NGS技术使大规模全基因组测序变得切实可行。本研究利用NGS技术对FAP家系行全外显子组检测分析,耗时短、成本低、数据量足,检测结果经Sanger测序验证可靠。此外,先证者APC基因外显子区域还发现多处同义突变和错义突变(p.T1475T、p.G1660G、p.S1738S、p.V1804D、p.P1942P),与数据库对比发现,这些位点均为多态性位点。 在临床诊治过程中,许多FAP患者青春期即出现反复便血、腹泻等症状,但多未引起重视而延误治疗。本研究中,先证者就诊时结直肠已存在大量息肉样腺瘤,必须接受手术治疗。询问家族史时发现,其家族中也有类似表型的患者,但由于年代和技术限制,并未引起重视。因此,当家族成员中有相似表型时,应考虑遗传病的可能,及时行结肠镜检查,并结合基因检测,对于携带突变而尚无临床表型的家庭成员及早进行监测,以预防结直肠癌变,对于未携带突变的成员可按正常人群进行筛查。 综上所述,随着FAP临床表型与APC基因相关性认识的深入研究和进展,临床工作者可利用更先进的遗传筛查技术更早、更准确地对患者进行诊断和治疗,基因检测结果与临床决策可相辅相成。三、目标区域捕获结合高通量测序
结 果
一、先证者内镜检查和病理学结果
二、高通量测序和Sanger测序验证结果
讨 论