Apollon蛋白表达与结直肠癌预后及临床病理特征的相关性
2019-07-04陈建发季茹谢奎龙冯巧智朱文彬周勇军周淑蓉
陈建发 季茹 谢奎龙 冯巧智 朱文彬 周勇军 周淑蓉
(解放军第四二二中心医院普外科,广东 湛江 524009)
在世界范围,结直肠癌(CRC)为第3常发癌、第4致死癌〔1〕,2012年约70万人死于该病〔2〕。在中国,无论男性还是女性,CRC发病率及致死率均排在癌症前5位〔3〕。CRC患者确诊后其5年及10年生存率分别为65%及58%。CRC预后与肿瘤分期关系密切,多数病例诊断时已处于晚期,如发生远端转移其5年生存率则仅为13%〔4〕。靶向治疗由于能够延长CRC总生存期而获得关注〔5〕。寻找合适的分子标靶的一个基本原则是需与预后及肿瘤进展有关〔6〕,如血管内皮生长因子(VEGF)、表皮生长因子(EGFR)及其他已确定的标记物〔5〕。抗凋亡蛋白表达的改变可以调控肿瘤细胞活性并抵抗程序化细胞死,其过表达还可导致肿瘤常规化疗抵抗。凋亡抑制蛋白(IAP)家族不仅在恶性肿瘤中过表达,还与不良预后有关〔7〕。Apollon作为IAP家族最大成员,被称为含杆状病毒IAP重复结构的泛素结合酶(BRUCE)或含杆状病毒IAP重复结构的蛋白(BIRC)6,在氨基端及羧基端分别拥有1个含杆状病毒IAP重复(BIR)结构域及1个泛素结合域(UBC)结构,通过抑制Smac/Diablo及Caspases的促凋亡活性而发挥细胞保护功能〔8〕。此外,Apollon还是胞质分裂的关键调控者,在细胞分裂过程中发挥重要作用〔9〕。目前,有关Apollon与CRC关系的研究尚不多见,确定生物标记物的临床价值需要对尽可能多的样本进行评估〔10〕。鉴于此,本研究分析Apollon与CRC临床病理参数及术后生存之间的关系。
1 材料和方法
1.1临床资料 收集2006年7月至2011年12月解放军第四二二中心医院普外科手术切除的原发性CRC标本59例,癌组织取自癌灶中心,且术前未行放化疗。全组男35例、女24例,年龄33~79岁,平均56岁。按美国癌症联合委员会(AJCC)/肿瘤-淋巴结-转移(TNM)分期法进行分期,根据世界卫生组织标准进行组织学分级。
1.2随访 采用电话、电子邮件或门诊方式进行随访,病例均有随访的完整资料。总生存时间为自手术之日起至出现与CRC相关的死亡时间,死于其他原因或在随访期内生存的病例作为截尾事件处理。本研究随访期为5年。
1.3免疫组化法 取经甲醛溶液固定、石蜡包埋的手术切除癌组织标本,4 μm厚连续切片,脱蜡,浸于0.01 mol/L 枸橼酸盐缓冲液内,微波炉加热至沸腾并保持该状态15 min修复抗原;切片冷却后洗涤,采用Abcam公司封闭缓冲液封闭非特异性背景染色;滴加Abcam公司兔抗人Apollon多克隆抗体(稀释400倍),4℃过夜;洗涤,浸于含0.3% H2O2的甲醇中灭活内源性过氧化物酶;洗涤,加VECTOR公司ImmPRESS试剂抗兔二抗(稀释1 000倍),室温反应15 min;洗涤后二氨基联苯胺(DAB)显色,苏木精轻染后封片。
1.4结果判定 Apollon评分系统和标准:Apollon蛋白主要定位于胞质。采用双评分半定量分析,根据阳性细胞百分比及显色程度计分,200倍镜下随机取5个视野,计算阳性细胞平均数,阳性细胞平均数为0计0分,≤25%计1分,26%~50%计2分,51%~75%计3分,≥76%计4分;显色程度无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。两种分数相加后综合判定,0~1分为(-),2~3 分为(+),4~7分为()。(-~+)为阴性,定义为Apollon低表达;()为阳性,定义为Apollon高表达。
1.5统计分析 应用SPSS12.0软件进行kendall等级相关分析,Kaplan-Meier法进行生存分析并以Log-rank检验差异性。
2 结 果
2.1Apollon蛋白在CRC组织内的表达 59例CRC患者中31例(52.54%)呈阳性染色(图1)。

图1 Apollon蛋白在CRC组织内的免疫组化染色(×200)
2.2Apollon蛋白表达与CRC临床病理参数的相关性 淋巴结转移、TNM分期更差且易发生肝转移者Apollon阳性率显著增高(P<0.01,P<0.001,P<0.001),Apollon表达在不同年龄、性别、肿瘤直径及组织分化程度的CRC患者中无显著性差异(P>0.05)。见表1。

表1 Apollon在CRC组织中的表达与临床病理参数之间的相关性〔n(%)〕
2.3生存分析 Apollon蛋白低表达者5年总生存率(71.4%)显著高于Apollon高表达者(38.7%,P<0.01),见图2。
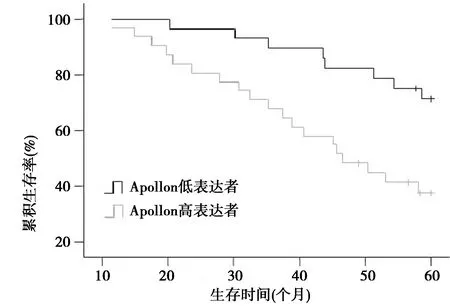
图2 Apollon蛋白不同表达水平的CRC患者Kaplan-Meier总生存曲线
3 讨 论
Apollon在包括CRC在内的多种恶性肿瘤中过表达,如前列腺癌、胃癌、肾癌、食管癌、乳腺癌、卵巢癌、黑色素瘤及白血病〔11~19〕。在前列腺癌中,Apollon表达与不良的临床病理特征及较差预后有关,而敲除Apollon则能够显著抑制前列腺癌细胞增殖并提高凋亡水平〔12,20〕。在肾癌中,Apollon表达与肿瘤大小、淋巴结转移及TNM分期有关,并与更短的总生存期有关〔14〕。在食管癌中,Apollon表达与肿瘤浸润深度、淋巴结转移、TNM分期、更短的总生存期及更短的无病生存期有关,还与较差的化疗应答有关,提示化疗与抗Apollon联用治疗食管癌的可行性〔15,21,22〕。在乳腺癌中,Apollon表达与新辅助化疗后获得的病理完全缓解率呈负相关、与人表皮生长因子受体(Her)-2状态及淋巴结转移呈正相关〔23〕。在卵巢癌中,Apollon表达与肿瘤更低的分化有关,并指示更短的术后总生存期和无病生存期〔17〕。在白血病中,Apollon基因过表达与儿童急性早幼粒细胞白血病不利的临床表现及不良疗效有关,提示Apollon基因过表达是儿童急性白血病的一个危险因素并可用于指导其治疗〔19,24〕。Apollon表达与CRC大小及浸润深度有关,与更差的总生存期及更短的无病生存期有关,敲除Apollon可抑制肿瘤细胞增殖并提高体内外CRC细胞对化疗的敏感性〔11〕。本研究显示CRC患者Apollon高表达者其5年总生存期更短,Apollon表达与淋巴结转移、TNM分期及肝转移有关。Apollon过表达可能是一个包括CRC在内的诸多恶性肿瘤的不良预后指标。
在本研究中,Apollon过表达被首次发现于发生了肝转移的CRC手术切除癌组织内。约20%的病例在CRC确诊时已发生远端转移,在整个疾病进程中最终发生远端转移者可达60%。肝脏为最常见的转移位置,并被认为是转移性CRC主要致死原因〔25〕。肿瘤干细胞(CSCs)负责肿瘤的发生、生长、转移及复发〔26〕,因此,监测CRC状态可能有利于预测和判断CRC发生肝转移的危险度。研究显示,来源于肝转移灶的结肠癌干细胞以一组高表达的存活蛋白为特征,其中过表达最显著者是Apollon,并且该蛋白能够保护结肠癌干细胞对抗化疗药物奥沙利铂及顺铂,提示Apollon过表达可能是结肠癌干细胞的特征〔27〕。如果上述Apollon作为CRC干细胞标志物这一假说成立,本研究则进一步验证了CSCs与转移之间的密切关系;而检测Apollon表达状况则可能有助于及早预测或发现CRC肝转移的发生,从而为下一步治疗提供合适的方案。
综上,Apollon可能是一个有用的CRC治疗标靶。
