长爪沙鼠非酒精性脂肪肝肝硬化模型的建立
2019-07-04李巍陈晓娟张旭亮石巧娟陈振文
李巍 陈晓娟 张旭亮 石巧娟 陈振文
(1浙江大学实验动物中心,浙江 杭州 310058;2浙江省医学科学院;3首都医科大学基础医学院)
目前全世界约20%的成年人患有非酒精性脂肪肝(NAFLD)〔1〕,肥胖人群的发病率则高达90%〔2〕。随着中国经济的快速发展,NAFLD患病率正逐年升高。NAFLD疾病谱由轻到重表现为单纯性脂肪肝、脂肪性肝炎、肝纤维化及肝硬化和肝癌,据统计15%~50%肝硬化与脂肪肝有关〔3~6〕。预测NAFLD引发的肝硬化在未来十年将成为发达国家肝移植的首要原因〔7,8〕。NAFLD从单纯脂肪变性到肝硬化的临床进展通常需要几十年。目前NAFLD诊断仍以病理学诊断为主要依据,肝活检仍是诊断NAFLD疾病谱的金标准〔9〕。活检难以反复取材且存在抽样误差〔10〕,任何一种非侵入诊断方法还不能完全代替肝穿刺活组织检查〔11〕。此外,获得人类肝脏组织还受道德约束的限制。长爪沙鼠是一种对膳食脂质比较敏感的动物〔12~14〕,本研究利用高脂饮食、雄性和脂质代谢紊乱等NAFLD临床主要致病因素,以长爪沙鼠为实验动物建立一种稳定的NAFLD肝硬化模型,并结合模型的病理过程、肝胶原沉积及相关细胞因子展开研究和评价。
1 材料与方法
1.1主要试剂 蛋黄粉购于浙江省长兴艾格生物制品有限公司。胆固醇、三号胆盐购于华东医药股份有限公司。食用猪油购于超市。Collagen Ⅰ、Collagen Ⅲ、基质金属蛋白酶(MMP)13、组织MMP抑制剂(TIMP)1(美国Proteintech公司)。
1.2实验动物 雄性Z:ZCLA长爪沙鼠40只,体重40~60 g,由浙江省实验动物中心提供〔生产许可证号:SCXK(浙)2014-0001,使用许可证号:SYXK(浙)2014-0008〕。
1.3饲料配方 普通饲料及高脂饲料(HFD)由浙江省医学科学院实验动物中心加工生产,HFD配方见相关专利〔15〕。
1.4模型建立 适应性饲养1 w后,给予HFD进行喂养,动物自由进食饮水。于0、6、12和24 w末动物称重,以1%戊巴比妥钠麻醉,腹主动脉采血处死全部动物。
1.5标本采集及指标测定 取肝脏后,将肝最大叶中部用4%甲醛固定后制备石蜡切片,进行苏木素-伊红(HE)染色和Masson染色观察病理变化;最大的肝叶中央部分(约1 mm3)2.5%的戊二醛4℃固定4 h后送中国科学院病毒研究所进行电镜观察;Western印迹法测定肝组织Collagen Ⅰ、Collagen Ⅲ、TIMP1、MMP13蛋白表达。
1.6统计学处理 用SPSS11.5软件进行t检验。
2 结 果
2.1肝脏外观特征 0 w组肝脏肉眼观察质地柔润,边缘尖锐,表面光滑,呈暗红色(图1A)。24 w模型组肝脏肿胀,体积增大,包膜紧张,边缘钝化,呈奶黄色,肝脏表面出现凹凸不平的结节(图1B)。部分动物肝脏与周围组织有粘连,切面油腻。
2.2各组沙鼠组织学改变 随着饲喂时间延长动物不同阶段临床指证打分结果见表1。HE染色和Masson染色显示,0 w组肝小叶结构完整,以中央静脉为中心,肝细胞呈放射索状排列,细胞大小均一,细胞核位于细胞正中,汇管区未见异常(图2A、2D)。6 w后动物肝细胞30%~60%大泡性脂肪变性(图2B)为单纯性脂肪肝模型;12 w时动物肝脏细胞胞质透明,被大小不一的空泡所替代,间质有散在性多核白细胞及单个核细胞浸润(图2C)形成非酒精性脂肪性肝炎(NASH)模型,肝细胞出现气球样变,尤其是肝小叶中心的肝腺泡Ⅲ区,部分细胞可观察到Mallory小体(图2E)。24 w时Masson染色可见动物肝脏中央静脉及汇管区周围纤维组织增生,呈条索状向肝小叶内延伸,部分包绕肝小叶,出现假小叶结构,形成肝硬化模型(图2F)。

图1 饲喂不同时间肝脏外观变化
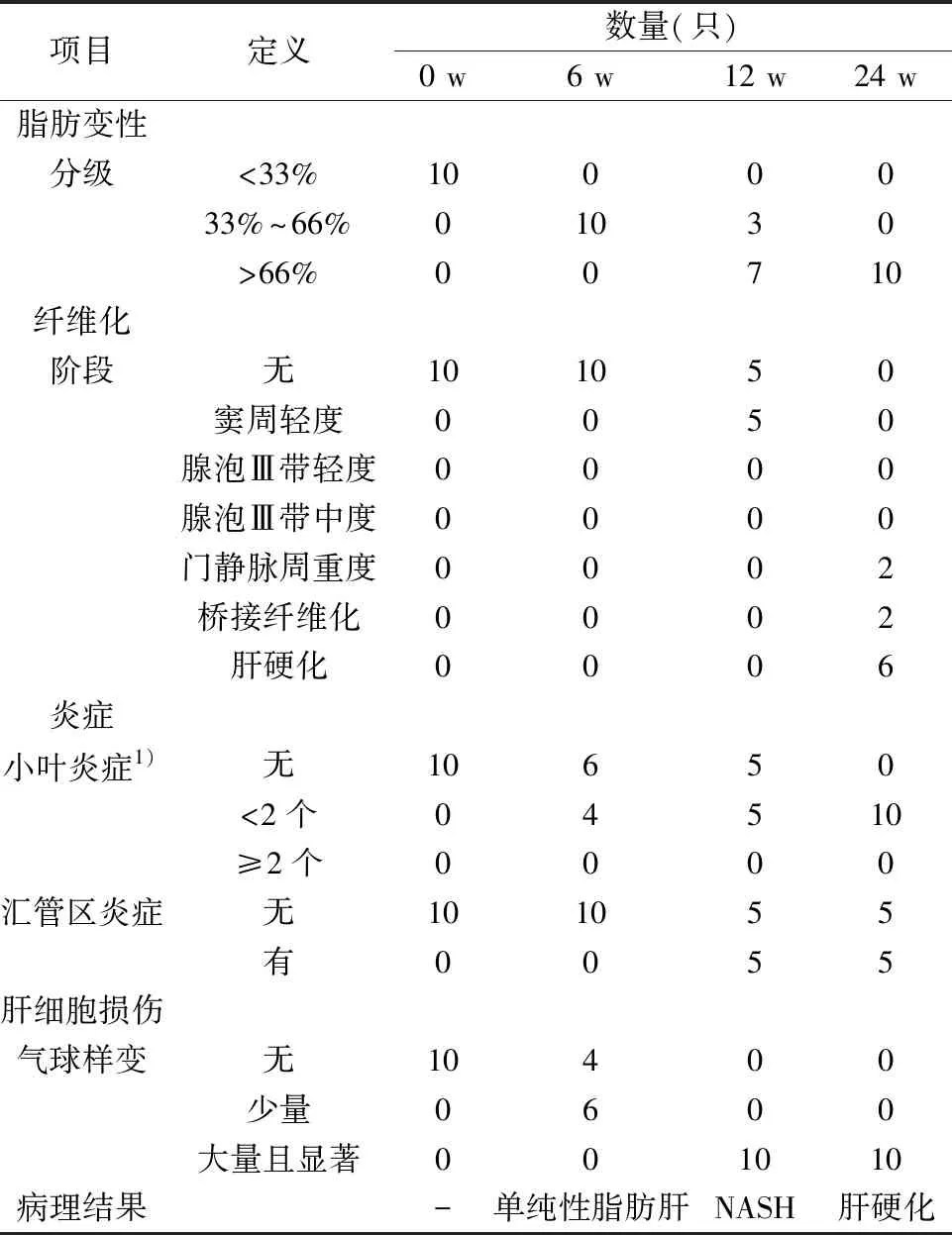
表1 模型动物不同阶段临床指证打分表
1)显微镜下200倍视野
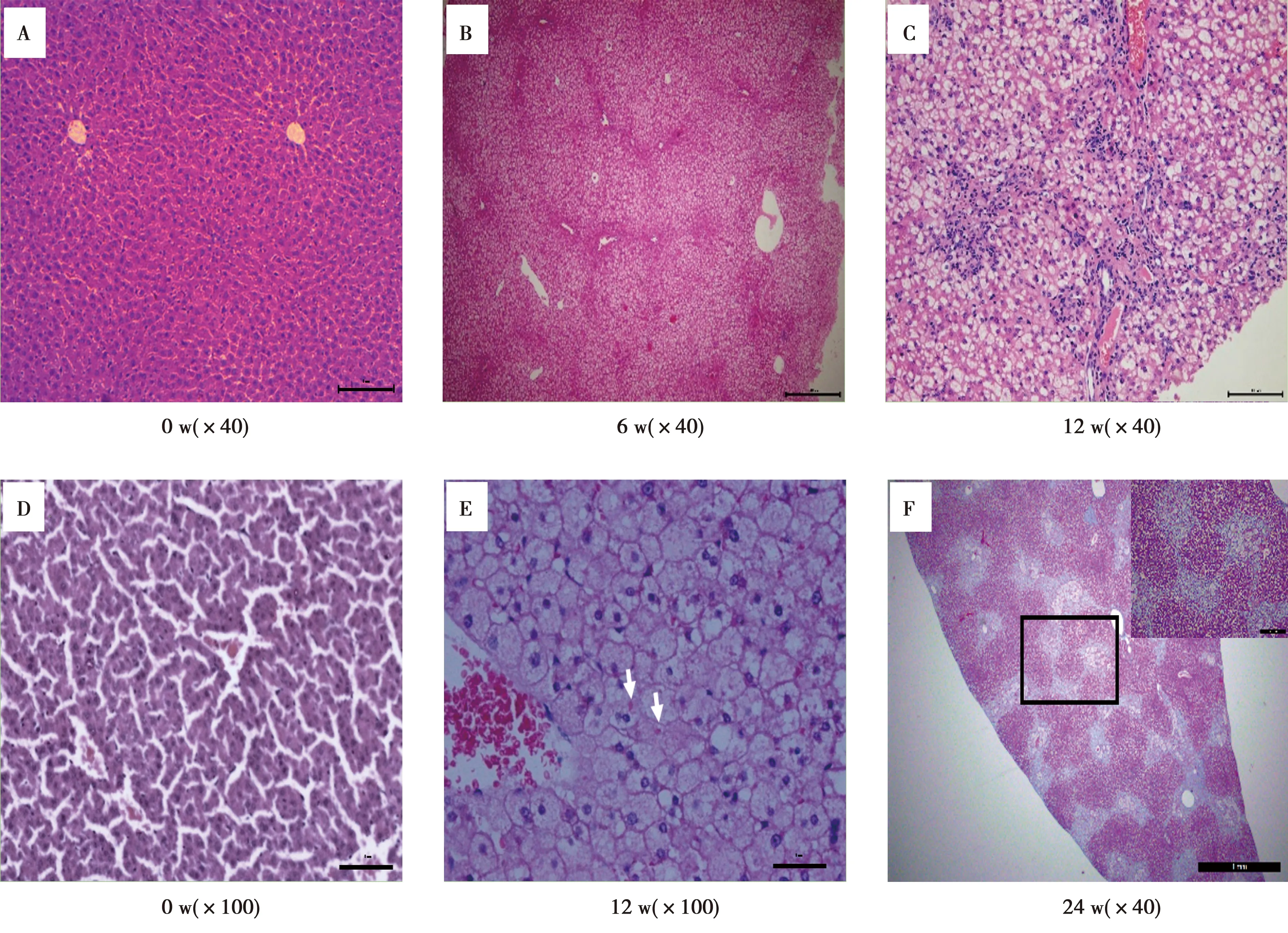
图2 沙鼠HFD饲喂不同时间的肝脏病理变化(HE)
2.3电镜下各组动物肝细胞超微结构及星状细胞形态学观察 0 w组动物肝细胞内散在少量的异染色质团块,核质有均质细颗粒,胞质中线粒体呈现椭圆形或杆状、电子密度较低,细胞核及胞质无异常变化(图3A)。NASH动物模型肝细胞内出现脂滴,部分细胞出现细胞核变形、边缘化,或核收缩变小、浓缩、甚至仅留下一个致密的团块,出现凋亡;线粒体高度肿胀,密度增高并呈现多种形态(图3B)。肝硬化阶段动物肝细胞细胞核不规则,核边聚,染色质浓缩凝结成块,胞质内出现大量沟裂和空泡等,部分细胞可见凋亡小体;出现细胞膜、核膜破损,细胞坏死性死亡;线粒体高度肿胀,密度更高并呈现多种形态。内质网扩张,星状细胞激活,胞质中脂滴消失,周围有纤维束形成(图3C;3D)肝细胞外及狄氏窦胶原纤维增生。
2.4Western印迹法检测各组CollagenⅠ、CollagenⅢ、TIMP1及MMP13蛋白表达情况 CollagenⅠ、CollagenⅢ在各组肝脏中的表达呈逐渐增强的趋势,肝硬化时有显著性升高(P<0.01,P<0.001)。特异性分解肝脏胶原蛋白的MMP13在肝硬化时明显降低(P<0.01),TIMP1则明显升高(P<0.001)。见表2,图4。
表2 饲喂不同时间CollagenⅠ、Collagen Ⅲ、TIMP1及MMP13蛋白表达变化
与0 w组比较:1)P<0.05,2)P<0.01,3)P<0.001
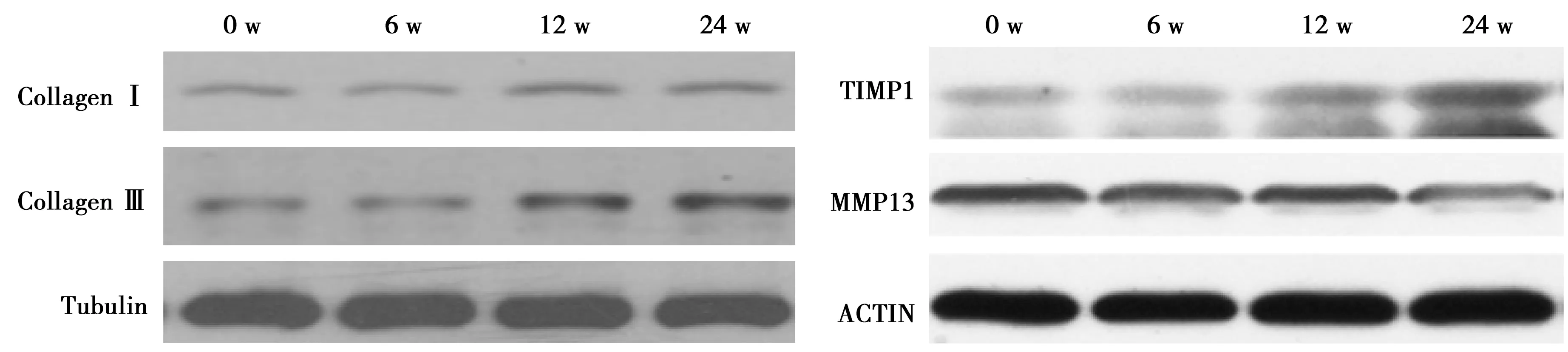
图4 饲喂后各时间点CollagenⅠ、CollagenⅢ、TIMP1及MMP13蛋白表达变化
3 讨 论
NAFLD具有代谢综合征的所有特征,目前大多数学者已经将NAFLD作为代谢综合征的组分之一,或代谢综合征在肝脏的表现〔16〕。而长爪沙鼠已被用于建立高胆固醇血症、Ⅱ型糖尿病模型等代谢综合征模型,课题组前期选择长爪沙鼠成功的构建了NASH模型,并验证了模型有较好的稳定性〔17,18〕。病因学调查发现,过去30年NAFLD患病率的增加主要是由于食物数量和成分改变所致,表现为饮食中高热量、高脂肪等特点的西方膳食结构模式〔4〕。现有的NAFLD模型中,HFD饮食诱导模型的病因、发病背景方面与此类似。已有的HFD饮食诱导模型具有血脂紊乱、胰岛素抵抗等代谢综合征表现,镜下可见脂肪变性、肝小叶炎症、气球样变性。但它形成的肝脏纤维化、炎症改变较轻,不能形成肝硬化。模型与人类疾病的发生发展仍然存在较大差异,这些差异部分是病因的差异,更急需解决的是疾病谱的差异,尤其是全谱模型的缺乏〔19,20〕。本研究模仿人类疾病高风险因素长期高脂饮食、男性、血脂紊乱等条件〔21〕,利用长爪沙鼠得到了NAFLD可以发展到肝硬化的全谱模型。本研究首次对NAFLD全谱模型进行全程监测,重点研究模型发展与形成肝硬化阶段。沙鼠NAFLD与临床患者有一定的相似性,与现有HFD饮食模型相比,沙鼠模型表现出更严重的组织病变,更深入的阶段发展,模型后期病理及胶原蛋白的检测结果,及文献对模型后期羟脯氨酸含量的检测结果〔17〕,均可证实模型经过单纯性脂肪肝和NASH阶段后,形成了肝硬化。在形成的过程中,首先发生了肝星状细胞活化,之后产生了以胶原蛋白为代表的细胞外基质的沉积。在经历了“胶原带-桥接纤维化-肝硬化”典型发展模式后,最终形成了肝硬化。
肝硬化的实质是Collagen Ⅰ、CollagenⅢ等细胞外基质在肝内大量异常沉积。模型在纤维化前发生了星状细胞活化,在各种原因导致的肝纤维化形成过程中都具有核心地位。星状细胞激活后表达CollagenⅢ,随后在数量上和活性上增加产生了CollagenⅠ。另外,特异性降解细胞外基质的间质胶原酶活性下降是肝硬化形成的主要原因〔22〕。MMPs是降解细胞外基质的蛋白水解酶,其中,MMP13是主要的间质性胶原酶,是除中性粒细胞胶原酶外唯一特异性分解肝脏胶原蛋白的MMP。TIMPs是MMPs的主要特异性抑制物,目前发现肝内主要存在TIMP1和TIMP2。在病理状下,其中TIMP1表达增强更为显著,而肝纤维化时MMP13的活性主要受TIMP1抑制。本实验结果表明,MMP13及TIMP1在0 w组动物肝组织少量表达,随饲喂延长MMP13表达虽有降低,TIMP1表达增强更为显著,二者平衡被破坏。大量TIMP1的出现使MMP13失去活性,致使细胞外基质成分降解减少,沉积增多,促进了肝纤维化的发展,形成肝硬化。
NAFLD发展到肝硬化是多方面原因造成的,氧化应激和脂毒性对线粒体损伤是NAFLD发展的关键作用〔23〕。课题组前期对沙鼠NAFLD模型的研究发现其肝脏存在超氧化物歧化酶(SOD)活性下降及游离脂肪酸在肝脏的堆积〔18〕。肝游离脂肪酸和胆固醇积累引起细胞损伤。在氧化应激条件下,过量的胆固醇会自动氧化生成氧甾醇。肝脏中游离脂肪酸和非酶促氧甾醇协同促进NAFLD的发生发展,损害线粒体功能、能量平衡和对慢性损伤的修复〔24〕。研究表明NASH患者存在肝细胞线粒体超微结构的损伤,且肝脏脂质含量与线粒体损伤密切相关。沙鼠模型存在SOD降低等氧化应激〔18〕,肝硬化时发生了细胞凋亡,推测氧化应激诱导的线粒体DNA损伤最终导致肝细胞凋亡。细胞凋亡及星状和库普弗细胞生成的细胞因子进一步增强了纤维化的变化,促进了疾病的发展。
肝脏近中央静脉的肝腺泡Ⅲ带细胞由于再生能力弱,营养条件差,肝损伤时往往最先出现腺泡Ⅲ带细胞的变性坏死。与人类疾病相似,模型脂质聚集首先发生在肝腺泡Ⅲ带细胞。本实验还观察到模型气球样病变、炎细胞浸润,乃至后期出现的肝纤维化,也都首先出现在肝腺泡Ⅲ带细胞。对NAFLD各个病理阶段的治疗与预防中,应先考虑对肝腺泡Ⅲ带细胞的保护和干预。
