骨保护素基因修饰的骨髓间充质干细胞治疗大鼠骨质疏松
2019-07-04柏小金黄文良柏帆郑强向柄彦
柏小金 黄文良 柏帆 郑强 向柄彦
(遵义市第一人民医院 遵义医科大学第三附属医院骨科,贵州 遵义 563000)
骨质疏松(OP)在绝经后女性中患病率显著增加〔1,2〕,严重影响中老年人的身体健康和生活质量〔3~6〕。骨保护素(OPG),又称护骨素、破骨细胞生成抑制因子,属于肿瘤坏死因子超家族成员,主要由成骨细胞和骨髓基质细胞合成、分泌〔7〕。OPG是细胞核因子-κB受体活化因子配体(RANKL)的天然阻滞受体,可竞争性的抑制其与细胞核因子-κB受体活化因子(RANK) 的结合〔8~10〕,进而抑制破骨细胞的增殖活化〔11〕,并抑制成骨细胞对破骨细胞的激活功能和破骨细胞的骨吸收活性〔12,13〕,以减少骨吸收,增加骨密度,此外,OPG还能促进破骨细胞的凋亡〔14〕。骨髓间充质干细胞(BMSCs)来源于骨髓,取材简便,易于分离及培养,可分泌多种细胞生长因子,具有成骨、成软骨等多向分化能力,此外,BMSCs具有低免疫原性的特性,可在体外增殖分化,是细胞移植、再生修复及基因治疗等方面的理想种子细胞〔15,16〕。本实验拟采用绿色荧光蛋白(GFP)标记的携带OPG基因的慢病毒(LV)载体(LV-OPG-GFP)感染SD大鼠BMSCs,构建成OPG基因修饰的BMSCs(LV-OPG-GFP-BMSCs),并将其通过尾静脉注射至去卵巢SD大鼠骨质疏松模型体内,通过全身“给药”的方式,观察其治疗去卵巢SD大鼠骨质疏松的效果,以期为骨质疏松的治疗提供一定的实验及理论依据。
1 材料及方法
1.1主要实验动物、材料及试剂 LV-OPG-GFP慢病毒重组载体(上海吉凯生物);健康雌性SD大鼠〔许可证号:SCXK(渝)2012-0005〕,3月龄,第三军医大学大坪医院实验动物中心提供;胎牛血清、DMEM/F12(Gibco);胰蛋白酶、青链霉素(Hyclone);大鼠骨碱性磷酸酶(B-ALP)酶联免疫吸附试验(ELISA)试剂盒、大鼠Ⅰ型胶原C端肽(CTX-1)ELISA试剂盒(武汉华美);RT-PCR 引物及试剂(Takara)。
1.2主要实验仪器 双能X线骨密度测量仪(Siemens);全自动生化分析仪、低温离心机(Beckman);倒置荧光显微镜(Olympus);CO2培养箱(Panasonic);快速梯度PCR仪、凝胶成像系统(Bio-Rad);纯水制备系统(Millipore)。
1.3BMSCs分离及培养 选取健康雌性SD大鼠1只,颈椎脱臼法处死,无菌条件下取大鼠股骨和胫骨,无菌磷酸盐缓冲液(PBS)冲洗,彻底清除骨表面的软组织,咬骨钳咬除股骨和胫骨两端,用DMEM/F12培养基反复冲洗髓腔至发白,反复吹打细胞悬液后,200目细胞筛网过滤,收取过筛细胞悬液,1 000 r/min离心5 min,去上清液,用DMEM/F12完全培养基重悬后,以1.0×104个/ml的密度接种于培养瓶内,置于5% CO2、37℃细胞培养箱中培养,48 h半换液,72 h全换液,以后每隔2 d换液1次。每天在倒置显微镜下观察并记录细胞的生长情况,当细胞长至瓶底面积80%左右时,按照1∶3的比例进行传代培养。
1.4慢病毒重组载体LV-OPG-GFP感染BMSCs 选用第3代BMSCs,胰酶消化后重悬,进行细胞计数后,按5×104个/ml的细胞密度接种在6孔板中,每孔2 ml,置于细胞培养箱中培养24 h后,更换2 ml新的培养液。分别设置实验组(LV-OPG-GFP)、阴性对照组(LV)及空白对照组(不加任何转染试剂)。加入 10 mg/ml 聚凝胺(Polybrene)2 μl,混匀后放入细胞培养箱中培养1 h。期间,从-80℃冰箱取出病毒液,放置于4℃冰箱融化,完全融化后,从细胞培养箱中取出6孔板放入生物安全柜内进行转染。本研究前期预实验已证实感染复数(MOI)=80时,细胞转染率可达80%以上,由此计算所需病毒量,并按分组进行细胞感染,混匀后放入细胞培养箱中培养,24 h后观察细胞生长状态,弃掉原培养基,更换完全培养基。72 h后,采用DAPI进行细胞核染色用倒置荧光显微镜观察其绿色荧光的强度,并收集感染后的BMSCs,采用Trizol法提取总RNA,进行PCR后做电泳观察。
1.5大鼠骨质疏松模型的建立 选取健康雌性SD大鼠40只,随机分为对照组(8只)与模型组(32只)。 模型组:称重后,予以适量1%戊巴比妥钠(10 mg/kg)麻醉,腹部备皮,仰卧位固定于操作台上,消毒、铺无菌巾后,逐层切开皮肤、肌肉,进入腹腔,找到子宫,沿子宫向上找到卵巢,结扎并切除卵巢,无菌生理盐水冲洗后,逐层关闭腹腔,术后3 d予以青霉素钠预防感染。对照组:术前及术后处理同模型组,不切除卵巢,仅切除等量脂肪组织。造模后大鼠单笼饲养于遵义医科大学动物中心同一房间、通风良好、室温25℃、自由摄食、饮水。3个月后采用双能量X线骨密度检查法检测两组SD大鼠脊柱全长的平均骨密度,确定建模是否成功。
1.6骨质疏松大鼠模型的分组及LV-OPG-GFP-BMSCs尾静脉注射治疗 将成功建立的骨质疏松大鼠模型(32只),随机分为A、B、C、D四组,每组8只,采用大鼠尾静脉注射法〔17〕进行干细胞注射治疗。其中A组,注射等量生理盐水;B组,BMSCs,1×106/kg;C组,注射LV-BMSCs,1×106/kg;D组,注射LV-OPG-GFP-BMSCs,1×106/kg〔18〕。各组饲养条件不变。
1.7LV-OPG-GFP-BMSCs治疗大鼠骨质疏松效果评价 在治疗后3个月,通过双能量X线骨密度检查法检测A、B、C、D四组大鼠的骨密度。采用1%戊巴比妥钠麻醉大鼠,通过断尾法收集A、B、C、D四组及1.5中对照组大鼠外周血液约2 ml,分别用全自动生化分析仪测定血清中钙、磷含量,并用ELISA 法测定血清中 B-ALP和CTX-1水平,具体操作方法参考各自试剂盒说明书。
1.8统计学处理 使用SPSS18.0软件进行独立样本t检验,单因素方差分析。
2 结 果
2.1BMSCs的提取及培养 BMSCs在接种48 h后,基本完全贴壁,贴壁的细胞多呈梭形或多角形,表现出典型的鱼群样或漩涡样生长,培养5~6 d后细胞逐渐融合并铺满瓶底,传至第3代后,细胞基本呈纺锤形或梭形,形态基本一致,见图1。
2.2慢病毒重组载体LV-OPG-GFP感染BMSCs效果 将LV-OPG-GFP以MOI=80的病毒量感染BMSCs 72 h后,普通光镜下观察发现,实验组细胞生长状况可,与阴性对照组相比,未出现明显的细胞生长缓慢及死亡现象。采用倒置荧光显微镜观察发现,实验组目的基因OPG已成功转入BMSCs中并能稳定表达,细胞转染率可达 80%以上,而阴性对照组因不含GFP基因及其表达产物,故无绿色荧光表达,仅作为细胞生长状况及荧光空白对照,见图2。PCR后电泳结果显示,实验组OPG mRNA在500~700 bp处出现明显的条带,与理论结果相符,而阴性对照组和空白对照组均无表达,提示重组后OPG基因可在BMSCs中稳定表达,见图3。
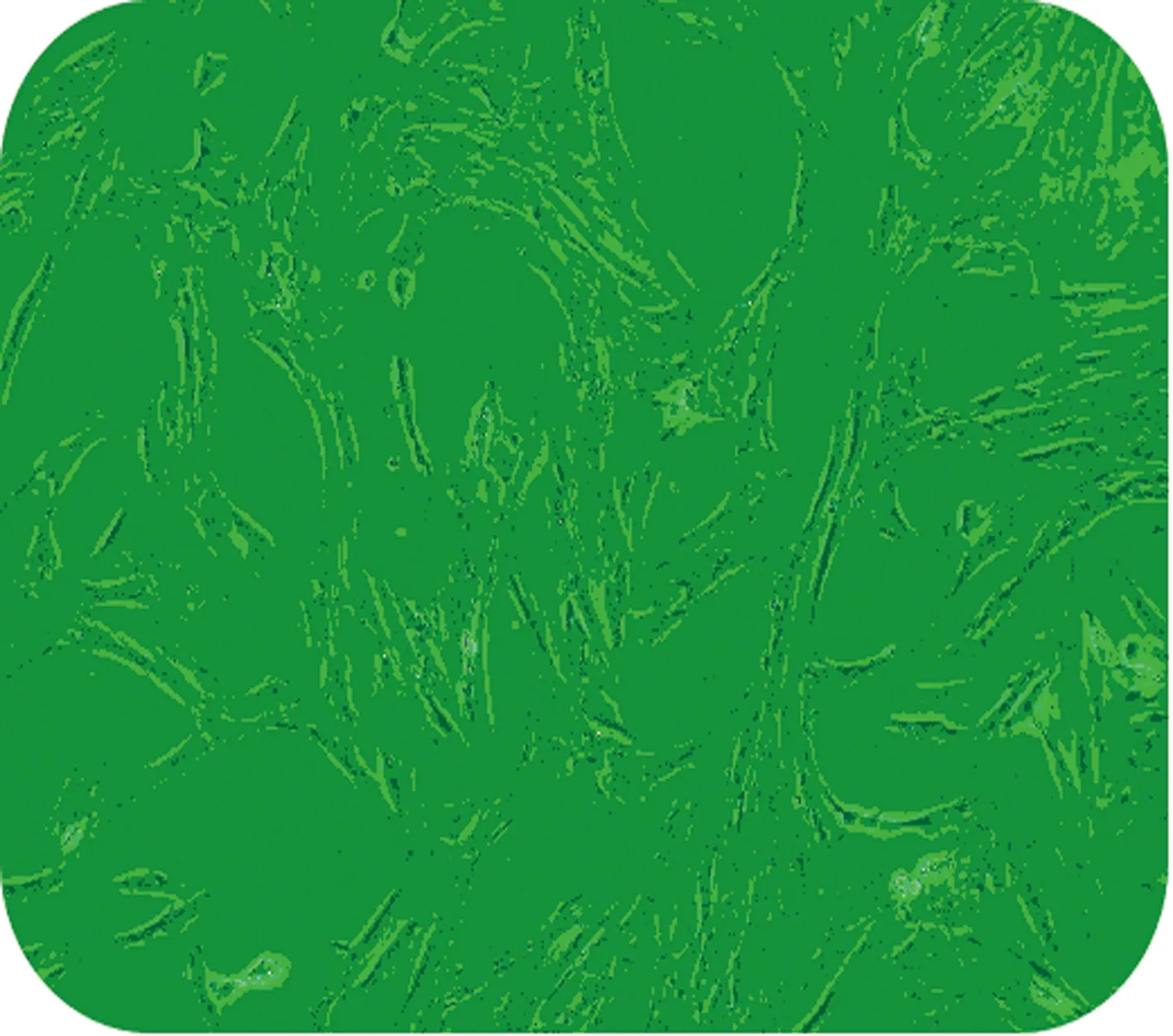
图1 SD大鼠第3代BMSCs形态学观察(×100)
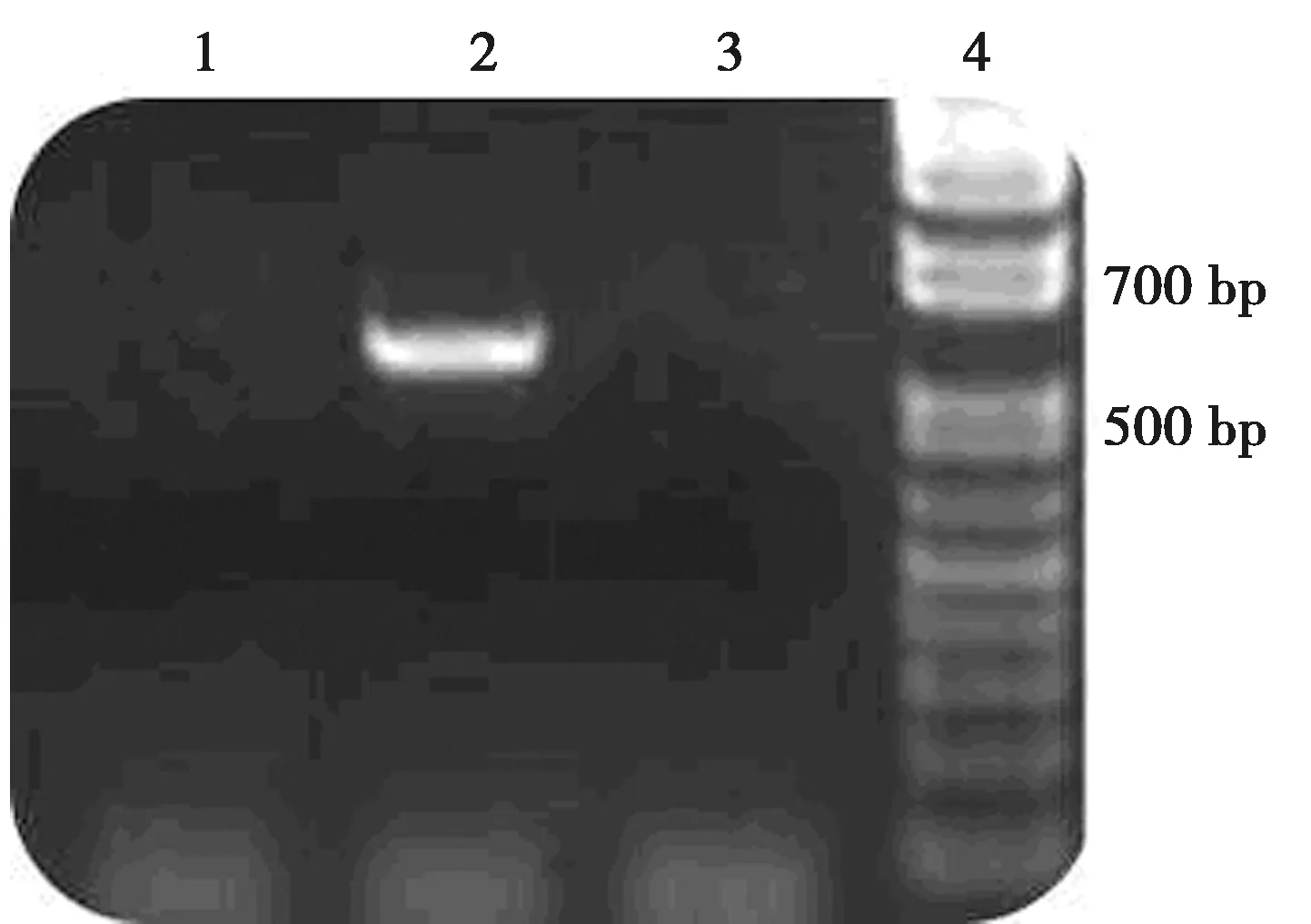
1:空白组;2:实验组;3:阴性对照组;4:Marker图3 PCR检测三组OPG mRNA的表达
2.3SD大鼠骨质疏松模型构建效果 与对照组〔(0.239±0.005)g/cm2〕相比,模型组骨密度下降明显〔(0.198±0.013)g/m2,P<0.05〕。说明双侧卵巢切除可以引起大鼠骨质疏松,提示造模成功。
2.4LV-OPG-GFP-BMSCs尾静脉注射治疗大鼠骨质疏松效果评价
2.4.1骨密度检测结果 尾静脉注射LV-OPG-GFP-BMSCs治疗大鼠骨质疏松3个月后,各组大鼠生长状况可,未出现死亡及明显衰弱现象。B、C、D三组骨密度均高于显著A组(P<0.05),D组骨密度显著高于B、C组(P<0.05),说明通过尾静脉注射LV-OPG-GFP-BMSCs治疗,可大幅度的增高骨质疏松大鼠的骨密度,起到治疗作用,但显著低于正常组(P<0.05),可能与观察时间不足有关;B组与C组相比无明显差异(P>0.05),将二者与2.3中模型组相比,发现B、C组骨密度未进行性降低(P>0.05),而A组骨密度则出现进行性降低(P<0.05),说明BMSCs注入大鼠体内后具有一定的缓解骨质疏松加重的作用,可能与BMSCs在体内持续释放各种生长因子相关,而LV在大鼠体内不影响骨密度变化,见表1。
表1 治疗3个月后各组骨密度、血钙、血磷、B-ALP及CTX-1水平比较
与A组相比:1)P<0.05;与B组相比:2)P<0.05;与C组相比:3)P<0.05;与D组相比:4)P<0.05
2.4.2血清中钙、磷检测结果 血清中钙、磷检测结果显示,A、B、C三组间无明显差异(P>0.05),D组及正常组血钙含量均显著低于A、B、C三组(P<0.05),而磷含量均显著高于A、B、C三组(P<0.05);D组与正常组相比无明显差异(P>0.05),说明建模后大鼠模型血钙、血磷发生了变化,可能与卵巢切除后破骨细胞的活动增强有关。通过尾静脉注射LV-OPG-GFP-BMSCs治疗后,可使大鼠模型的血钙明显降低,而血磷明显升高,并恢复至正常水平,可能与OPG基因在大鼠体内持续表达,对破骨细胞活性产生抑制,使破骨作用减弱有关,见表2。
2.4.3血清 B-ALP 测定结果 血清B-ALP测定结果显示,A、B、C三组间无明显差异(P>0.05),D组及正常组血清B-ALP水平均显著低于A、B、C三组(P<0.05),而D组与正常组相比无明显差异(P>0.05)。说明A、B、C三组成骨细胞的活性增强,可能是由于大鼠模型的卵巢切除后导致破骨细胞活性增强,反馈性的引起成骨细胞活性也随之增强,以代偿及维持体内钙磷代谢平衡,此外也说明仅注射BMSCs对成骨细胞的活性无明显影响;而通过尾静脉注射LV-OPG-GFP-BMSCs治疗后,D组成骨细胞活性明显下降,基本恢复到正常水平,可能是由于OPG基因在大鼠体内表达,使破骨细胞活性受抑制,成骨细胞活性也随之反馈性的下降。说明尾静脉注射LV-OPG-GFP-BMSCs后,对大鼠骨质疏松有一定治疗作用,见表2。
2.4.4血清CTX-1测定结果 血清CTX-1测定结果显示,B、C、D及正常组CTX-1水平均显著低于A组(P<0.05),B组及C组无明显差异(P>0.05),D组及正常组CTX-1水平显著均低于B、C组(P<0.05),但D组CTX-1水平显著高于正常组(P<0.05)。说明卵巢切除后破骨细胞活性明显增强,B组、C组注射BMSCs对破骨细胞的性仅能产生轻微抑制,而通过尾静脉注射LV-OPG-GFP-BMSCs治疗后,D组破骨细胞活性明显下降,基本接近正常水平,可能是由于OPG基因在大鼠体内表达,使破骨细胞活性明显受抑制,而起到治疗骨质疏松的作用,见表2。
3 讨 论
骨质疏松严重影响患者生活质量,主要累及中老年女性,骨质疏松性疼痛及骨折是导致患者生活质量下降的主要原因。目前临床上有种类繁多抗骨质疏松的药物,但在应用过程中存在疗程长、副作用明显及依从性差等缺点〔19〕。随着基因技术的不断发展,基因治疗作为一种新的治疗方法被广泛研究。OPG基因自1997年被发现以来就备受关注〔20〕,其抑制破骨细胞增殖活化、减少骨吸收、增加骨密度的作用已被研究证实〔21,22〕,目前多数研究者认为OPG/RANKL/RANK信号系统是治疗骨质疏松的最相关靶向位点,尤其以OPG/RANKL的变化规律更为重要〔10,23~26〕。BMSCs具有多向分化功能,可分泌多种细胞生长因子,在骨组织再生及修复方面备受关注,研究发现其向成骨分化的多少是骨质疏松发病的重要机制〔27,28〕,因此,将BMSCs作为OPG基因的表达载体可能更有利于骨质疏松的治疗。本研究成功提取培养出SD大鼠BMSCs,并用慢病毒重组载体LV-OPG-GFP感染BMSCs构建OPG基因体内表达载体,结果显示重组后OPG基因可在BMSCs中稳定表达。
大鼠的骨骼变化与人类相近,目前公认的与临床最相似的绝经后骨质疏松动物模型是采用去势法构建的去卵巢大鼠模型,因其成功率高、稳定性好,使该种方法得到了广泛应用〔29,30〕。美国食品与药物管理局(FDA)和世界卫生组织(WHO)也推荐去卵巢大鼠为研究绝经后骨质疏松的最佳动物模型〔31〕。本研究亦采用此法将雌性SD大鼠双侧卵巢切除,3个月后模型组SD大鼠骨密度下降明显,说明绝经后SD大鼠骨质疏松模型构建成功。
骨质疏松是全身性的代谢性疾病,表现为全身性的骨量减少,骨密度降低,因此本研究采用尾静脉注射法将载有OPG基因的BMSCs注入去卵巢SD大鼠骨质疏松模型体内,通过全身“给药”的方式治疗并观察其效果。
治疗3个月后,骨密度检测结果表明通过尾静脉注射LV-OPG-GFP-BMSCs治疗,可大幅度的增高骨质疏松大鼠的骨密度,起到治疗作用,但与正常骨密度相比,仍略显不足。BMSCs仅具有一定的缓解骨质疏松加重的作用,可能与BMSCs在体内持续释放各种生长因子相关。血清中钙、磷、B-ALP 及CTX-1水平的升降变化也说明在尾静脉注射LV-OPG-GFP-BMSCs治疗后,OPG基因在大鼠体内持续表达及BMSCs在体内释放多种生长因子,二者协同,对破骨细胞活性产生抑制,使破骨作用减弱,导致血钙下降,血磷升高,基本恢复至正常水平,而CTX-1作为反映破骨细胞活性及骨吸收的特异性蛋白,也随之下降;B-ALP则是反映成骨细胞活性的特异性蛋白,其降低可能是因为破骨细胞活性减弱时,成骨细胞活性也随之反馈性的下降,以维持骨代谢平衡。
综上,尾静脉注射LV-OPG-GFP-BMSCs治疗SD大鼠骨质疏松,未出现明显的毒副作用,治疗效果良好,可为临床骨质疏松的治疗提供一定实验依据。但本研究仅在整体的角度上对LV-OPG-GFP-BMSCs的短程治疗效果进行评价,而对于LV-OPG-GFP-BMSCs在大鼠体内的富集、归巢、分化、分泌及长期安全性有待进一步研究证实。
