β-catenin、COX-2、15-PGDH在结直肠癌组织中的表达及意义
2019-07-04蒋海涛徐颖王兴兰杜胜奇钟江利王红
蒋海涛 徐颖 王兴兰 杜胜奇 钟江利 王红
(遵义医学院附属医院 1消化内科,贵州 遵义 563003;2肿瘤科;3呼吸与危重症医学科呼吸二病区)
结直肠癌是消化系统常见的恶性肿瘤,其早期诊断困难、死亡率高,最新报道指出,在全球范围内结直肠癌的发病率占恶性肿瘤第4位(6.1%),死亡率高居第3位(9.2%)〔1〕。结直肠癌的发生发展是多步骤多阶段的复杂过程,目前研究已发现多种信号通路可能参与了结直肠癌的发生发展过程,如Wnt/β-连环蛋白(catenin)、Notch、JAK/STAT3等信号通路〔2,3〕。合成前列腺素的关键限速酶环氧合酶(COX)-2在多种肿瘤尤其是消化道肿瘤组织中表达上调;而前列腺素降解酶15-羟基前列腺素脱氢酶(PGDH)在多种肿瘤组织中表达下调;在结直肠癌的研究中亦有类似的结论。Wnt/β-catenin、COX-2、15-PGDH在结直肠癌演变过程中均发挥了重要作用,但其具体机制及相互作用尚不明确。本实验旨在探讨β-catenin、COX-2、15-PGDH在结直肠癌发生、发展中的作用。
1 材料与方法
1.1标本来源 收集遵义医学院附属医院手术切除的结直肠癌标本30例(肠癌组),内镜下手术切除的结直肠腺瘤标本30例(腺瘤组),正常结直肠黏膜组织10例(正常组)。所有标本病理及临床资料完整,所有手术患者术前均无放、化疗,无非甾体抗炎药治疗。在30例结直肠癌标本中,右半结肠癌9例,乙状结肠癌7例,直肠癌14例,其中男17例,女13例,年龄33~80岁,平均58.5岁,<60岁11例,≥60岁19例。
1.2主要试剂 逆转录试剂盒、扩增试剂盒、引物合成、二喹啉甲酸(BCA)蛋白浓度测定试剂盒为宝生物工程公司提供,鼠抗-β肌动蛋白(actin)、脱脂奶粉为博士德生物有限公司提供,抗前列腺素脱氢酶、抗-β-catenin抗体为Abcam公司提供,兔抗-Cox-2/COX-2为北京博奥森生物技术有限公司提供,辣根过氧化物酶标记山羊抗兔免疫球蛋白(Ig)G(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)为碧云天生物技术研究所提供,焦碳酸二乙酯原液、多聚耐氨酸、通用二抗试剂盒为北京博奥森生物技术公司提供,超低蛋白分子量Marker为Sigma公司提供。
1.3实时荧光聚合酶链反应(RT-PCR)检测mRNA表达 使用Trizol试剂提取组织总RNA,按逆转录试剂盒(宝生物工程有限公司)说明合成cDNA。目的基因β-catenin引物,上游:5′-GCTGATCTTGGA CTTGATATTGGTG-3′,下游:5′-GTCCATACCCAAGGCATCCTG-3′;COX-2上游:5′-CCAGCACTTCACGCATTCCA-3′,下游:5′-GCTGTCTAGCCAGAGTTT CACC-3′;15-PGDH上游:5′-TGACTCATCCTGTCTGCTAACTCCA-3′,下游:5′-AGGGCAAGATATGACA ACATTCCA-3′。内参照β-actin上游:5′-CCAG GGCGTTATGGTAGGCA-3′,下游:5′-TTCCATATCCCAGTTGGT-3′。分别测定COX-2、15-PGDH与内参β-actin的PCR扩增产物的吸光度值,其比值作为待测样本mRNA表达水平。
1.4Western印迹法检测相关蛋白表达 将提取的结直肠组织蛋白与预染蛋白Marker一起上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后电转移至聚偏氟乙烯(PDVF)膜,置于配置好的5%脱脂奶粉/封闭1 h,加入一抗〔目的蛋白:兔抗人多克隆抗体β-catenin(1∶4 000)、COX-2(1∶500)、15-PGDH(2 μg/ml),内参β-actin小鼠抗人单克隆抗体(1∶400)〕;4℃过夜后加入二抗(山羊抗兔、山羊抗小鼠抗体,均以1∶1 000配制),室温孵育1 h,TBST洗膜3次,10 min/次,化学发光试剂(ECL)显色剂完成显色及曝光。
1.5免疫组化法检测相关蛋白表达 所有组织标本石蜡固定后连续切片,经二甲苯脱蜡、梯度酒精水化、柠檬酸盐抗原修复等步骤后,使用免疫组织化学SP法进行染色,二氨基联苯胺(DBA)显色剂显色,所用抗体浓度分别为兔抗人多克隆抗体β-catenin(1∶400)、COX-2(1∶500)、15-PGDH(1∶500)。采用半定量积分法进行结果判定。β-catenin在正常结直肠组织中定位于细胞膜,阳性表达为细胞质、细胞核中出现棕黄色至棕褐色颗粒。COX-2、15-PGDH定位于细胞质或细胞核,阳性表达为胞质、胞核中出现浅黄色至棕黄色颗粒。首先在低倍镜下浏览整张切片,选择高表达区域在高倍镜下进一步观察,共观察5个高倍视野,每个视野记数200个细胞,共计数1 000个,根据染色深度和阳性细胞率分别评估,综合判定。①按染色深度评分:无染色0分,浅黄色颗粒1分,棕黄色2分,深棕色3分。②按阳性细胞的比率评分:阳性细胞数占总细胞数<10%计0分,≥10%且<25%计1分,≥25%且<50%计2分,≥50%计3分;③每张玻片总积分为2项评分相加:0~1分为阴性(-),2分为弱阳性(+),3~4分为阳性(),5~6分为强阳性(),≥2分为阳性表达。
1.6统计学分析 采用SPSS17.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1RT-PCR及Western印迹法检测结果 β-catenin及COX-2 mRNA及蛋白在正常组、腺瘤组、肠癌组表达呈逐渐升高趋势(P<0.05)。15-PGDH mRNA及蛋白在正常组、腺瘤组、肠癌组表达呈逐渐降低趋势(P<0.05)。见图1、表1。
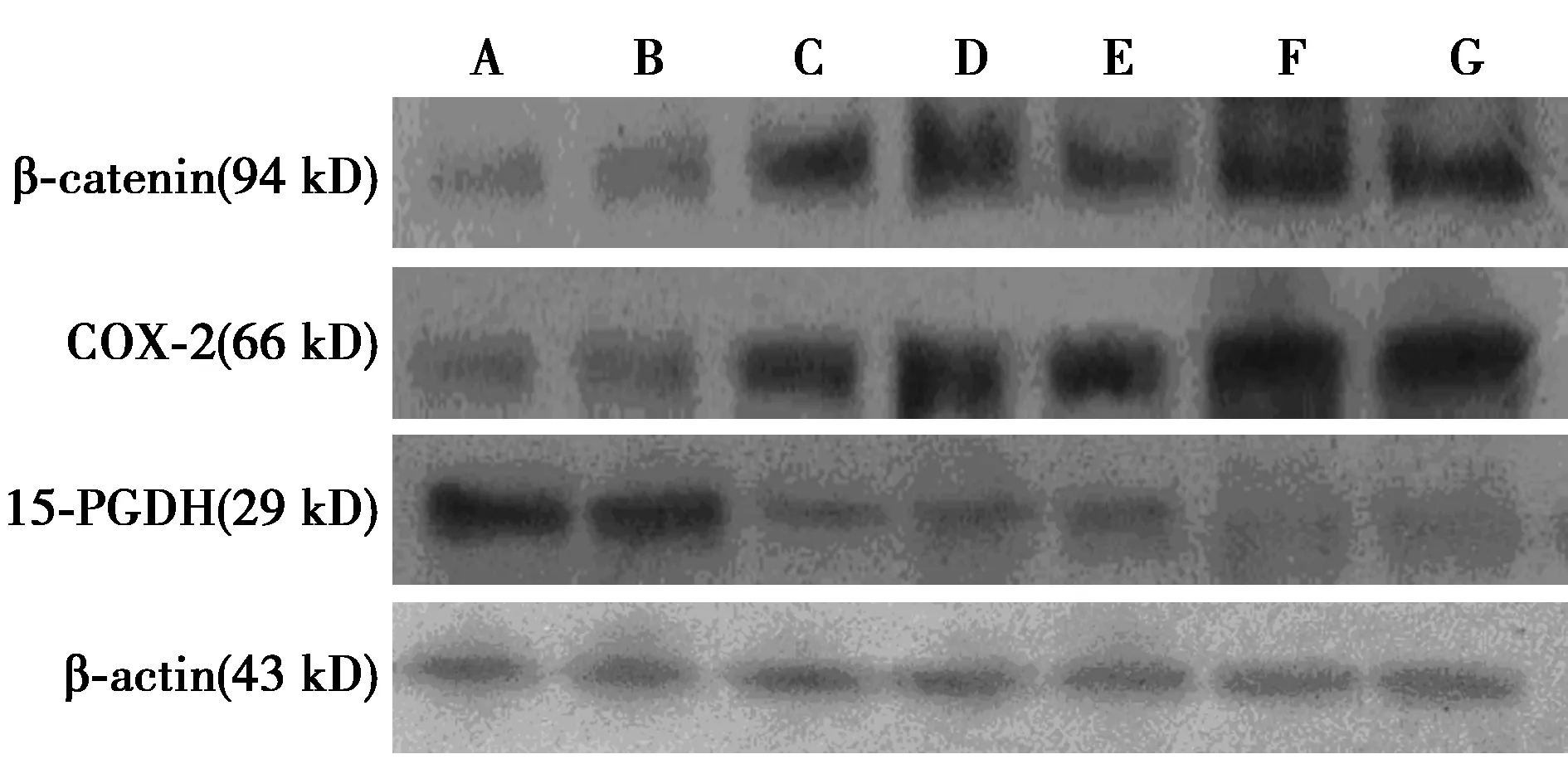
A、B:正常组;C~E:腺瘤组;F、G:肠癌组图1 各组β-catenin、COX-2、15-PGDH 蛋白表达
表1 各组β-catenin、COX-2、15-PGDH mRNA及蛋白表达
与正常组比较:1)P<0.05;与腺瘤组比较:2)P<0.05;下表同
2.2免疫组化结果 β-catenin和COX-2在正常组、腺瘤组、肠癌组的阳性标的率和表达强度均呈逐渐上升趋势(P<0.05)。15-PGDH在腺瘤组和肠癌组中表达明显低于正常组(P<0.05),且腺瘤组显著低于肠癌组(P<0.05)。见图2~4、表2。
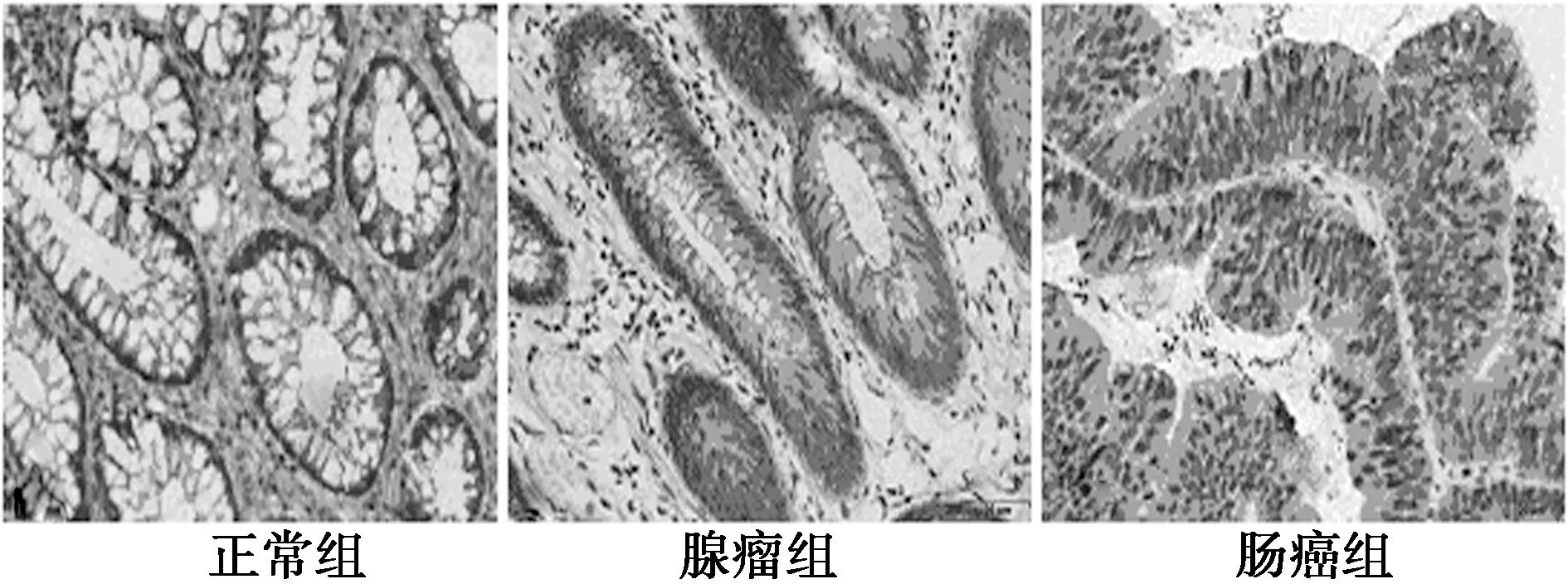
图2 β-catenin在3组中的表达(SP,×400)
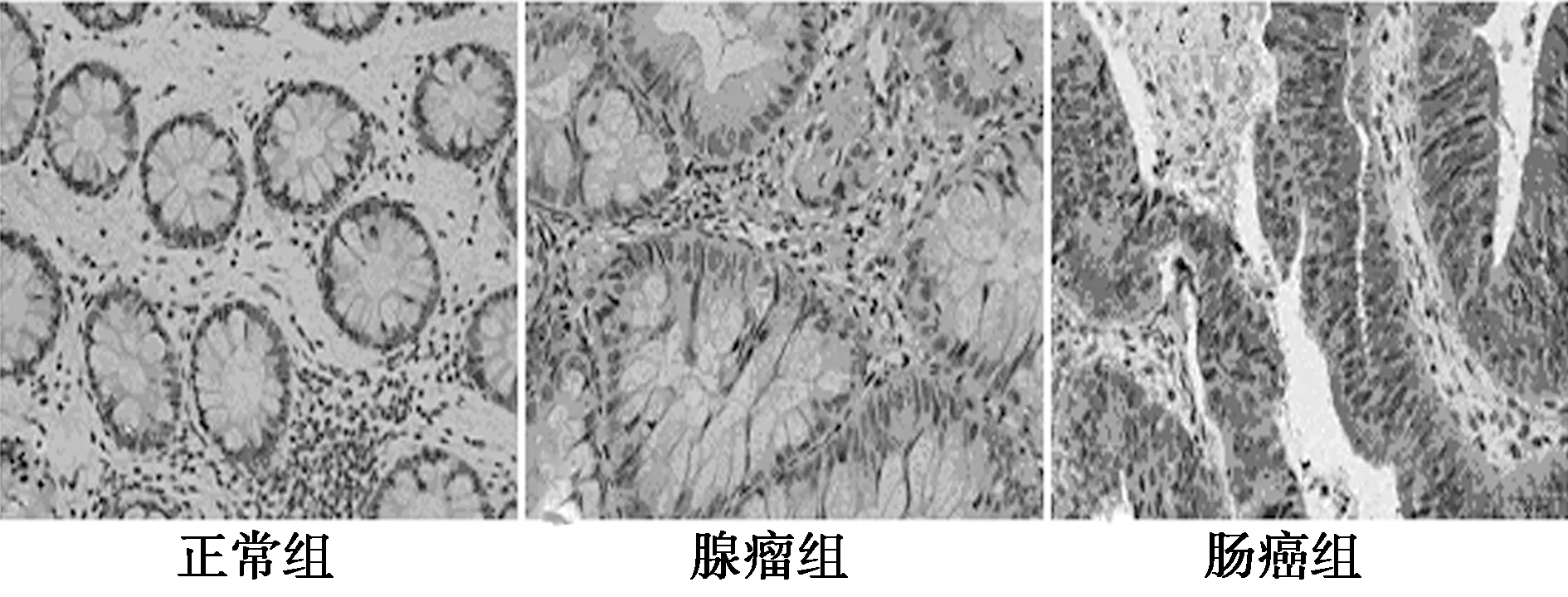
图3 COX-2在3组中的表达(SP,×400)
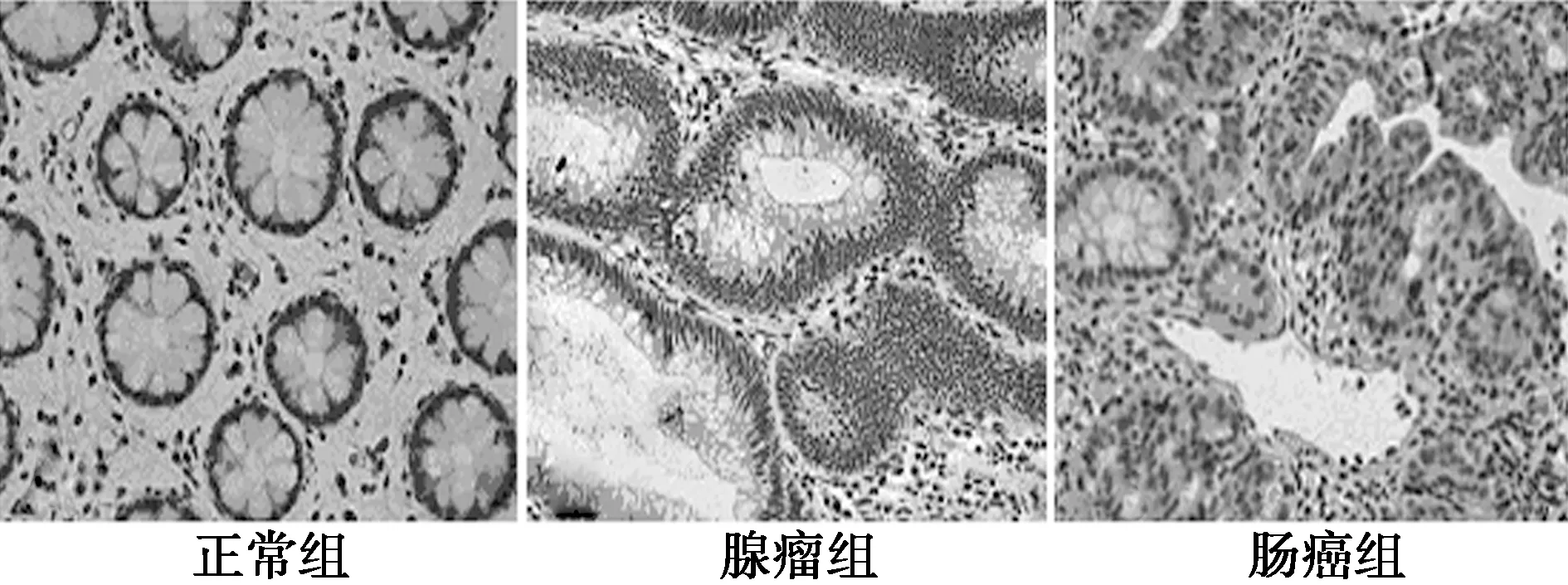
图4 15-PGDH在3组中的表达(SP,×400)
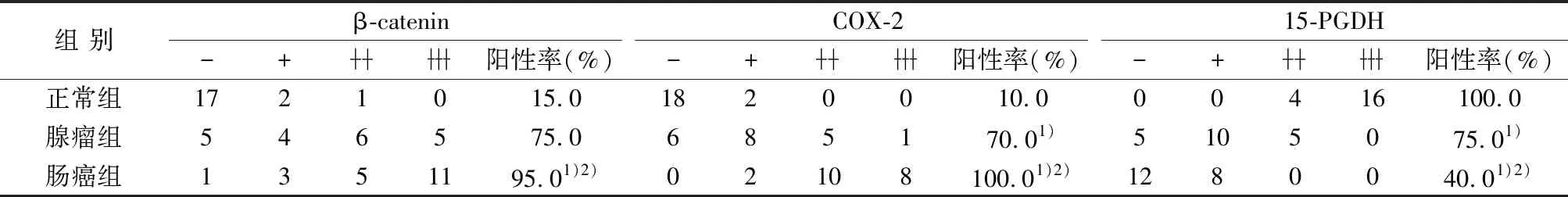
表2 各组β-catenin、COX-、15-PGDH蛋白表达(n,n=20)
3 讨 论
Wnt/β-catenin信号通路调节细胞增殖和分化,精细地调控着细胞的生命活动,是胚胎生长发育必需的重要通路,而该通路的过度激活或异常表达可导致肿瘤发生〔4,5〕。在诸多信号通路中,Wnt/β-catenin信号通路是研究较早、较深入的信号通路之一;在结直肠癌中,有研究发现超过94%的结直肠癌患者存在Wnt信号通路的异常表达和激活〔6〕。Wnt/β-catenin信号通路是经典的Wnt通路,β-catenin是该信号通路的关键蛋白。在正常结直肠组织中,β-catenin表达在细胞膜,在胞质和胞核中少见,当Wnt/β-catenin通路被异常激活后,β-catenin在胞质和胞核出现大量聚集,激活下游的靶基因,使肿瘤干细胞的自我更新和分化功能异常,从而导致肿瘤的发生。本实验表明,在正常结直肠组织、结直肠腺瘤、结直肠癌组织中β-catenin的表达呈逐渐增强趋势。免疫组化结果显示β-catenin在正常结直肠组织中主要表达在细胞膜,在胞质和胞核中鲜有表达,而随着正常组织、腺瘤、结直肠癌的演变,β-catenin在胞质和胞核中出现聚集且逐渐增强,在结直肠癌中表达阳性率最高,阳性强度最强。由此推测,在结直肠组织中β-catenin的高表达极有可能促进了结直肠肿瘤的发生,而β-catenin异位高表达可能是β-catenin在胞质中的降解异常所致。
Wnt/β-catenin在结直肠癌中的研究并非孤立,多种基因与之存在相互作用,研究发现近80%的结直肠癌中出现COX-2阳性表达〔7〕,COX-2被激活后产生的前列腺素(PG)E2使降解复合体解聚,导致β-catenin不能被正常磷酸化和降解,从而激活下游靶基因并促进结直肠肿瘤的发生。亦有研究认为,Wnt信号通路激活后,β-catenin与T细胞因子(TCF)-4结合,而TCF-4正好位于COX-2的转录启动子内,即COX-2是Wnt/β-catenin通路的靶基因之一。COX-2在癌症中研究已久,早在20余年前DuBois等〔8〕的报道就指出85%~90%的结直肠癌和40%~50%有恶变倾向的结直肠腺瘤中出现COX-2的高表达。有国外学者使用人工合成的COX-2选择性抑制剂进行肿瘤的预防、治疗并取得了显著的成果,其主要原因是抑制了PG的合成〔9〕。本研究推测在结直肠组织中COX-2的表达上调极有可能促进了结直肠癌的发生、发展,而β-catenin与COX-2在结直肠癌的发生、发展等过程中是否存在相互关系及其机制目前尚不明确。
COX-2是合成PG的关键限速酶,而15-PGDH是降解前列腺素的关键酶,对COX-2有生理性的拮抗作用。15-PGDH广泛存在于哺乳动物体内,在正常的胃、结直肠、肺、肾、乳腺等组织中均有高水平表达,可催化活性较强的15-羟基PG转化为活性较低的15-酮基PG,从而降解PG〔10〕。近年来,COX-2与15-PGDH在肿瘤中的关系备受关注。Lim等〔11〕研究发现,在结直肠癌中15-PGDH 的阳性率为46.1%,而COX-2的阳性率高达80.5%。Yang等〔12〕进一步研究认为,15-PGDH的早期失活,伴随着COX-2的激活,促进了PGE2的产生,并导致了结直肠癌的发生。本实验结果与国内外研究结果一致,由此推测,在结直肠组织中15-PGDH可能充当COX-2的拮抗剂,抑制COX-2活性的增加从而抑制结直肠癌的发生、发展,发挥抑癌基因的作用。
综上,β-catenin、COX-2在结直肠组织中的异位及异常高表达可能在结直肠癌的发生、发展过程中发挥了关键作用,而15-PGDH在结直肠组织中的表达降低或缺失可能也促进了结直肠癌的发生、发展。
