四种精液处理方法优选冷冻精子的比较
2019-06-24陈娟耿琳琳卢文红张蔚高丽娜李琳
陈娟,耿琳琳,卢文红,张蔚,高丽娜,李琳
(国家卫生健康委科学技术研究所,北京 100081)
近年来不孕不育症患者呈逐年增加的趋势,已成为影响人类发展与健康的一个全球性医学和社会学问题。我国育龄人群中的不孕不育发生率已上升至10%~15%[1],男性不育占其中的30%~40%[2]。随着冷冻生物学和辅助生殖技术的不断发展,供精人工授精(AID)和供精体外受精(IVF-D)作为人类辅助生殖技术之一,成为治疗男性不育症,尤其是无精子症的重要治疗手段[3]。精子优选技术作为AID和IVF-D等辅助生殖技术的主要环节之一,与妊娠结局有着密切的联系。目前常用的精子优选方法包括,洗涤法(simple washing,SW)、密度梯度离心法(density-gradient centrifugation,DGC)、上游法(swim-up,SU)及磁性活性细胞分选法(magnetic activated cell sorting,MACS)。本文通过比较SW、DGC、SU和MACS四种方法对冷冻精液的优选效果,旨在探讨不同精液处理方法对冷冻精液的优选效果,为AID和IVF-D提供可靠的数据。
资料与方法
一、研究对象及试剂、仪器
1.研究对象:收集本中心健康男性志愿者精液标本,并签署知情同意书。精液入选条件:精液液化时间正常,精液质量符合WHO第5版手册正常精液标准。
2.实验仪器及试剂:miniMACSstartingkit和Dead cellremovalkit购于德国美天旎生物技术有限公司;QUINNS Sperm Wash Medium(ART-1006)、PureCeption 24-Determination Bi-Layer Kit(ART-2024)购于秒泉仪器有限公司;精子DNA碎片检测试剂盒和精子活体染色(伊红-苯胺黑染色法)试剂盒购于博锐德生物科技有限公司;生物显微镜(奥林巴斯CX41,日本);机械细胞分类计数器。
二、研究方法
1.冷冻精液标本的制备:精液标本液化,2体积标本中加入1体积甘油-卵黄-柠檬酸盐(GEYC)冷冻保护剂混匀后于30℃孵育10 min,分装标本,每份标本不少于1 ml,于液氮面悬挂熏蒸10 min后投入液氮内保存。
2. 分组:按照不同的精液优选方法设立4个实验组,分别是SW组、DGC组、SU组和MACS组,每组随机使用20例冷冻精液标本。对冷冻精液标本进行复温解冻,记录每份冷冻精液优选处理前后的精子浓度、前向运动精子活率、膜完整性、正常形态率及DNA碎片率。
3.精子优选处理:冷冻精液标本预处理:从液氮中提取冷冻精液标本后立刻放入37℃水浴锅内10 min进行解冻。
洗涤法(SW组):取1 ml解冻精液标本加入2 ml ART-1006混匀后300g离心5 min,吸取并丢弃上清液,加入0.5 ml ART-1006重悬精子沉淀。置37℃温箱内备用。
直接上游法(SU组):取1 ml解冻精液标本置于15 ml无菌锥形离心管中,在精液上方加入1.2 ml培养液形成液层,离心管倾斜45度,放置37℃温箱内孵育1 h后保留上层培养液,300g离心5 min后丢弃上清液,加入0.5 ml ART-1006重悬精子沉淀。置37℃温箱内备用。
非连续密度梯度法(DGC组):在15 ml无菌锥形离心管中制备密度梯度液,用ART-2024制备密度梯度分离液,下层为1 ml 80% Isolate,上层为1 ml 40% Isolate。取1 ml解冻精液缓慢加入密度梯度液上层,300g离心20 min,保留下层精子团,加入2 ml ART-1006洗涤后300g离心5 min,吸取并丢弃上清液,加入0.5 ml ART-1006重悬精子沉淀。置37℃温箱内备用。
磁珠活性细胞分选法(MACS组):取1 ml解冻精液,加入80 μl 1×结合缓冲液(每10×106个精子)和20 μl MACS AnnexinV磁珠(每10×106个精子)混匀室温孵育15 min,加入2 ml ART-1006洗涤,300g离心5 min后去上清,用0.5 ml 1×结合缓冲液重悬,将精子悬液置于磁场分选柱中,结合AnnexinV磁珠的精子被滞留在分选柱中,AnnexinV阴性精子则顺柱流出,用0.5 ml 1×结合缓冲液冲洗分选柱,重复3次,收集AnnexinV阴性精子和冲洗液于15 ml无菌锥形离心管,300g离心5 min,弃上清液,加入0.5 ml ART-1006重悬精子沉淀。置37℃温箱内备用。
4.精液动态学检测:在高倍镜下按照前向运动、非前向运动和不活动对精子进行计数,每份精液至少计数200个精子,重复两次,计算精子浓度、前向运动精子活率。
5.精子形态学检测:用巴氏染色法对精子进行涂片染色,镜下观察200个精子,按WHO第5版手册方法对精子进行形态学检查分类,计算精子总畸形率。
6.精子细胞膜完整性检测:利用精子活体染色法(伊红-苯胺黑染色法)对精子进行涂片染色,镜下观察200个精子,判断精子细胞膜是否完整,计算精子细胞膜完整率。如图1所示,精子若细胞膜不完整,则被染为红色。否则不着色或被染为浅粉色。
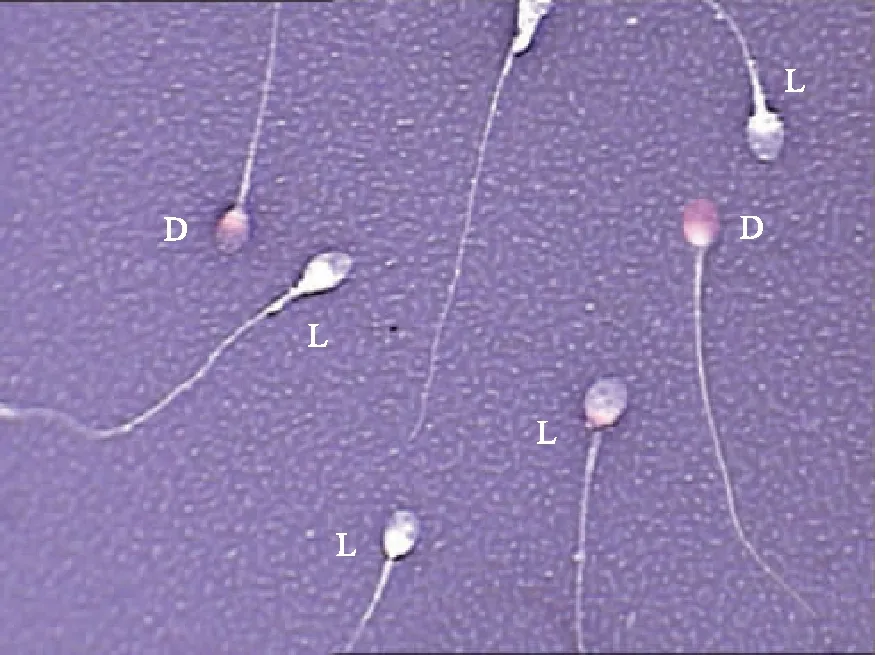
L为细胞膜完整精子(头部为不着色或淡粉色),D为细胞膜不完整精子(头部被染为红色)图1 精子活性染色(细胞膜完整性检测)判断示意图
7.精子DNA完整性检测:取60 μl待测精液标本制备精子熔凝胶,制片后室温放置醋酸溶液(含有0.09%过氧化氢)7 min后移入Tris-HCl缓冲液(含有0.5%十二烷基硫酸钠SDS)25 min进行裂解变性反应,大量纯化水洗涤后,依次用70%、90%、100%乙醇各洗涤2 min,干燥后用瑞士染液进行染色。高倍镜下观察500个精子,如图2所示,精子头部仅产生较小或者没有光晕的即为含有DNA碎片的精子,计算精子DNA完整率。

①:精子DNA碎片判定图示,其中A为精子头部最小直径,B为单侧光晕厚度,当B≤1/3A则表明精子存在DNA碎片;②、③:DNA完整的精子;④、⑤:存在DNA碎片的精子图2 精子DNA完整性判断示意图
三、统计学处理

结 果
一、不同优选方法前后精子回收率及前向运动活动力参数变化比较
统计结果显示,精子总数变化方面,4种优选方法前后均有统计学差异(P<0.05),其中SU组冷冻精子优选前后精子总数变化最大,回收率最低(SW组回收率56.13%,DGC组回收率33.04%,SU组回收率16.77%,MACS组回收率62.87%)。前向运动精子活率方面,DGC和SU组优选后精液的前向运动精子活率显著升高,差异有统计学意义(P<0.05)(表1)。

表1 各组优选前后精子总数及前向运动精子活率比较(-±s)
注:与同组该指标优选前比较,*P<0.05
二、各组精子优选前后形态学变化
统计结果显示,SW组精液优选前后精子膜完整性、正常形态率及DNA完整率,均无显著性差异(P>0.05);DGC、SU和MACS组,优选后精子膜完整率、正常形态率及DNA完整率均显著高于优选前,差异具有统计学意义(P<0.05)(表2)。瑞士染色结果表明,4种优选方法中,MACS在DNA完整率的优化上更加显著,优选前后数值为(69.79±3.90)%、(91.95±2.82)%(图3)。

表2 优选前后精子各项形态参数对比(-±s)
注:与同组该指标优选前相比,*P<0.05

1:优选前;2:SW组;3:DGC组;4:SU组;5:MACS组图3 优选前后精子SCD实验图片(瑞士染色,×40)
讨 论
AID和供精IVF-ET作为治疗男性不育症,尤其是无精子症的重要治疗手段,所采用的精液均是经低温冷冻的精液。新鲜精液经低温冷冻后细胞完整性及DNA完整性均受到一定程度的损伤[4-5],对优胚率、种植率及妊娠率造成负影响[6-7]。为了改善妊娠结局,通过精子优选技术去除冷冻精液的杂质、碎片和冷冻保存液,获得高前向运动精子活率、高细胞形态正常及DNA完整率、少损伤、无凋亡的精子悬液是AID和IVF-D技术中至关重要的环节。
SW法操作简单,处理时间短,但优选效果较差。本实验中,SW组,冷冻精子优选前后精子运动活力、膜完整性、正常形态率及DNA完整率均没有明显改善,结果与以往新鲜精液的研究[7]一致。DGC组通过离心力的作用使得精液中各种成分在密度梯度溶液柱中达到平衡,而停留在各自的等浮力密度点上,从而分离出正常的精子。分离得到的精子前向运动活率、膜完整率、正常形态率及DNA完整性均得到了改善,结果与以往新鲜精液的优化研究[7-8]一致,但反复长时间离心对精子可能造成一定的损伤[9]。SU依靠精子的活力进行优选,优点是由于纯物理作用分离,对精子损伤小,能获得较高前向运动精子活率、膜完整性、正常形态率及DNA完整性的精子悬液。本研究中,SU组优选后,精子前向运动活率、膜完整率、正常形态率及DNA完整性显著改善,结果与以往新鲜精液的优化研究[7]一致,但耗时长,精子回收率低,长时间操作易造成精子损伤[9]。MACS的优选原理是将膜联蛋白V偶联在微小的磁珠上,将精子混悬液同磁珠混匀孵育,磷脂酰丝氨酸(PS)外翻(凋亡)的精子就会吸附在磁珠上[10],将此混合液通过具有磁性的MACS分选柱,吸附凋亡精子的磁珠便会吸附在分选柱上,其他精子则会自由通过[11]。MACS可以很好地去除凋亡精子,从而优化冷冻精液的正常形态率、膜完整性和DNA完整率。本研究中,MACS组优选后,精子膜完整率、正常形态率及DNA完整率均显著高于优选前,结果与以往对于新鲜精液优化的MACS研究结果[12-13]一致。但MACS不能很好地改善冷冻精液的前向运动率。
这4种方法在处理冷冻精子方面各有优缺点,临床可以根据精液标本的质量或者对于精液制备液的要求来选择不同的精子优化方法。SW回收率高,但优化效果差,适用于质量好但精子浓度较低的冷冻精子优化,用于AID的治疗。DGC可以很好地改善冷冻精液的质量,可以应用于AID/IVF-D/ICIS的治疗。SU可以很好地改善冷冻精液的前向运动精子活率、膜完整性和正常形态率,获得的精子悬液在前向运动精子活率以及正常形态率方面优于其他方法,但回收率较低,故可以应用于精子浓度较高但质量较差的冷冻精子的优化或应用于IVF-D/ICSI治疗。4种方法中,MACS可以很好地优选冷冻精液的DNA完整率,但对改善精液前向运动活率没有显著成效。越来越多的研究证明精子核DNA的完整度和精子膜的完整度影响受精后的胚胎发育潜能或导致胚胎发育的异常,从而影响辅助生殖技术临床结局和出生后代的异常[14],故可以将MACS应用于IVF-D/ICSI的治疗,保障具有完整DNA的冷冻精子与卵母细胞受精,从而得到健康后代。目前,已有利用MACS优选新鲜精子后行ICSI成功妊娠并分娩健康婴儿的报道[15]。
SW、DGC和SU目前已广泛应用于临床。MACS对IVF-D/ICSI(尤其是ICSI)的治疗有着得天独厚的优势[16],可以保证受精后胚胎发育的潜能及胚胎正常发育,因此认为MACS在辅助生殖领域的应用具有一定前景。但本研究中每个实验组只使用了20例冷冻精液标本,样本量少,并且缺乏MACS后精液用于临床治疗的受精率、优胚率及妊娠率等数据。所以对于MACS在辅助生殖领域的推广还需要开展更大样本量及多中心的研究加以探讨验证。
