高糖对小鼠精母细胞增殖和凋亡的影响
2019-06-24杜兆金吴雅慧王楠
杜兆金,吴雅慧,王楠
(1.青岛大学附属青岛妇女儿童医院生殖医学中心,青岛 266000;2.威海市立医院妇产科,威海 264200)
糖尿病是一种以高血糖为主要特征的代谢性疾病,流行病学研究表明,随着饮食习惯改变和生活水平提高,世界范围内糖尿病发病率逐年增高,成为威胁人类健康的主要代谢类疾病[1]。患者血糖长期处于较高水平,高糖环境可诱导产生大量自由基,导致细胞氧化应激损伤,影响细胞正常生长,继而出现细胞病变或凋亡[2-3]。据报道,2型糖尿病可导致患者性腺功能下降,精子存活率低[4],但其作用机制尚不清楚。有研究发现,Notch信号通路与高糖诱导的细胞凋亡有关,是多种并发症发生过程中的重要因素[5],然而Notch信号通路在小鼠精母细胞凋亡中的作用尚不清楚。本研究通过观察高糖对小鼠精母细胞GC-2spd细胞生长、凋亡及Notch信号通路的影响,探究高糖诱导小鼠精母细胞凋亡的作用机制,为寻找改善糖尿病患者精子存活情况的治疗方案提供思路。
材料与方法
一、细胞培养及试剂
1.细胞培养:小鼠精母细胞GC-2spd(货号:CRL-2196TM)购自上海酶联生物研究所。小鼠精母细胞复苏后转入M16培养液(含10%胎牛血清),加入链霉素和青霉素,转移至培养箱进行常规培养(5%CO2,37℃),收集生长至对数期细胞。
2.主要试剂与仪器:M16培养液、胎牛血清、葡萄糖购自美国Sigma公司;胰蛋白酶、蛋白提取试剂盒(P0033)、CKK-8试剂盒(C0037)、细胞周期检测试剂盒(C1052)、AnnexinV-FITC细胞凋亡检测试剂盒(C1063),均购自上海碧云天公司;AceQ qPCR SYBR Green Mix(Q121-02)购自南京vazyme生物公司;反转录试剂盒(RR037Q)、Trizol试剂购自日本Takara公司;兔源Notch1抗体、Jagged1抗体、Hes1抗体、cleaved-caspase3抗体、GAPDH抗体、cleaved-caspase9抗体、羊抗兔二抗,均购自美国Abcam公司;自动酶标仪(Elx800)、荧光定量PCR仪购自美国Bio-Rad公司;流式细胞仪(CytoFLEX)购自德国MICROM公司。
二、实验方法
1.实验分组:收集对数期小鼠精母细胞GC-2spd,加入胰蛋白酶(0.25%)对GC-2spd细胞进行消化,转接于6孔细胞培养板(1×105个/孔),待细胞生长至融合度约80%时,分别更换培养基,对细胞进行处理。实验分为两组:(1)对照组:培养液中加入终浓度为5 mmol/L葡萄糖;(2)高糖组:培养液中加入终浓度为30 mmol/L葡萄糖。在高糖诱导48 h后,收集各组GC-2spd细胞,进行后续实验。每组设置6个重复。
2.CKK-8法检测GC-2spd细胞生长情况:收集上述两组GC-2spd细胞,转接至96孔板(5 000个/孔),加入相应浓度葡萄糖的M16培养液进行培养。分别在培养0 h、12 h、24 h、36 h、48 h、60 h和72 h后加入CKK-8试剂,继续培养2 h,收集细胞,按照试剂盒说明书进行操作,采用全自动酶标仪(Elx800)检测各孔细胞在450 nm波长下光密度值(OD)。
3.流式细胞术检测GC-2spd细胞周期和凋亡:收集两组GC-2spd细胞,按照细胞周期检测试剂盒和AnnexinV-FITC细胞凋亡双染试剂盒说明书处理样品,采用流式细胞仪检测,借助CellQuest软件获取实验数据,采用ModFit LT4.0软件分析数据。
4.实时荧光定量PCR(qRT-PCR)检测caspase3、caspase9、Notch1、Jagged1、Hes1基因表达:收集两组GC-2spd细胞,采用Trizol试剂提取总RNA,反转录得到cDNA。按照AceQ qPCR SYBR Green Mix试剂盒说明书对caspase3、caspase9、Notch1、Jagged1和Hes1基因进行扩增,每个浓度设置3个复孔。以GAPDH基因为内参,采用2-ΔΔCT对各目标基因表达情况进行分析。qRT-PCR引物由上海生工生物公司合成,具体序列见表1。

表1 Notch1、Jagged1、Hes1、caspase3、caspase9和GAPDH的qRT-PCR引物序列
5. 蛋白印迹(WB)法检测cleaved-caspase3、cleaved-caspase9、Notch1、Jagged1、Hes1蛋白表达:收集两组GC-2spd细胞,加入1.2 ml蛋白裂解液,逐步提取GC-2spd细胞中总蛋白,采用试剂盒测定蛋白总量。经SDS-凝胶电泳分离后,采用半干转膜仪将凝胶中蛋白质转至PVDF膜上;采用5%脱脂奶粉室温封闭1 h;之后分别加入兔源一抗Notch1抗体、Jagged1抗体、Hes1抗体、cleaved-caspase3抗体、GAPDH抗体和cleaved-caspase9抗体(1∶500)4℃孵育过夜;采用1倍磷酸缓冲液冲洗后,分别加入羊抗兔二抗(1∶2 000)室温孵育1 h。采用化学发光法检测PVDF膜上的目标蛋白信号,Tanon软件拍摄图像并分析。
三、统计学分析

结 果
一、高糖对GC-2spd细胞生长的影响
与对照组比较,高糖组存活小鼠精母细胞GC-2spd数量显著低于对照组(P<0.05),见图1。
二、高糖对GC-2spd细胞周期的影响
与对照组比较,高糖组G0/G1期小鼠精母细胞GC-2spd比例显著增高,G2/M期GC-2spd细胞比例显著降低(P<0.05);而S期小鼠精母细胞GC-2spd比例两组间无显著性差异(P>0.05),见图2。

图1 高糖对GC-2spd细胞生长的影响
三、高糖对GC-2spd细胞凋亡的影响
与对照组比较,高糖组小鼠精母细胞GC-2spd的早期凋亡率、晚期凋亡率均显著增高(P<0.05),见图3。

A:对照组GC-2spd细胞周期情况;B:高糖组GC-2spd细胞周期情况;C:流式细胞术检测GC-2spd细胞周期变化:与对照组比较,*P<0.05图2 流式细胞术检测高糖对GC-2spd细胞周期的影响

A:对照组GC-2spd细胞凋亡情况;B:高糖组GC-2spd细胞凋亡情况;C:流式细胞术检测GC-2spd细胞凋亡的变化:与对照组比较,*P<0.05图3 流式细胞术检测GC-2spd细胞凋亡情况
四、高糖对GC-2spd细胞中caspase凋亡蛋白表达的影响
与对照组比较,高糖组小鼠精母细胞GC-2spd中caspase3和caspase9 mRNA及活性蛋白相对表达量均显著增高(P<0.05),见图4。
五、高糖对GC-2spd细胞Notch通路相关基因表达的影响
与对照组比较,高糖组小鼠精母细胞GC-2spd中Notch、Jagged1、Hes1 mRNA及蛋白相对表达量均显著下调(P<0.05),见图5。
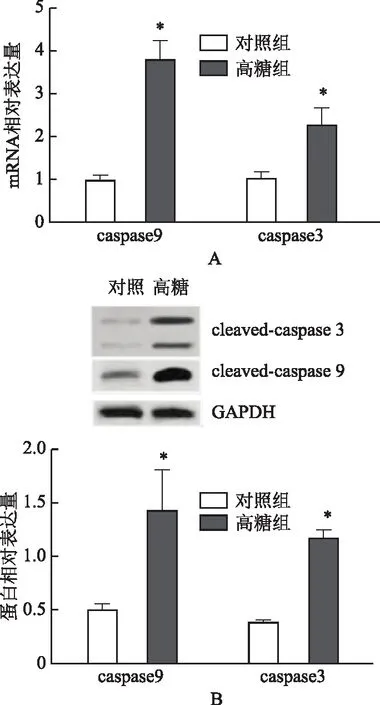
A:qRT-PCR检测GC-2spd细胞中caspase mRNA相对表达量;B:WB法检测GC-2spd细胞中caspase凋亡蛋白表达情况。与对照组比较,*P<0.05图4 高糖对GC-2spd细胞中caspase凋亡蛋白表达的影响

A:qRT-PCR检测GC-2spd细胞中Notch通路mRNA相对表达量;B:WB法检测GC-2spd细胞中Notch通路蛋白表达情况。与对照组比较,*P<0.05图5 高糖对GC-2spd细胞中Notch通路蛋白表达的影响
讨 论
精子发生过程起始于精原细胞,先经过有丝分裂增殖分化为初级精母细胞,后经过减数分裂最终分化为成熟精子[6]。初级精母细胞的凋亡对淘汰缺陷精子、维持成熟精子数量非常重要,其异常凋亡会导致精子发生障碍,影响生育能力,因此精母细胞存活情况和健康程度是决定精子质量的关键[7-8]。本研究采用终浓度为30 mmol/L葡萄糖的M16培养液模拟体内高糖环境,观察高糖对小鼠精母细胞GC-2spd增殖和细胞凋亡的影响,结果发现,与对照组比较,高糖作用24 h后,同一时间点高糖组小鼠精母细胞GC-2spd的OD值均显著降低(P<0.05),表明高糖作用后小鼠精母细胞GC-2spd生长速度显著减慢,提示高糖可抑制GC-2spd细胞生长。且高糖组G0/G1期GC-2spd细胞比例显著增高,G2/M期细胞比例显著降低(P<0.05),提示高糖可诱导GC-2spd细胞停滞在G0/G1期,阻止其进入G2/M期,抑制细胞增殖。表明高糖可阻滞细胞周期,使其失去分裂能力,影响细胞生长,但其具体机制尚不清楚。另有研究表明G0/G1期细胞增多与细胞凋亡密切相关[9-10],因此本研究进一步对高糖对GC-2spd细胞凋亡的影响进行研究。
精子存活率低与精母细胞异常凋亡密切相关。本研究发现,高糖作用后,GC-2spd细胞早、晚期凋亡率均显著高于对照组(P<0.05),表明高糖环境可促进GC-2spd细胞凋亡。细胞凋亡是机体自主调控的一种死亡过程,涉及一系列凋亡诱导因子和凋亡抑制因子的共同调节[11]。其中依赖caspase凋亡通路是主要的凋亡通路,一般情况下,细胞凋亡的执行者caspase3以前体的形式存在[12];当细胞接触到凋亡信号或刺激后,经过一系列的信号传导,引起caspase9大量表达,诱导Procaspase3裂解活化,启动细胞凋亡程序[13]。本研究中,高糖作用48 h后,caspase3、caspase9在小鼠精母细胞GC-2spd中mRNA及活性蛋白相对表达量均显著上调(P<0.05),提示高糖处理可诱导小鼠精母细胞caspase3凋亡通路活化,启动凋亡,但其机制尚不明确。
Notch信号通路的激活依赖于Notch基因编码的跨膜受体与其邻近细胞表面的配体相互结合,进而激活下游靶基因的转录和翻译,参与调节细胞增殖、分化和凋亡等生理生化过程[14]。目前已在哺乳动物中发现4种Notch基因编码的跨膜受体,分别为Notch 1、Notch 2、Notch 3、Notch 4以及dll1、dll3、dll4、Jagged1、Jagged2五种配体[15]。Yoon等[16]采用体外实验模拟高糖对血管生成过程的影响,发现高糖条件下,血管出现直径减小、生长和分支增加、不稳定性增加等,认为高糖可能抑制Notch1和Jagged1蛋白表达,导致异常血管生成。Zhang等[17]采用高糖处理H9c2细胞建立糖尿病心肌损伤模型,发现高糖可抑制Notch1蛋白在H9c2细胞中表达,抑制细胞增殖,诱导细胞凋亡,且Notch1过表达可抑制高糖诱导的心肌细胞凋亡。Allam等[18]研究发现,上皮性卵巢癌细胞中糖基化可通过促进Notch受体的活化状态,促进肿瘤细胞增殖和迁移,抑制Notch蛋白活化可促进肿瘤细胞凋亡,提示抑制糖基化水平可通过抑制Notch活化抑制卵巢癌细胞增殖,促进其凋亡。Wei等[19]研究报道,Notch1、Hes1等蛋白在高糖诱导的心肌细胞中低表达,松弛素可通过调节Notch通路抑制高糖诱导的心肌细胞凋亡,增加其生存能力。本研究结果发现,与对照组比较,高糖组GC-2spd细胞中Notch1、Jagged1、Hes1 mRNA和蛋白相对表达量均显著下调(P<0.05),表明高糖可抑制Notch信号通路活化,与Zhang等[17]在H9c2细胞中的发现一致。另有研究表明,Notch通路相关基因的异常激活可抑制细胞凋亡,促进细胞增殖,与糖尿病所致心肌梗死等多种疾病的发生相关[20],提示抑制Notch通路激活可能抑制细胞增殖、促进细胞凋亡。但高糖如何抑制Notch信号通路活化及该通路如何影响细胞增殖和凋亡的具体机制尚未阐明,有待进一步研究探讨。
综上所述,高糖可能通过抑制Notch信号通路活化抑制GC-2spd细胞增殖,促进其凋亡,提示Notch信号通路可能作为潜在靶标应用于糖尿病所致精子存活率低的临床治疗。
