利用染色质开放性测序技术探讨叶酸缺乏对胚胎干细胞基因组结构变化调控影响
2019-06-24谢秋李才华王滔孙正怡郁琦张霆
谢秋,李才华,王滔,孙正怡,郁琦,张霆
(1.中国医学科学院 北京协和医学院 北京协和医院,北京 100730;2.上海天昊生物,上海 200120;3. 首都儿科研究所,北京 100020)
真核生物染色体以核小体为单位进行致密折叠,同时部分染色质会呈现开放状态,这些开放结构通常作为特异性反式作用因子(如转录因子、酶等)和顺式作用元件(如增强子、隔离子等)与基因组DNA相关作用的活跃区域。染色体的开放程度用染色体可接近性(Chromatin Accessibility)来表示,该状态的变化会对基因表达调控、DNA复制和修复等产生重要影响。之前有研究报道的染色质开放性测序技术(Assay for Transposase Accessible Chromatin with high throughput sequencing,ATAC-seq)方法,利用高灵敏度的转座酶(Transposase,Tn5)在寻找染色质可接近位置的同时对染色体DNA进行片段化,细胞数量级在10的四次方即可[1-2]。因此对于数量有限的临床样本尤其适合,实验操作上更方便快捷,是一种创新的表观遗传学研究技术手段。流行病学研究表明围孕期叶酸缺乏是习惯性流产、出生缺陷发生的重要危险因素,补充叶酸能有效预防上述不良反应的发生[3-5]。越来越多的研究表明叶酸作为一碳单位的运载体作为甲基供体影响表观修饰调控[6-8]。本研究通过ATAC-seq技术研究叶酸代谢异常对小鼠胚胎干细胞(mouse embryonic stem cell,mESC)全基因组染色质开放程度的影响,为探索叶酸缺乏对早期胚胎发育表观编程影响提供初步的研究基础。
资料与方法
一、研究对象及试剂
1.研究对象:Sv/129 mESC细胞来源于北京宣武医院,采用高糖DMEM培养,含15% 胎牛血清、β-巯基乙醇、非必须氨基酸、谷氨酸及白血病抑制因子,培养在预先包被有2% 明胶的培养瓶或者培养板中,37℃、5%CO2培养箱传代培养,每隔2~3 d传代1次。
2.主要试剂:甲氨蝶呤(MTX,CalBiochem,美国);Tn5转座酶(北京MDTKBio);高保真PCR扩增试剂盒(Next High Fidelity 2×PCR Master Mix,NEB,美国);DNA文库制备试剂盒(Nextera DNA Sample Prep Kit,Illumina,美国);双末端簇生成试剂盒(v3-cBot-HS,Illumina,美国);核酸纯化试剂盒(AgencourtAMPure XP,Beckman Coulter,美国);核酸片段筛选试剂盒(AgencourtSPRIselect Reagent Kit,Beckman Coulter,美国)。
3.主要仪器:PCR仪(ABI2720,美国);低温离心机(Eppendorf 5810R,美国);核酸蛋白定量仪Qubit3.0(Thermo,美国);磁力架DynaMag(Thermo,美国);倒置显微镜ECLIPSETi(Nikon,日本);二代测序仪器Illumina Hiseq 2500(Illumina,美国)。
二、实验方法
1.细胞计数与裂解:分别使用叶酸浓度为4 mg/ml的正常叶酸培养基和终浓度为0.12 μM的MTX处理mESC 24 h(分别为正常对照组和MTX实验组),收集细胞。制备PBS重悬的单细胞悬液,0.4%台盼蓝染色后倒置相差显微镜下计数,取104个细胞至新的离心管;4℃低温500g离心5 min,小心弃去上清,用预冷的PBS洗涤1次;离心后重悬于50 μl预冷的Lysis buffer,轻柔吹打分散细胞;弃去上清,置于冰上准备转座反应。
2.转座反应与纯化:配制如下反应体系,吹打混匀后重悬上一步细胞核沉淀:5×reaction buffer 10 μl,Tn5 Enzyme 5 μl,ddH2O 35 μl。反应条件:37℃孵育30 min。使用纯化试剂盒纯化上一步产物,操作按试剂盒说明书进行;DNA洗脱液洗脱得到11 μl纯化产物。
3.PCR放大与纯化:对转座文库进行放大和添加样本特异的Index,配制如下反应体系:上一步转座DNA 11 μl,10 M Primer F 2 μl,10 M Barcoded Primer R 2 μl,NEBNextUltraTMII Q5Master Mi 15 μl。反应条件:72℃延伸5 min;98℃变性30 s(1个cycle);98℃变性10 s;63℃退火30 s;72℃延伸1 min(10个cycle);72℃延伸5 min;4℃冷却。使用纯化试剂盒纯化上一步产物,操作按试剂盒说明书进行;得到最终上机文库。
4.文库质控与上机:取1 μl文库使用Qubit3.0检测文库浓度;将不同文库按照等摩尔量混样按DNA文库制备试剂盒操作后上机至Illumina Hiseq平台,采用PE150模式测序。引物与接头信息见表1。

表1 文库构建引物与接头信息
*IIIIIIII为8 bp的Barcode信息
三、数据分析及统计学处理
测序得到的原始测序序列(raw reads或raw data),里面含有带接头的、低质量的reads,为了保证信息分析质量,必须对raw reads进行过滤,得到clean reads用于后续分析。利用trim_galore(http:∥www.bioinformatics.babraham.ac.uk/projects/trim_galore/)进行质量过滤[1,9],包括3个步骤:(1)去掉测序引物;(2)去掉末端低质量的reads;(3)去掉上述1和2步骤后片段<35 bp的reads。正常对照组和MTX实验组分别设置3个生物学重复,参照小鼠基因组mm10数据库进行生物信息学分析。
数值分析采用组间均数比较的单因素方差分析,组间计量资料的比较采用独立样本t检验,P<0.05表示差异有统计学意义。
结 果
一、Tn5转座酶消化mESC细胞
为了摸索适合的Tn5酶体系,我们选择两个酶浓度梯度,分别为5 U和7.5 U,具体标记见表2。
经历12个cycle扩增后,取少量产物进行琼脂糖电泳发现Tn5浓度为7.5 U,正常对照组转座酶消化后核小体周期条带明显优于5 U处理浓度,而对于MTX实验组转座酶5 U处理优于7.5 U处理,文库可见清晰的核小体周期条带(图1箭头所示)。

表2 Tn5酶体系摸索

采用5 U、7.5 U Tn5转座酶分别处理正常对照组、MTX实验组后检测核小体分布图1 Tn5转座酶消化产物经琼脂糖凝胶电泳质控
二、有效peak calling总数分析
使用MACS(http:∥liulab.dfci.harvard.edu/MACS/)软件[10]识别reads在参考基因组上的富集区域,即peak calling,作为候选的蛋白质结合位点(或表观修饰位点)。正常对照组peak calling数量明显多于MTX实验组,中位长度为302 bp(图2A);MTX实验组peak calling中位长度为271 bp(图2B),两组peak calling数量采用单因素方差分析具有统计学差异(P<0.01),提示MTX处理后mESC染色质可接近区域发生减少。
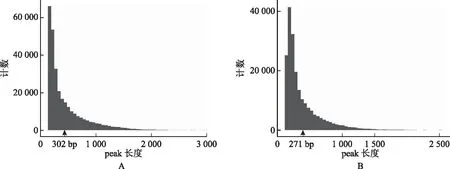
A:正常对照组peak calling计数及长度分布,黑色箭头示中位peak长度(bp);B:MTX实验组peak calling计数及长度分布,黑色箭头示中位peak长度(bp)图2 两组peak calling数量及长度分布示意图
三、差异peak calling基因本体论富集分析
基因本体论(Gene Ontology,GO)是基因功能国际标准分类体系,对目标区域基因进行筛选与分类富集。对正常对照组和MTX实验组差异peak calling进行GO富集分析比较,发现MTX处理后差异染色质开放区域主要集中胚胎器官形成、细胞周期调控、神经骨骼系统发育及生殖系统发育有关基因(表3)。

表3 差异peak相关区域GO富集显著性差异分析(Top 10)
四、差异peak相关基因KEGG富集分析
我们对差异peak相关基因进一步进行KEGG(Kyoto Encyclopedia of Genes and Genomes) Pathway分析,通过Pathway显著性富集分析能确定差异peak相关基因集合主要参与的生化代谢通路和信号转导通路。正常对照组和MTX实验组差异peak 相关基因显著性富集的pathway集中在 MAPK(mitogen-activated protein kinase)信号通路、细胞骨架调控、Rap1信号通路等(图3)。
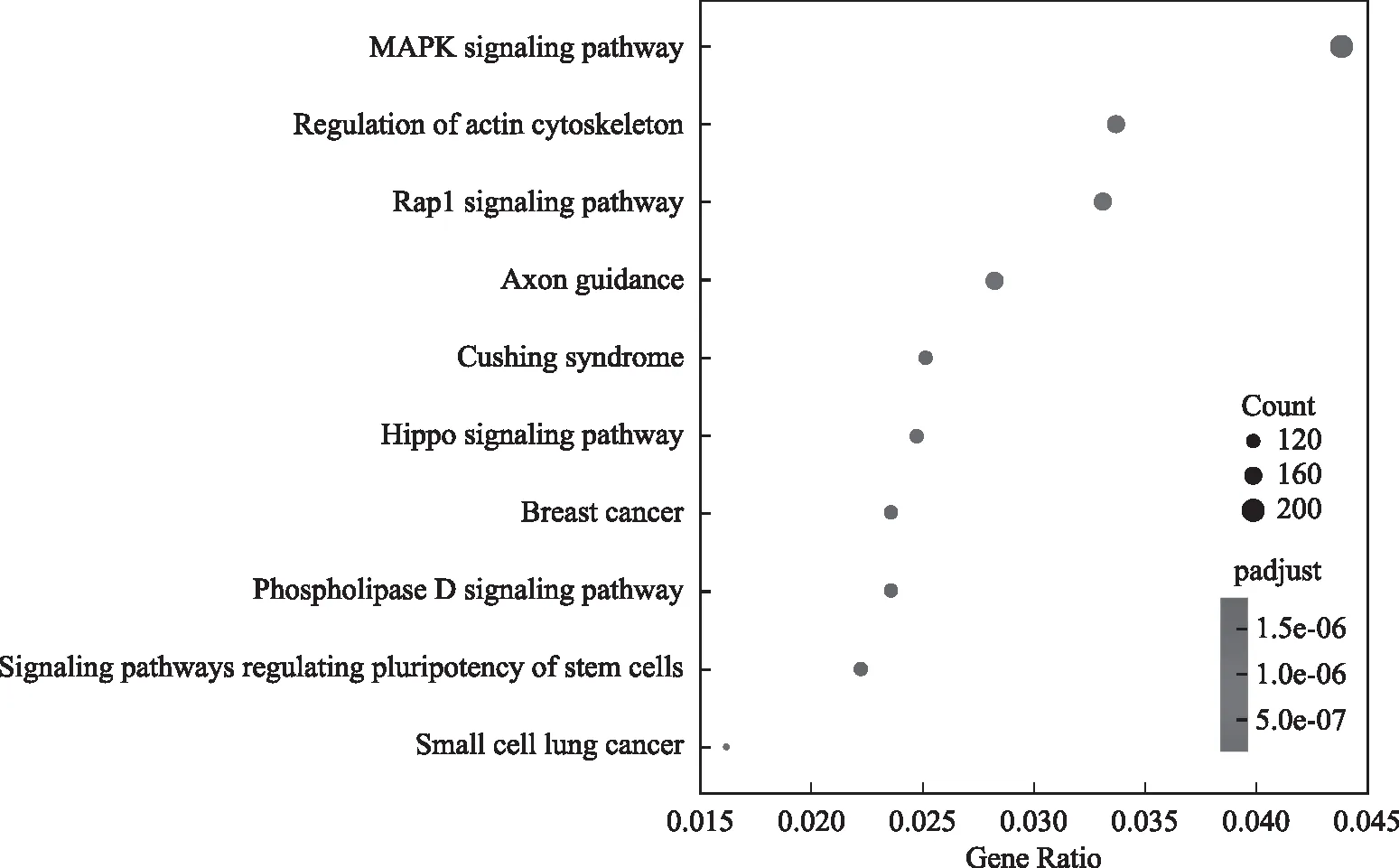
图3 差异peak相关基因KEGG富集分析
讨 论
目前现有的用于染色质开放区域捕获的技术手段包括利用脱氧核糖核酸酶DNase Ⅰ酶切基因组寻找高敏位点的DNase-seq(DNaseⅠhypersensitive sites,DHSs);利用有机溶剂甲醛对染色体裸露的DNA进行固定的FAIRE-seq(Formaldehyde-Assisted Isolation of Regulatory Elements with Sequencing)。这些方法对于细胞数量要求甚高,而且实验步骤繁琐。本研究利用二氢叶酸还原酶抑制剂MTX诱导叶酸代谢障碍作用胚胎干细胞,采用ATAC-seq发现全基因组染色质开放程度即发生明显变化,涉及基因尤以组织器官形成为主,提示叶酸代谢能够影响早期胚胎发育表观修饰调控。
2017《Development》通过ATAC-seq技术获得早期小鼠胚胎组织的全基因组顺式调控元件序列谱,并对预测增强子位点进行了功能鉴定,发现3个新的增强子序列对于小鼠神经板前后体轴的发育是必须的。通过分析motif,发现属于Smad蛋白家族成员的motif序列[11]。转录因子信号转导和转录激活因子-3(signal transducer and activator of transcription factor-3,STAT3)参与很多基因的表达与调控,并与其他转录因子形成复杂的网络调控。Fujitani等[12]发现在哺乳动物前脑发育时期即有JAT/STAT蛋白表达,进一步检测发现在妊娠14.0~18.0 d大鼠胚胎的大脑皮质、纹状体、基底前脑和海马都有STAT3的表达,而STAT3敲除的鼠胚胎发育至妊娠6.5 d就退化,提示STAT3对于胚胎早期的发育是必要的。对小鼠胚胎的研究发现,妊娠9.5 d时,STAT3在脑区有高水平的表达,此时间点恰好为神经系统发育的重要时期。推辞STAT3可能参与神经管闭合的关键信号通路调节[13]。ATAC-seq研究揭示STAT3通过结合染色质开放区域调控位点能够与KLF6基因启动子区形成loop环状结构,协同促进神经突触的发育与生长,决定中枢神经系统神经前体细胞的分化命运[14]。Fullard等[15]通过ATAC-seq技术建立了成人大脑(神经元,非神经元)的可接近性染色质图谱,绘制了5个个体14个不同大脑区域的染色质开放性结构域,神经元较非神经元具有更高的染色质开放区,意味着此处有更多的顺式调控元件存在,参与基因表达调控。纹状体神经元会存在特殊的染色质开放区域,具有识别分子途径和生物功能差异。通过motif分析,鉴定出大脑区域特异性蛋白编码序列及长链非编码RNA。本研究ATAC-seq证实叶酸代谢障碍下的mESC染色质可接近性与正常叶酸培养相比,其开放程度呈下降趋势,提示调控因子结合位点发生改变,可能影响早期胚胎发育进程重编程。因此我们推测叶酸缺乏可能通过改变染色质可接近性影响组织器官命运分化,决定细胞命运分化,但其具体调控机制尚待进一步研究探讨。
