黄素化颗粒细胞分离提纯方法的比较研究
2019-06-24周小丹罗金漆倩荣谢青贞钟方圆梅忆媛张祎明
周小丹,罗金,漆倩荣,谢青贞,钟方圆,梅忆媛,张祎明
(武汉大学人民医院生殖医学中心,湖北省辅助生殖与胚胎发育医学临床研究中心,武汉 430060)
卵泡是卵巢的基本功能单位,而颗粒细胞是附着在卵泡腔卵母细胞周围,构成卵泡的最大细胞群,是卵巢分泌甾体激素的主要功能细胞。颗粒细胞通过间隙链接和旁分泌因子影响卵泡及卵母细胞的生长、发育、成熟[1-2]。目前,已有不同研究报道分离提取人卵巢颗粒细胞的各种方法,但结论并不一致。国内有部分研究提出了使用红细胞裂解法[3-4],但是国外多数实验研究仍以密度梯度离心法作为基本方法[5-6],两者各具优、缺点。因此,如何有效提取原代颗粒细胞仍是实验研究的基础,本文分别选择这两种方法及联合这两种方法进行提取人卵巢颗粒细胞,从细胞获取量、存活率、贴壁及细胞生长情况进行比较,为建立分离培养颗粒细胞方法提供更多选择和依据。
材料和方法
一、研究对象
选取2018年3~4月在我院生殖中心接受IVF-ET治疗的20例患者。纳入标准:年龄21~38岁;月经第2~3天基础性激素水平正常;月经第3天窦状卵泡数在6~20个之间;因输卵管梗阻或男方因素导致不育;获卵数>6枚;采卵前阴道分泌物霉菌、滴虫检查正常。所有患者均采用黄体期长方案降调节,采卵日收集穿刺取卵和捡卵后废弃的卵泡液。本研究获本院伦理委员会批准,所有患者均签署知情同意书。
主要试剂:DMEM/F12培养基购自美国Hyclone公司;红细胞裂解液、Percoll分离液购自武汉Biosharp公司;胎牛血清购自新西兰Gibco公司;台盼蓝购自福州迈新生物技术开发有限公司;胰酶、PBS缓冲液购自杭州吉诺生物医药技术有限公司;免疫组化染色试剂盒购自北京博奥森生物技术有限公司;FSHR抗体购自美国Santa Cruz公司;CCK8试剂盒购自日本同仁。
二、方法
1.材料收集:收集我院采卵患者在B超下经阴道穿刺卵泡获得的卵泡液,以300g离心10 min,取沉淀用PBS液充分混匀,平分3份提取人卵巢黄素化颗粒细胞。
2.分离纯化:(1)密度梯度离心法:5 ml沉淀用PBS配成悬液,以1∶1的比例将细胞悬液缓慢加入到50%Percoll分离液上,以1 800 r/min离心20 min,用巴氏吸管小心吸取中间白色颗粒细胞层,用PBS洗涤1遍,重复上述步骤一次,留取沉淀待消化。(2)红细胞裂解法:5 ml沉淀加入3倍体积的红细胞裂解液,37℃孵育5 min后离心,弃上清,若沉淀仍有红色,可重复上述步骤一次。最后用PBS洗涤1遍,离心弃上清,留取沉淀待消化。(3)密度梯度离心法+红细胞裂解法:5 ml沉淀用PBS配成悬液,以1∶1的比例将细胞悬液缓慢加入到50%Percoll分离液上,离心,吸取中间白色颗粒细胞层,加入PBS洗涤1次,后按上述红细胞裂解法进行操作,留取沉淀待消化。(4)消化:将沉淀的黏液团通过200目过滤网过滤,后加入胰酶,轻轻吹打混匀,室温消化5~10 min以获取单细胞悬液。然后加入含血清培养基终止消化,离心弃上清,用PBS洗涤1次,留取细胞沉淀待用。
3.细胞计数及存活率检测:用含10%胎牛血清、1%青霉素和1%链霉素DMEM/F12培养液(与后文所提培养液一致)重悬细胞,吸取100 μl重悬的颗粒细胞到一塑料EP管内,加入等体积台盼蓝染色液,轻轻混匀,染色5 min后,用血细胞计数板计数。存活率计算公式:活细胞率=(细胞总数-蓝染细胞数)/细胞总数。
4.细胞培养:调整细胞密度为2×105/ml,接种于96孔板,每孔200 μl,设3个复孔,置于37℃、5%CO2培养箱中孵育,用于CCK8测细胞生长曲线。另取细胞沉淀,调整细胞密度为1×106/ml,接种到放置有盖玻片的12孔板中培养,48 h后换液1次,培养72 h后用于颗粒细胞鉴定。
5.人卵泡颗粒细胞的鉴定:颗粒细胞是女性体内唯一表达卵泡刺激素受体(FSHR)的细胞[7],本研究采用以FSHR表达作为鉴定颗粒细胞的标准:(1)FSHR免疫组织化学染色:颗粒细胞接种于细胞爬片培养72 h后,细胞爬片用PBS冲洗5 min×3次;4%多聚甲醛固定5 min,PBS冲洗5 min×3次;0.1%Triton通透化处理5 min,3%H2O2去离子水孵育10 min,PBS洗涤5 min×3次;滴加正常山羊血清,孵育15 min,倾去;孵育一抗FSHR兔多克隆抗体(1∶200),4℃过夜,PBS洗涤5 min;HRP标记的二抗37°孵育45 min,PBS洗涤3 min×3次;用DAB溶液显色,自来水充分冲洗;苏木素复染10 min,盐酸酒精分色,常规梯度酒精脱水,二甲苯透明,中性树脂封片。用PBS代替一抗作为阴性对照。(2)FSHR免疫组织荧光染色:细胞固定及通透化处理同免疫组织化学过程相同,通透化处理后用PBS洗涤5 min×3次;滴加适量山羊血清封闭,孵育15 min,倾去;一抗FSHR兔多克隆抗体(1∶200)孵育,4℃过夜,PBS洗涤5 min×3次;孵育荧光二抗(按1∶200稀释)1 h,PBS洗涤5 min×3次;用DAPI染色液染核5 min,PBS洗涤5 min×3次;抗荧光淬灭封片剂封片,后于荧光显微镜下观察。
6.细胞体外生长曲线:96孔板培养的颗粒细胞分别在孵育后24 h、48 h、72 h、96 h后每孔加入20 μl CCK8溶液,继续孵育1.5 h。置Rayto酶联免疫检测仪(Perkin Elmer公司,美国)上测定450 nm双波长处吸光度值(OD值),取3孔OD平均值;以培养时间为横轴、OD值为纵轴,绘制细胞生长曲线。
三、统计学分析

结 果
一、3种分离方法所得颗粒细胞数及存活率
红细胞裂解法获得的颗粒细胞数为(8.3±3.0)×106/ml,显著多于密度梯度离心+红细胞裂解法的(3.3±2.2)×106/ml和密度梯度离心法的(2.1±1.6)×106/ml(P<0.05),密度梯度离心+红细胞裂解法得到的细胞数稍多于密度梯度离心法,但两者比较无显著性差异(P>0.05)。台盼蓝染色后,发现2次密度梯度离心法和密度梯度离心法+红细胞裂解法获得的细胞活率均>90%,而红细胞裂解法获得的细胞活率为80%~90%。
二、颗粒细胞形态特征及生长状态
颗粒细胞培养48 h后换液,倒置显微镜下观察,发现颗粒细胞呈多突形或梭形,部分黏成一团,胞内可见黑色颗粒,有部分未贴壁颗粒细胞和少量的红细胞分散漂浮。密度梯度离心法的贴壁细胞伸出细长伪足,紧密相连,细胞核大,圆形,胞质颗粒均匀丰富,生长旺盛,周边围绕着少量未贴壁的细胞(图1A)。密度梯度离心法+红细胞裂解法较密度梯度离心法获得的细胞贴壁数目少,周边围绕的未贴壁细胞数目略多(图1B)。红细胞裂解法的细胞贴壁数目最少,体积细长,伸出伪足数目少,细胞多分散生长,周边围绕多数仍未贴壁的细胞(图1C)。
三、颗粒细胞鉴定
以FSHR表达作为鉴定颗粒细胞的标准,免疫组织化学染色后,镜下观察到阳性细胞表现为细胞膜和胞质呈棕褐色着染,FSHR阴性对照组表现为胞膜和胞质呈深蓝色着染,镜下可见FSHR阳性率均>90%(图2),说明3种不同分离方法获取的颗粒细胞纯度达到90%以上。此外,细胞免疫荧光染色方法均检测到FSHR阳性表达,胞质呈红染,颗粒细胞阳性率均>90%(图3),说明3种方法分离提纯的颗粒细胞纯度也均达到90%以上。

A:密度梯度离心法;B:密度梯度离心法+红细胞裂解法;C:红细胞裂解法图1 不同分离方法提取的原代颗粒细胞48 h后的生长状态(×200)

A:密度梯度离心法;B:密度梯度离心法+红细胞裂解法;C:红细胞裂解法;D:FSHR阴性对照图2 体外原代颗粒细胞FSHR免疫组织化学染色结果(×200)

A:密度梯度离心法;B:密度梯度离心法+红细胞裂解法;C:红细胞裂解法图3 体外原代颗粒细胞FSHR免疫荧光染色(×200)
四、颗粒细胞体外生长曲线
3种方法分离提纯得到的颗粒细胞,采用CCK8方法检测并绘制生长曲线图,发现培养24 h后密度梯度离心法获得的颗粒细胞贴壁量多于其他两种方法,继续培养有明显的细胞增殖,且细胞存活量均高于其他两种方法。而红细胞裂解法获得的颗粒细胞培养24 h后细胞贴壁量最少且无明显细胞增殖(图4)。
五、颗粒细胞传代后的贴壁、生长状态
在倒置显微镜下观察,密度梯度离心法提取的颗粒细胞传代前(图5A)和传代24 h后(图5B)细胞形态发生改变,传代后的细胞贴壁数目极少,体积小于传代前的细胞形态,多数未见明显细长伪足,伸展差,细胞分散生长,并未相互连接、抱团,周边围绕多数未贴壁和凋亡的颗粒细胞。
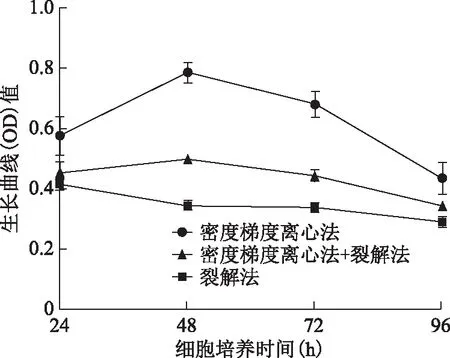
图4 不同分离方法的颗粒细胞生长曲线

A:传代前;B:传代后图5 密度梯度离心法提取的原代颗粒细胞传代前及传代后24 h的生长状态(×200)
讨 论
人卵巢颗粒细胞作为卵巢的最大细胞群,与生殖内分泌功能密切相关,对研究卵母细胞的成熟机制、女性生殖功能、卵巢肿瘤等具有重要的临床研究意义[8-9]。因此,如何有效分离获取体外人卵巢颗粒细胞是各种实验开展的基础。目前,国内外已有文献报道的人卵巢颗粒细胞分离提纯的方法,主要有红细胞裂解法和密度梯度离心法。有研究认为红细胞裂解法是分离提纯的最佳选择[10],其获取的颗粒细胞数目远多于密度梯度离心法,且分泌功能无显著差异。但国外研究以密度梯度离心法作为分离、提纯原代颗粒细胞的主要选择[11-13]。以往研究多偏重于比较不同方法获取的细胞数量、活率及实验效率,很少侧重于对细胞贴壁、生长及传代后的影响。因此,本研究旨在比较并结合这两种方法的优缺点进行分析,为原代颗粒细胞体外实验提供最佳的分离选择方法。
收集的卵泡液中主要混杂红细胞以及少量白细胞、上皮细胞等。红细胞裂解法通过裂解红细胞从而获取纯度相当的颗粒细胞;密度梯度离心法则根据不同细胞比重的差异,借助分离液和离心对细胞进行分离纯化,但有部分颗粒细胞与红细胞黏连而沉于管底,故获取的细胞数目少于裂解法。实验结果比较发现3种方法中红细胞裂解法提取的细胞数目最多,但活率最低;密度梯度离心法虽然获取细胞数量最低,但活率高;红细胞裂解法+密度梯度离心法的获取效果处于这两种方法之间,但其细胞量仍远低于红细胞裂解法。卵巢颗粒细胞是附着于卵泡腔面的复层立方上皮细胞,贴壁能力弱,其贴壁数目决定着细胞未来生长数目。本研究采用密度梯度离心法提取的细胞培养48 h后贴壁数目最多,生长状态最佳,而红细胞裂解法获取的细胞数目最低,状态最差;红细胞裂解法+密度梯度离心法获取的颗粒细胞生长状态亦处于这两者之间。基于FSHR在颗粒细胞的特有表达,培养72 h后进行颗粒细胞鉴定,3种方法提取的细胞纯度均达到90%以上。本研究中3种分离方法的细胞贴壁状态提示红细胞裂解参与的次数越多,细胞的活性和贴壁状态可能越差;且红细胞裂解法获取的颗粒细胞生长曲线呈逐渐下降趋势,提示颗粒细胞数目在培养过程中逐渐减少,可能是红细胞裂解液或红细胞裂解碎片对细胞活性产生了负面作用,此结论与江欢等[14]人的研究结果相似。相比之下,密度梯度离心法获取的颗粒细胞24 h后贴壁增殖,并在培养48 h后达到生长高峰,72 h后逐渐出现凋亡,这与颗粒细胞在人体内的变化趋势相一致,说明该方法对细胞生长影响较小;但也有研究认为密度梯度离心后的细胞贴壁不佳,状态稍差[3],推测这可能是由于实验过程中选择的离心率过大,造成细胞损伤从而影响细胞活率及贴壁生长状态。此外,本研究对密度梯度离心法获取的颗粒细胞进行传代培养,发现和传代前相比,传代后的细胞贴壁数目少、种类单一且细胞形态发生变化。因此,从细胞状态和数量考虑,传代后的颗粒细胞并不适合体外细胞实验研究,传代后的颗粒细胞是否保持原有的细胞功能特性,是否能满足人原代颗粒细胞体外实验条件仍需进一步研究。
体外细胞实验最终的实验对象主要是贴壁的卵巢颗粒细胞,因此,从最终贴壁的细胞数目和生长状态考虑,本研究认为密度梯度离心法是分离纯化颗粒细胞最佳的选择方法,红细胞裂解法+密度梯度离心法并没有显示更好的优点。即使为了进一步分离混杂的白细胞,以获取更高纯度的颗粒细胞,密度梯度离心法也是初步分离条件方法的基础[15]。因此,本研究为进行体外原代颗粒细胞实验方法的选择,提供了可靠依据。
